辽宁省抚顺市六校协作体2022-2023学年高三上学期期中考试化学试题
试卷更新日期:2022-12-14 类型:期中考试
一、单选题
-
1. 中华文化源远流长、博大精深,云南省馆藏文物是中华文化的重要代表。下列文物主要是由硅酸盐材料制成的是( )
文物




战国牛虎铜案
溪山行旅图
西汉滇王编钟
新石器时代鸡形陶壶
选项
A
B
C
D
A、A B、B C、C D、D2. 《明会典》中记载:“嘉靖中则例,通宝钱六百万文,合用二火黄铜四万七千二百七十二斤……”这里黄铜是铜锌合金。下列说法错误的是( )A、锌、铜均位于元素周期表的区 B、在铜、锌中,第二电离能与第一电离能相差较大的是锌 C、在潮湿空气中,与黄铜中的铜相比,纯铜中的铜更容易被腐蚀 D、用黄铜不用铁铸造“通宝钱”,主要因为黄铜的化学性质比铁稳定3. 在酸性或者接近中性的条件下,易发生歧化反应,将通入溶液中,其反应为。下列有关说法错误的是( )A、的空间结构为三角锥形 B、中心原子的杂化方式是sp C、基态钾原子的价电子排布式: D、基态的价电子轨道表示式: 4. 设为阿伏加德罗常数的值,下列说法正确的是( )A、16.9g过氧化钡()固体中阴、阳离子总数为0.2 B、溶液中,氢原子数目为2 C、标准状况下,22.4L氯气与56g铁充分反应,转移的电子数为3 D、密闭容器中和充分反应后,容器中分子数为25. 奥地利物理学家Boltzmann首次将熵与混乱度定量地联系起来,即[k为Boltzmann常数;为混乱度(即微观状态数),也粗略地看作空间排列的可能性数目]。在常温常压下,下列反应是熵增反应的是( )A、 B、 C、 D、6. 化学创造美好生活。下列生产或探究活动中,相关操作或事实合理且对应的离子方程式正确的是( )A、用过量氨水吸收烟道气中的: B、用白醋除铁锈: C、向混有少量的溶液中通入少量氯气除杂: D、用稀硝酸除去银镜实验中附着在试管内壁的银单质:7. 化学与生活息息相关,下列有关说法正确的是( )A、二氧化硫有毒,严禁将其添加到任何食品饮料中 B、维生素C具有氧化性,可在人体内起抗氧化作用 C、泡沬灭火哭可用于扑救一般的起火,也适用于扑救电器起火 D、含钠、铜、钙金属元素的化合物均可使火焰呈现出不同的颜色8. 下列实验操作规范且能达到实验目的的是( )
4. 设为阿伏加德罗常数的值,下列说法正确的是( )A、16.9g过氧化钡()固体中阴、阳离子总数为0.2 B、溶液中,氢原子数目为2 C、标准状况下,22.4L氯气与56g铁充分反应,转移的电子数为3 D、密闭容器中和充分反应后,容器中分子数为25. 奥地利物理学家Boltzmann首次将熵与混乱度定量地联系起来,即[k为Boltzmann常数;为混乱度(即微观状态数),也粗略地看作空间排列的可能性数目]。在常温常压下,下列反应是熵增反应的是( )A、 B、 C、 D、6. 化学创造美好生活。下列生产或探究活动中,相关操作或事实合理且对应的离子方程式正确的是( )A、用过量氨水吸收烟道气中的: B、用白醋除铁锈: C、向混有少量的溶液中通入少量氯气除杂: D、用稀硝酸除去银镜实验中附着在试管内壁的银单质:7. 化学与生活息息相关,下列有关说法正确的是( )A、二氧化硫有毒,严禁将其添加到任何食品饮料中 B、维生素C具有氧化性,可在人体内起抗氧化作用 C、泡沬灭火哭可用于扑救一般的起火,也适用于扑救电器起火 D、含钠、铜、钙金属元素的化合物均可使火焰呈现出不同的颜色8. 下列实验操作规范且能达到实验目的的是( )选项
A
B
C
D
操作


实验目的
制备氢氧化铁胶体
定容
除去中的少量HCl
制备并收集
A、A B、B C、C D、D9. 氮及其化合物在生产生活中具有广泛的应用。在给定条件下,下列选项所示物质间的转化能实现的是( )A、 B、 C、 D、10. 某混合物可能含有Al、Cu、、 , 为探究该混合物成分,某兴趣小组设计如图分析方案。下列分析错误的是( )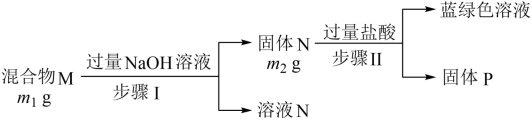 A、固体P一定是纯净物 B、若 , 则原混合物中可能含有Al C、蓝绿色溶液中一定含有的金属阳离子为、 D、向溶液N中通入足量的 , 一定可观察到有白色沉淀生成11. 类推的思维方法在化学学习与研究中有时会产生不符合题意结论,因此类推的结论最终要经过实验的检验,才能确定其符合题意与否。下列类推结论中正确的是( )A、极易溶于水,也极易溶于水 B、为分子晶体,也为分子晶体 C、是非极性分子,也是非极性分子 D、分子的空间结构为直线形,分子的空间结构也为直线形12. 现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成 , 型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )
A、固体P一定是纯净物 B、若 , 则原混合物中可能含有Al C、蓝绿色溶液中一定含有的金属阳离子为、 D、向溶液N中通入足量的 , 一定可观察到有白色沉淀生成11. 类推的思维方法在化学学习与研究中有时会产生不符合题意结论,因此类推的结论最终要经过实验的检验,才能确定其符合题意与否。下列类推结论中正确的是( )A、极易溶于水,也极易溶于水 B、为分子晶体,也为分子晶体 C、是非极性分子,也是非极性分子 D、分子的空间结构为直线形,分子的空间结构也为直线形12. 现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成 , 型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( ) A、简单离子半径:Y<T<Z B、最高价氧化物对应水化物的酸性:R<T C、R、Y、T三种元素形成的氢化物中,沸点最高的是Y的氢化物 D、由X、Y、R三种元素组成的常见化合物均能与金属钠反应13. 天然海水中主要含有等离子。火力发电时燃煤排放的含的烟气可利用海水脱硫,其工艺流程如图所示。下列说法错误的是( )
A、简单离子半径:Y<T<Z B、最高价氧化物对应水化物的酸性:R<T C、R、Y、T三种元素形成的氢化物中,沸点最高的是Y的氢化物 D、由X、Y、R三种元素组成的常见化合物均能与金属钠反应13. 天然海水中主要含有等离子。火力发电时燃煤排放的含的烟气可利用海水脱硫,其工艺流程如图所示。下列说法错误的是( ) A、“氧化”时,溶液的pH减小 B、“反应、稀释”时会有气体放出,此气体为 C、天然海水呈弱碱性的原因之一: D、实验中,可用饱和溶液除去中的杂质14. 一种贵金属磷化物晶体的晶胞结构如图所示。已知晶胞参数为a nm,设为阿伏加德罗常数的值。下列说法正确的是( )
A、“氧化”时,溶液的pH减小 B、“反应、稀释”时会有气体放出,此气体为 C、天然海水呈弱碱性的原因之一: D、实验中,可用饱和溶液除去中的杂质14. 一种贵金属磷化物晶体的晶胞结构如图所示。已知晶胞参数为a nm,设为阿伏加德罗常数的值。下列说法正确的是( ) A、晶体中与P距离最近的Rh的数目为8 B、晶体的密度为 g⋅cm C、晶胞中Rh的配位数为8 D、晶胞中,若A处原子分数坐标为(0,0,0),则B处原子分数坐标为( , 0,)15. 常温下,向20.00 mL 0.10 mol⋅L溶液中滴加0.10 mol⋅L的NaOH溶液,溶液中的()随pH的变化关系如图所示(已知)。下列说法错误的是( )
A、晶体中与P距离最近的Rh的数目为8 B、晶体的密度为 g⋅cm C、晶胞中Rh的配位数为8 D、晶胞中,若A处原子分数坐标为(0,0,0),则B处原子分数坐标为( , 0,)15. 常温下,向20.00 mL 0.10 mol⋅L溶液中滴加0.10 mol⋅L的NaOH溶液,溶液中的()随pH的变化关系如图所示(已知)。下列说法错误的是( ) A、图中a点的Y值为1.8 B、溶液中水的电离程度:c>b>a C、常温下,的电离常数 D、当加入10.00 mL NaOH溶液时,
A、图中a点的Y值为1.8 B、溶液中水的电离程度:c>b>a C、常温下,的电离常数 D、当加入10.00 mL NaOH溶液时,二、填空题
-
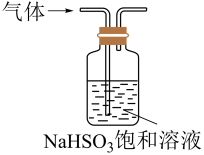
16. 硫化氢广泛存在于燃气及废水中,热分解或氧化硫化氢有利于环境保护并回收硫资源。回答下列问题:(1)、写出的电子式:。(2)、与溶液反应可生成两种酸式盐,该反应的离子方程式为。(3)、氯气可用于除去废水中 , 写出反应的化学方程式:。(4)、将含尾气的空气按一定流速通入酸性溶液中,可实现含尾气的空气脱硫。在溶液吸收的过程中也发生了反应 , 溶液中的及被吸收的随时间t的变化如图所示。

①时刻前,溶液中减小速率较快,时刻后,溶液中基本不变,其原因是。
②预测时刻后,的物质的量变化趋势,并在图中补充完整。
(5)、科学家设计出质子膜燃料电池,实现了利用废气资源回收能量并得到单质硫。质子膜燃料电池的结构如图所示。
①电极b极为(填“正极”或“负极”),写出该电极的电极反应式:。
②电池工作时,经质子膜进入(填“a极”或“b极”)区。
三、综合题
-
17. 水合肼()常用作航天器燃料,也广泛应用于医药生产。实验室制取水合肼并模拟处理铜氨溶液回收铜粉的实验流程如图:
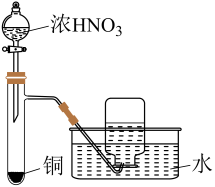
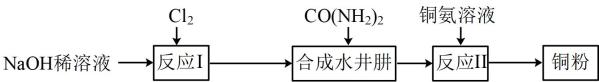 (1)、“反应Ⅰ”中温度升高时易产生副产物。若要提高NaClO产率,可采取的措施有(任写一点)。(2)、实验室常采用固体和浓盐酸在加热条件下制备氯气,该反应的化学方程式为。(3)、“合成水合肼”的过程中,理论上尿素与NaClO的物质的量之比为1∶1,实际操作时,尿素的用量一般比NaClO的略大,其原因可能是。(4)、向硫酸铜溶液中逐滴加入氨水至过量,可观察到的实验现象为;在铜氨中,配体为 , 配位数为。(5)、由铜氨废液回收铜粉的实验方案如下:收一定量水合肼溶液,加入适量蒸馏水稀释,再滴加适量NaOH溶液,边搅拌边逐滴加入铜氨废液,加热使其充分反应,同时用稀硫酸吸收反应中放出的 , 直至溶液中无气泡产生,停止滴加,静置、过滤、洗涤、干燥。反应中水合肼被氧化,生成和水,写出水合肼还原铜氨的离子方程式:。18. 某小组设计实验探究铜和浓硫酸反应的产物,装置如图所示。
(1)、“反应Ⅰ”中温度升高时易产生副产物。若要提高NaClO产率,可采取的措施有(任写一点)。(2)、实验室常采用固体和浓盐酸在加热条件下制备氯气,该反应的化学方程式为。(3)、“合成水合肼”的过程中,理论上尿素与NaClO的物质的量之比为1∶1,实际操作时,尿素的用量一般比NaClO的略大,其原因可能是。(4)、向硫酸铜溶液中逐滴加入氨水至过量,可观察到的实验现象为;在铜氨中,配体为 , 配位数为。(5)、由铜氨废液回收铜粉的实验方案如下:收一定量水合肼溶液,加入适量蒸馏水稀释,再滴加适量NaOH溶液,边搅拌边逐滴加入铜氨废液,加热使其充分反应,同时用稀硫酸吸收反应中放出的 , 直至溶液中无气泡产生,停止滴加,静置、过滤、洗涤、干燥。反应中水合肼被氧化,生成和水,写出水合肼还原铜氨的离子方程式:。18. 某小组设计实验探究铜和浓硫酸反应的产物,装置如图所示。
已知:①(棕色);
②都是难溶于水、难溶于稀硫酸的黑色固体。
实验中,观察到B中红色溶液变无色,C中产生白色沉淀,D中溶液变棕色。铜粉完全反应后,观察到烧瓶底部有灰白带黑色固体。
(1)、B装置作用是。(2)、探究C中白色固体成分。过滤C中混合物,得到滤液和白色固体。猜想1:白色固体是;
猜想2:白色固体是(填化学式);
猜想3:白色固体是和。
为了确认白色固体成分,取少量白色固体于试管中,加入足量盐酸,白色固体不溶解且无气泡生成。由此推知,猜想(填数字)合理。
(3)、结合(2)的结论,分析C中的化学反应可能有两种情况:①若过量或恰好完全反应,则发生的离子反应为;若少量,则发生的离子反应为。
②设计实验证明C中盛装的是否过量:。
(4)、实验完毕后,分离A中烧瓶里的混合物并探究其成分:①分离应选择的合理操作是(填标号),过滤,得到蓝色溶液和黑色固体。
a.向混合物中加入蒸馏水,搅拌,静置
b.将混合物倒入盛有水的烧杯中,搅拌,静置
②黑色固体不可能是(填标号),判断依据是。
A. B. C.
③探究上述黑色固体成分。

取所配制的溶液于锥形瓶中,滴几滴试剂R,用的标准溶液滴定至终点,消耗滴定液。R是(填名称)。根据上述相关实验结果,X是(填化学式)。
19. 的捕集、利用与封存成为科学家研究的重要课题。催化重整对温室气体的减排具有重要意义,其反应为。回答下列问题:(1)、已知:Ⅰ. kJ⋅molⅡ. kJ⋅mol
Ⅲ. kJ⋅mol
则的 kJ⋅mol , 该反应在(填“高温”、“低温”或“任意温度”)条件下自发。
(2)、将原料按初始组成充入密闭容器中,恒温条件下,保持体系压强为100 kPa发生反应,经过10min,反应达到平衡,此时的体积分数为30%。①则0∼10min内,kPa⋅min ,该温度下,此反应的平衡常数 (kPa)2(以分压表示,结果保留一位小数)。
②上述条件下,下列情况能说明反应一定达到平衡状态的是 (填标号)。
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内
D.单位时间内,断开键的数目和断开键的数目相同
(3)、900℃下,将和的混合气体(投料比1∶1)按一定流速通过盛有炭催化剂的反应器,测得的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)
由图可知,75 min后转化率与炭催化剂目数的关系为 , 原因是。
-