河南省名校联盟2022-2023学年高一上学期期中考试化学试题
试卷更新日期:2022-12-14 类型:期中考试
一、单选题
-
1. 很多美轮美奂的自然现象都与胶体的形成有关,例如天上的云朵、雨后的彩虹等。鉴别胶体的最佳方法是( )A、丁达尔效应 B、观察颜色 C、观察状态 D、闻气味2. 古文化富载化学知识。下述变化中涉及氧化还原反应的是( )A、以灰淋汁,取碱浣衣 B、曾青涂铁,铁赤如铜 C、浓酒和糟入甑,蒸令气上 D、侯潮一过,明月天睛,半日晒出盐霜3. 实验图标是保证实验人员安全的重要措施,起到安全防范警示等作用。下列实验图标能说明该实验过程中会产生有毒气体或产生烟、雾的是( )A、
 B、
B、 C、
C、 D、
D、 4. 为了使我们的美食变得色、香、味俱全,烹饪时必不可少添加一些食品调味剂。下列食品添加剂中的化合物不属于电解质的是( )A、食盐中的氯化钠(NaCl) B、食醋中的醋酸() C、白砂糖中的蔗糖() D、碱面中的苏打()5. 实验室为了延长试剂的保质期,对不同试剂会采用不同的保存方式,下列试剂的保存方法错误的是( )A、新制氯水避光保存 B、少量钠保存在煤油中 C、氢氧化钠密封保存 D、过氧化钠保存在水中6. 北宋著名画家王希孟所画的《千里江山图》是中国的十大传世名画之一,此画用到了一种矿物颜料——石青[]。下列说法正确的是( )
4. 为了使我们的美食变得色、香、味俱全,烹饪时必不可少添加一些食品调味剂。下列食品添加剂中的化合物不属于电解质的是( )A、食盐中的氯化钠(NaCl) B、食醋中的醋酸() C、白砂糖中的蔗糖() D、碱面中的苏打()5. 实验室为了延长试剂的保质期,对不同试剂会采用不同的保存方式,下列试剂的保存方法错误的是( )A、新制氯水避光保存 B、少量钠保存在煤油中 C、氢氧化钠密封保存 D、过氧化钠保存在水中6. 北宋著名画家王希孟所画的《千里江山图》是中国的十大传世名画之一,此画用到了一种矿物颜料——石青[]。下列说法正确的是( ) A、石青是一种白色固体 B、石青易溶于水 C、能用酸性液体清洗画卷上的污垢 D、高温下石青能分解生成黑色固体7. 工业生产中可通过一系列反应制备重要的化工原料。下列化工原料的制备过程中必须加入氧化剂才能实现的是( )A、从铁矿石中冶炼金属铁 B、工业上通过氮气合成氨气 C、工业上通过硫黄(硫单质)制备硫酸 D、工业上通过NaCl制备8. 某实验小组将一小块Na投入盛放硫酸铜溶液的烧杯中,探究了Na与硫酸铜溶液的反应。下列关于该实验现象描述错误的是( )A、Na熔成小球 B、Na单质浮在水面上四处游动 C、溶液中有紫红色固体析出 D、溶液颜色逐渐变浅9. 工业流程中常常会产生浸出液,对浸出液合理分析才能更好地利用浸出液中的各种成分。某无色浸出液中可能大量存在的离子组为( )A、、、、 B、、、、 C、、、、 D、、、、10. 为制备胶体,某实验小组设计如下操作,其中操作正确的是( )A、向煮沸的溶液中滴加几滴NaOH溶液,继续加热至液体呈红褐色,停止加热 B、向煮沸的蒸馏水中滴加几滴饱和溶液,继续加热至液体呈红褐色,停止加热 C、向煮沸的溶液中滴加几滴NaOH溶液,用玻璃棒不断搅拌,至液体呈红褐色,停止加热 D、向煮沸的自来水中滴加几滴饱和溶液,用玻璃棒不断搅拌,至液体呈红褐色,停止加热11. 设为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下2.24L 中所含氧原子的数目为 B、2.3g Na与足量氧气完全反应,转移电子数目为0.1 C、 NaOH溶液中所含数目为0.1 D、1 mol 固体中含有的离子数目为612. 下列离子方程式书写正确的是( )A、铁与稀硫酸反应: B、金属铝与溶液反应: C、氢氧化钡溶液与稀硫酸反应: D、澄清石灰水中通入少量二氧化碳:
A、石青是一种白色固体 B、石青易溶于水 C、能用酸性液体清洗画卷上的污垢 D、高温下石青能分解生成黑色固体7. 工业生产中可通过一系列反应制备重要的化工原料。下列化工原料的制备过程中必须加入氧化剂才能实现的是( )A、从铁矿石中冶炼金属铁 B、工业上通过氮气合成氨气 C、工业上通过硫黄(硫单质)制备硫酸 D、工业上通过NaCl制备8. 某实验小组将一小块Na投入盛放硫酸铜溶液的烧杯中,探究了Na与硫酸铜溶液的反应。下列关于该实验现象描述错误的是( )A、Na熔成小球 B、Na单质浮在水面上四处游动 C、溶液中有紫红色固体析出 D、溶液颜色逐渐变浅9. 工业流程中常常会产生浸出液,对浸出液合理分析才能更好地利用浸出液中的各种成分。某无色浸出液中可能大量存在的离子组为( )A、、、、 B、、、、 C、、、、 D、、、、10. 为制备胶体,某实验小组设计如下操作,其中操作正确的是( )A、向煮沸的溶液中滴加几滴NaOH溶液,继续加热至液体呈红褐色,停止加热 B、向煮沸的蒸馏水中滴加几滴饱和溶液,继续加热至液体呈红褐色,停止加热 C、向煮沸的溶液中滴加几滴NaOH溶液,用玻璃棒不断搅拌,至液体呈红褐色,停止加热 D、向煮沸的自来水中滴加几滴饱和溶液,用玻璃棒不断搅拌,至液体呈红褐色,停止加热11. 设为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下2.24L 中所含氧原子的数目为 B、2.3g Na与足量氧气完全反应,转移电子数目为0.1 C、 NaOH溶液中所含数目为0.1 D、1 mol 固体中含有的离子数目为612. 下列离子方程式书写正确的是( )A、铁与稀硫酸反应: B、金属铝与溶液反应: C、氢氧化钡溶液与稀硫酸反应: D、澄清石灰水中通入少量二氧化碳:二、多选题
-
13. 常温下,向某浓度的硫酸铜溶液中分别加入硫酸铜固体和固体,随着二者的加入,溶液的导电性变化如图所示。下列分析合理的是( )
 A、原硫酸铜溶液一定是饱和溶液 B、若将固体换成固体,曲线变化可能完全重叠 C、M点后曲线表征的是新加入的硫酸铜固体生成了胆矾晶体,使溶液质量减小 D、N点时和恰好完全反应14. 下列实验方案能计算出最终结果的是( )A、a g碳酸钠和碳酸氢钠混合物加热,充分反应后,剩余b g固体,计算碳酸钠的质量分数 B、1 L 的浓盐酸与足量充分反应,计算产生氯气的物质的量 C、a g硝酸钠和氯化钠溶于水后加入足量硝酸银溶液,产生b g干燥的白色沉淀,计算硝酸钠的质量分数 D、a g碳酸钠和氯化钠混合物完全溶于足量盐酸,将产生的气体通过碱石灰,碱石灰增重b g,计算碳酸钠的质量分数15. 某实验小组通过图所示装置进行实验,验证能与反应产生。下列说法错误的是( )
A、原硫酸铜溶液一定是饱和溶液 B、若将固体换成固体,曲线变化可能完全重叠 C、M点后曲线表征的是新加入的硫酸铜固体生成了胆矾晶体,使溶液质量减小 D、N点时和恰好完全反应14. 下列实验方案能计算出最终结果的是( )A、a g碳酸钠和碳酸氢钠混合物加热,充分反应后,剩余b g固体,计算碳酸钠的质量分数 B、1 L 的浓盐酸与足量充分反应,计算产生氯气的物质的量 C、a g硝酸钠和氯化钠溶于水后加入足量硝酸银溶液,产生b g干燥的白色沉淀,计算硝酸钠的质量分数 D、a g碳酸钠和氯化钠混合物完全溶于足量盐酸,将产生的气体通过碱石灰,碱石灰增重b g,计算碳酸钠的质量分数15. 某实验小组通过图所示装置进行实验,验证能与反应产生。下列说法错误的是( )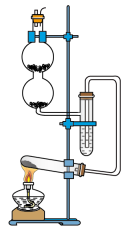 A、装置A中可换成 B、将装置B撤掉也可得到同样的实验结论 C、蚊香燃烧更旺可证明与反应产生了 D、该反应过程中既是氧化剂又是还原剂,为氧化产物
A、装置A中可换成 B、将装置B撤掉也可得到同样的实验结论 C、蚊香燃烧更旺可证明与反应产生了 D、该反应过程中既是氧化剂又是还原剂,为氧化产物三、填空题
-
16. 根据物质的组成和性质,可将物质进行分类,并实现物质之间的转化。由H、O、Na、S四种元素中的一种或几种元素能形成多种物质,利用这些物质回答下列问题。(1)、常温下能导电的固体为(任写一种化学式,下同),属于非电解质的是 , 属于强酸的是 , 属于碱的是。(2)、是由上述四种元素组成的化合物,其在水溶液中的电离方程式为。(3)、写出由两种单质发生化合反应生成一种淡黄色固体的化学方程式,并用双线桥表示出电子转移数目。17. NaCl是一种食品添加剂、防腐剂,也是重要的化工原料。
回答下列问题:
(1)、某NaCl溶液中混有少量 , 获得纯净NaCl晶体的方法是先向溶液中加入稍过量的(填试剂名称,下同),过滤,再加入稍过量的 , 最后蒸发结晶得NaCl晶体。(2)、工业上可通过电解NaCl溶液的方法制备NaOH、和 , 该反应的化学方程式为。(3)、实验室需要100mLNaCl溶液,现用NaCl固体配制该溶液。①配制过程中必须要用到的玻璃仪器除玻璃棒、烧杯、胶头滴管外还有 , 该仪器使用前需进行的操作为。
②经计算需要准确称量NaCl的质量为g(保留四位有效数字)。
③若定容过程中仰视读数,则所配溶液浓度(填“偏大”“偏小”或“无影响”)。
18. 某溶液中只可能大量含有、、、、、、中的若干种,对其进行如下实验:i:取少量该溶液于试管中,加入过量溶液,产生白色沉淀,过滤;
i:向i中所得滤渣中加入足量盐酸,沉淀全部溶解,并有无色气体生成;
ii:向i中所得滤液中加入足量硝酸酸化后,再加入溶液,有白色沉淀生成。
回答下列问题:
(1)、无需实验即可推断溶液中一定不会大量存在的离子为。(2)、通过实验i可知溶液中一定不会大量存在的离子为。(3)、实验ⅰ中过滤时用到的玻璃仪器为烧杯、、。(4)、由实验ⅱ可知溶液中一定不会大量存在的离子为 , 一定大量存在的离子为;实验ⅱ中发生反应的离子方程式为。(5)、实验iii(填“能”或“不能”)说明该溶液中存在;若能请说明理由,若不能请简单设计实验证明该溶液中是否存在:。(6)、上述实验(填“能”或“不能”)说明该溶液中存在 , 若能请说明理由,若不能请简单设计实验证明该溶液中是否存在:。四、综合题
-
19. 某兴趣小组通过下列实验制备并探究氯气性质。(1)、I.利用下列装置制备干燥纯净的氯气。

盛放浓盐酸的仪器的名称为。
(2)、利用装置E进行排空气法收集氯气,则制备氯气时,正确的连接顺序是A→(用字母表示)。(3)、装置E中应有一个导管伸入集气瓶底部,其中伸入底部的导管是(填“左管”或“右管”)。(4)、装置A为的发生装置,发生反应的化学方程式为。(5)、装置C中“饱和食盐水”的作用为。(6)、II.探究氯水具有酸性。甲同学设计实验:将氯气通入滴有酚酞的NaOH溶液中,溶液的红色褪去。
常温下,与NaOH溶液反应的离子方程式为。
(7)、乙同学认为该实验设计不合理,原因为。(8)、甲同学重新设计实验:将氯气通入饱和溶液中,能证明氯水具有酸性的实验现象为。