河南省洛阳市2022-2023学年高一上学期期中考试化学试题
试卷更新日期:2022-12-14 类型:期中考试
一、单选题
-
1. 下列各组物质,按化合物、单质、混合物顺序排列的是( )A、烧碱、液态氧、碘酒 B、生石灰、白磷、熟石灰 C、干冰、铁、氯化氢 D、空气、氮气、胆矾2. 下列叙述中,正确的是( )A、固体不导电,所以不是电解质 B、熔融的能导电,所以是电解质 C、铜丝、石墨均能导电,所以它们都是电解质 D、溶于水,在通电条件下才能发生电离3. 下列离子方程式中,正确的是( )A、将稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ B、将稀盐酸滴在石灰石上:CaCO3+2HCl=CaCl2+H2CO3 C、将铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag D、将氧化镁与稀盐酸混合:MgO+2H+=Mg2++H2O4. 下列各组中的离子,能在溶液中大量共存的是( )A、K+、H+、SO、OH- B、Na+、Ca2+、CO、NO C、Na+、H+、Cl-、CO D、Na+、Cu2+、Cl-、SO5. 当光束通过下列物质时,不会出现丁达尔效应的是( )
①Fe(OH)3胶体 ②水 ③蔗糖溶液 ④FeCl3溶液 ⑤云、雾
A、②④⑤ B、③④⑤ C、②③④ D、①③④6. 下列转化中,需要加入氧化剂才能实现的是( )A、 B、 C、 D、7. 0.5molNa2SO4中含Na+的数目为( )A、3.01×1023个 B、6.02×1023个 C、0.5个 D、1个8. 下列物质放在空气中,因发生氧化还原反应而变质的( )A、NaOH B、Na C、NaCl D、Na2CO39. 下列物质中,既含有氯分子,又含有氯离子的是( )A、氯化钠溶液 B、新制氯水 C、漂白液 D、液氯10. 将30mL0.5mol/LNaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为( )A、0.3mol/L B、0.04mol/L C、0.03mol/L D、0.05mol/L11. 相同状况下,等体积的CO和CO2两种气体,以下有关说法错误的是( )A、所含分子数相同 B、所含氧原子个数之比为1∶2 C、密度之比为11∶7 D、质量之比为7∶1112. 在下列溶液中,各组离子能够大量共存的是( )A、使酚酞试液变红的溶液:Na+、、Ba2+ B、使紫色石蕊试液变红的溶液:K+、、Cl- C、常温下pH=2的溶液:K+、Ca2+、 D、碳酸氢钠溶液:Na+、、OH-13. 下列实验操作可以达到目的的是( )目的
操作
A
测定氯水的pH
用洁净干燥的玻璃棒蘸取氯水,点在pH试纸中间
B
验证KI具有还原性
向酸性KMnO4溶液中滴加KI溶液,再滴入数滴淀粉溶液,溶液变蓝
C
除去CO2中的HCl气体
将混合气体通过饱和Na2CO3溶液
D
配制100mL 0.1mol/L CuSO4溶液
称取1.6gCuSO45H2O固体,溶于水后定容于100mL容量瓶
A、A B、B C、C D、D14. 某溶液中仅含有Na+、Mg2+、SO、Cl-四种离子其物质的量浓度之比为c(Na+):c(Mg2+):c(Cl-)=3:5:5,若Na+浓度为3mol·L-1。则SO的浓度为( )A、2mol·L-1 B、3mol·L-1 C、4mol·L-1 D、8mol·L-115. 某地化工厂的贮氯罐意外发生泄漏,下列关于安全处理措施错误的是( )A、紧急组织群众沿逆风方向疏散 B、消防队员向贮氯罐周围空气中喷洒NaOH溶液 C、处在该环境中的群众,应用浸有稀氨水的毛巾捂住鼻子,趴在低洼处等待救援 D、处在该环境中的群众,应用浸有一定浓度Na2CO3的毛巾捂住鼻子,向高处转移16. 24mL浓度为5mol/L的Na2SO3溶液恰好与20mL浓度为2mol/L的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4 , 则元素Cr在还原产物中的化合价是( )A、+2 B、+3 C、+4 D、+517. 下列实验现象和结论相符的是( )操作及现象
结论
A
某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体
溶液中一定含有
B
某溶液中加入硝酸银,产生白色沉淀
溶液中一定含有Cl-
C
把一块绿豆大的钠放入滴有酚酞的水中,溶液变红
钠和水反应后溶液显碱性
D
用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色
溶液中有Na+ , 无K+
A、A B、B C、C D、D18. 下列叙述正确的是( )A、常温常压下,28gN2含有的分子数约为6.021023 B、64gSO2气体中含有的氧原子数约为6.021023 C、标准状况下,22.4LH2O含有的分子数约为6.021023 D、2L0.5mol/LMgCl2溶液中,c()=0.5mol/L19. 以CO2和Na2O2为原料,制取纯净干燥的O2 , 实验装置如下,下列说法正确的是( ) A、装置②的作用是干燥O2 B、装置③中试剂可以是NaOH溶液 C、收集氧气应选择装置b D、装置①中反应的化学方程式:Na2O2+CO2=Na2CO3+O2↑20. 常温时在刚性容器内部有一个不漏气,且可滑动的活塞将容器分成左右两室。左室充入1molN2 , 右室充入H2与O2的混合气体,活塞恰好停留在离左端四分之一处,然后引燃氢、氧混合气体,反应完毕后恢复至原来温度,活塞恰好停在中间,忽略水的体积,下列说法错误的是( )
A、装置②的作用是干燥O2 B、装置③中试剂可以是NaOH溶液 C、收集氧气应选择装置b D、装置①中反应的化学方程式:Na2O2+CO2=Na2CO3+O2↑20. 常温时在刚性容器内部有一个不漏气,且可滑动的活塞将容器分成左右两室。左室充入1molN2 , 右室充入H2与O2的混合气体,活塞恰好停留在离左端四分之一处,然后引燃氢、氧混合气体,反应完毕后恢复至原来温度,活塞恰好停在中间,忽略水的体积,下列说法错误的是( )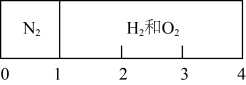 A、反应前,右室充入H2与O2共3mol B、反应完毕后,恢复至原来温度,左室的压强变为原来的一半 C、反应完毕后,右室剩余气体中含有NA个原子 D、反应前,H2与O2的体积比是4:5或7:2
A、反应前,右室充入H2与O2共3mol B、反应完毕后,恢复至原来温度,左室的压强变为原来的一半 C、反应完毕后,右室剩余气体中含有NA个原子 D、反应前,H2与O2的体积比是4:5或7:2二、综合题
-
21. 实验室需要配制100mL1.00mol/LNaCl溶液,请回答下列问题:(1)、实验中使用托盘天平称量gNaCl固体。(2)、实验仪器除了烧杯、玻璃棒、托盘天平、量筒、胶头滴管,还需要(填仪器名称)。(3)、以下关于溶液配制的各步骤中,错误的是____(填字母)。A、容量瓶检漏,并用蒸馏水洗涤 B、将容量瓶加热烘干,备用 C、将称好的NaCl固体放入容量瓶中,加入适量蒸馏水溶解 D、洗涤玻璃棒、烧杯2~3次,洗涤液均转移至容量瓶中 E、定容时,凹液面最低处与刻度线相切(4)、下列操作对浓度有何影响(填“偏高”、“偏低”或“无影响”)。
①定容时,俯视刻度线。
②定容滴加蒸馏水时不小心超过刻度线,将超出部分吸出。
22. 氯气是一种重要的化工产品和基础原料,实验室制备氯气装置如下,请回答: (1)、装置A中的化学方程式为。在该反应中浓盐酸表现的性质是(填字母)。
(1)、装置A中的化学方程式为。在该反应中浓盐酸表现的性质是(填字母)。A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)、装置B的作用是。(3)、氯气能将氧化为I2 , 因氯气有毒常用H2O2替代,H2O2氧化的离子方程式是。(4)、有同学认为H2O2既有氧化性又有还原性,理论依据是(从氧元素价态回答),选择合适的试剂设计实验,可以验证H2O2的还原性,提供试剂:0.1mol/LKMnO4(H+)溶液、0.1mol/LKI溶液、淀粉溶液、10% H2O2溶液、0.1mol/LFeCl3溶液。请写出H2O2只做还原剂的离子方程式 , 该反应中能够证明H2O2被氧化的实验现象是。三、综合题
-
23. 我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。联合制碱法的工艺流程简化如下:
 (1)、I.资料1:反应I中的化学方程式为:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓
(1)、I.资料1:反应I中的化学方程式为:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓资料2:20℃时,溶解度小于0.0lg的物质属于难溶物;20℃时BaSO4溶解度为g。
资料3:表1有关物质的溶解度(20℃)
物质
NaCl
NH4HCO3
NaHCO3
NH4Cl
溶解度/g
36.0
21.7
9.6
37.2
操作I的名称为 ,反应II的化学方程式为。
(2)、相同温度下,用pH试纸测量同等浓度的Na2CO3与NaHCO3溶液pH,溶液碱性强。(3)、离子反应: , BaSO4难溶生成沉淀,符合复分解反应发生的条件;反应I中NaHCO3不是难溶物,也生成了沉淀,理由是。(4)、II.泡腾片是一种医药片剂,适用于儿童、老年人以及吞服药丸困难的患者。泡腾片放入水中,在崩解剂的作用下,即刻产生大量气泡(二氧化碳),使片剂迅速崩解形成水溶液,崩解剂主要由NaHCO3固体与柠檬酸固体组成。下列说法正确的是____(填字母)。
A、NaHCO3固体与柠檬酸固体不反应 B、柠檬酸在水中电离产生H+与NaHCO3反应 C、Na2CO3比NaHCO3稳定,受热不易分解(5)、某NaHCO3样品中含NaCl杂质,取质量为a g的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到b g固体物质,则此样品中NaHCO3的质量分数是。24. 科学研究中观察到的宏观现象能反映微观本质。例如,我们可以通过测定溶液导电能力来探查溶液中自由移动的离子浓度。某小组向0.1mol/L Ba(OH)2溶液中匀速滴加0.1mol/L稀硫酸,测得溶液导电能力的变化如图所示,回答下列问题: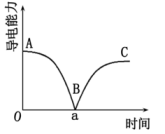
资料1:20℃时BaSO4溶解度为g
资料2:表2 20℃蒸馏水和饱和BaSO4溶液的电导率
蒸馏水
饱和BaSO4溶液
电导率(S/m)
注:电导率越大,溶液导电能力越强。
(1)、Ba(OH)2的电离方程式是。(2)、A~B段发生反应的离子方程式是。(3)、关于图中的说法正确的是____(填字母)。A、AB段溶液的导电能力不断减弱,说明生成的BaSO4不是电解质 B、B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子 C、BC段溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电 D、a时刻Ba(OH)2溶液与稀硫酸恰好完全中和 E、Ba(OH)2和HNO3反应,可以用同一个离子方程式表示(4)、BaSO4在水中的存在形式,同学们提出了不同的观点:A.只以BaSO4固体形式存在
B.只以自由移动的和Ba2+形式存在
C.主要以BaSO4固体形式存在,同时存在极少量自由移动的和Ba2+
你支持观点(填字母)证据是(用文字和数据说明);由此可知,物质在水中的存在形式决定了其在离子方程式中能否写为离子形式。
(5)、次磷酸与醋酸相似,是一种易溶于水的一元酸,其分子式为H3PO2 , 与NaOH溶液反应的离子方程式为: , 次磷酸在水中的存在形式是 , 次磷酸的电离方程式是。