河北省保定定州市2022-2023学年高一上学期期中考试化学试题
试卷更新日期:2022-12-14 类型:期中考试
一、单选题
-
1. 下列物质中,属于电解质的是( )A、乙醇 B、食盐水 C、KNO3 D、Mg2. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、KCl溶液 B、Fe(OH)3胶体 C、蔗糖溶液 D、CuSO4溶液3. 下列物质在标准状况下体积最大的是( )A、11.2L氢气 B、90g水 C、2molCl2 D、个氧分子4. 下列物质的保存方法,与其化学性质无关的是( )A、金属钠保存在煤油中 B、浓盐酸需密闭保存 C、新制氯水密闭存放于棕色瓶中 D、过氧化钠需保持干燥密闭保存5. 下列各项是关于玻璃棒在若干实验中的用途及操作,其中错误的是( )A、溶解物质时搅拌 B、蘸取少量溶液做焰色试验 C、过滤时向漏斗中转移液体 D、配制一定物质的量浓度的溶液时引流6. 下列反应中水做还原剂的是( )A、2Na+2H2O=2NaOH+H2↑ B、Cl2+H2O=HCl+HClO C、3NO2+H2O=2HNO3+NO D、2F2+2H2O=4HF+O27. 已知CCl4为非电解质,HCl为电解质,则下列物质中一定含有Cl-的是( )A、HCl气体 B、液态CCl4 C、KClO3溶液 D、KCl溶液8. 美丽的焰火增添了节日的气氛,这与“焰色试验”知识相关。下列说法中错误的是( )A、焰色试验时发生的是物理变化 B、用稀盐酸清洗做焰色试验的铂丝 C、Na与NaCl在灼烧时火焰颜色相同 D、若透过蓝色钴玻璃只看到紫色,说明样品中含K元素而不含Na元素9. 下列说法错误的是( )A、1mol N2中含有的质子数约为7×6.02×1023 B、标准状况下,1.5mol H2的体积约为33.6L C、配制250mL 1.0mol•L-1 H2SO4溶液需要18mol•L-1H2SO4溶液的体积约为13.9mL D、在标准状况下,20mL NH3和60mL O2所含分子个数比为1:310. 下列物质的分类组合正确的是( )
①金刚石、氢氧化铁胶体、豆浆均为混合物;
②HClO、CH3COOH、H2CO3均为酸;
③NaOH、NH4HCO3、KMnO4均为电解质;
④Na2O2、Na2O、MgO均为碱性氧化物;
⑤碳纤维、金刚石、石墨、C60互为同素异形体。
A、②⑤ B、②③⑤ C、①②③⑤ D、④⑤11. 下列实验现象的描述正确的是( )A、氢气在氯气中燃烧,发生苍白色火焰,瓶口上方形成白雾 B、铁丝在氯气中燃烧,产生棕褐色的烟,产物溶于水,溶液呈浅绿色 C、金属钠放入溶液中,有银白色金属析出 D、钠在空气中燃烧,发出黄色火焰,生成白色固体12. 同温同压下,有质量相同的CO2、H2、O2、CH4、SO2五种气体,下列有关说法错误的是( )A、气体的体积由大到小的顺序是H2>CH4>O2>CO2>SO2 B、所含分子数由多到少的顺序是H2>CH4>O2>CO2>SO2 C、密度由大到小的顺序是SO2>CO2>O2>CH4>H2 D、所含电子数由多到少的顺序是CO2>SO2>CH4>O2>H213. M与N反应时,不能实现图示电子转移的是( )选项
M
N
电子转移
A
H2
Cl2

B
Fe
CuCl2
C
Al
H2SO4(稀)
D
Cl2
H2O
A、A B、B C、C D、D14. 某同学配制的植物营养液中有4种离子,其中所含的、K+、的物质的量浓度分别为0.2mol·L-1、0.3mol·L-1、0.4mol·L-1 , 则Zn2+的物质的量浓度为( )A、0.5mol·L-1 B、0.7mol·L-1 C、0.35mol·L-1 D、0.9mol·L-115. 下列“实验方案”不宜用于完成“实验目的”的是( )选项
实验目的
实验方案
A
确认Fe(OH)3胶体是否制备成功
用可见光束照射
B
确认金属活泼性:Na>Cu
将金属钠投入CuSO4溶液中
C
确认钠与水反应生成NaOH
向反应后的混合液中滴加酚酞
D
确认Cl2无漂白作用
将有色纸条放入干燥Cl2中
A、A B、B C、C D、D16. 下列溶液与50mL 1mol/L AlCl3溶液中Cl-的物质的量浓度相等是( )A、25mL 2mol/L AlCl3溶液 B、75mL 0.5mol/L CaCl2溶液 C、100mL 1mol/L NaCl溶液 D、150mL 3mol/L KCl溶液17. 已知2MO+5S2-+16H+=2M2++5S↓+8H2O,则MO中x的值为( )A、1 B、2 C、3 D、418. 200℃时,11.6g由CO2和水蒸气的混合物与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均摩尔质量为( )g/molA、5.8 B、11.6 C、46.4 D、23.219. 将Cl2通入过量石灰乳[Ca(OH)2]中即可制得以Ca(ClO)2为有效成分的漂白粉。下列解释事实的方程式中,错误的是( )A、生成Ca(ClO)2:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O B、漂白粉溶液与盐酸混合产生Cl2:ClO﹣+Cl﹣+2H+=Cl2↑+H2O C、漂白粉溶液吸收CO2后产生白色沉淀:Ca2++CO2+H2O=CaCO3↓+2H+ D、漂白粉溶液加入适量醋酸在短时间内能达到漂白效果:Ca(OH)2+2CH3COOH=Ca(CH3COO)2+2H2O、Ca(ClO)2+2CH3COOH=Ca(CH3COO)2+2HClO20. 下列对实验过程的评价正确的是( )A、向某溶液中加入稀盐酸,产生无色无味气体,能使澄清石灰水变浑浊,证明该溶液中含有或 B、某溶液中滴加溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含 C、向某无色溶液中加入紫色石蕊显红色,证明该溶液一定是酸的溶液 D、验证烧碱溶液中是否含有 , 先加稀盐酸除去 , 再加硝酸银溶液,有白色沉淀出现,证明含21. 使用如图装置探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是( )
选项
A
B
C
D
试剂
试剂
A、A B、B C、C D、D22. 如图所示,锥形瓶和分液漏斗内的液体都盛有水,向烧杯内滴加水时,发现形管内液面左边低于右边,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( ) A、过氧化钠 B、氧化钙 C、钠 D、碳酸氢钠23. 过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②、③中红色均不褪去。下列分析错误的是( )
A、过氧化钠 B、氧化钙 C、钠 D、碳酸氢钠23. 过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②、③中红色均不褪去。下列分析错误的是( ) A、过氧化钠与水反应产生的气体为O2 B、过氧化钠与水反应需要MnO2作催化剂 C、实验②、③证明使酚酞褪色的不是氢氧化钠和氧气 D、过氧化钠与水反应可能生成了具有漂白性的H2O2
A、过氧化钠与水反应产生的气体为O2 B、过氧化钠与水反应需要MnO2作催化剂 C、实验②、③证明使酚酞褪色的不是氢氧化钠和氧气 D、过氧化钠与水反应可能生成了具有漂白性的H2O2二、多选题
-
24. 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中,一定能大量共存的是( )
 A、a点对应的溶液中:、、、 B、b点对应的溶液中:、、、 C、c点对应的溶液中:、、、 D、d点对应的溶液中:、、、
A、a点对应的溶液中:、、、 B、b点对应的溶液中:、、、 C、c点对应的溶液中:、、、 D、d点对应的溶液中:、、、三、综合题
-
25. 实验小组同学需要配制500mL0.2mol•L-1NaCl溶液。(1)、用托盘天平称取NaCl固体的质量为。(2)、该实验小组同学在实验室中找到了下列仪器。

①为了完成实验,还缺少的玻璃仪器是。
②在操作步骤“转移”中,玻璃棒的作用是。
(3)、配制过程中,下列操作会导致所配溶液物质的量浓度偏小的是(填序号)。a.转移时有少量溶液洒出
b.转移后未用蒸馏水洗涤烧杯
c.定容时俯视刻度线
26. 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中和利用如图装置制备KClO3(热水浴中)和NaClO(冰水浴中),探究其氧化还原性质。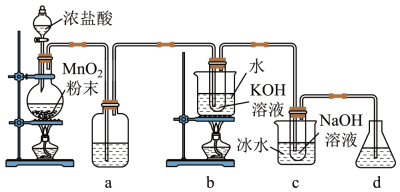
回答下列问题:
(1)、盛放MnO2粉末的仪器名称是 , a中的试剂为。(2)、写出该实验中制备Cl2的化学方程式,并用双线桥标出电子转移的数目和方向:。(3)、b中化学反应的离子方程式是 , d装置的作用是。(4)、取少量KClO3和NaClO溶液分别置于1号和2号试管中,先滴加KI溶液,再滴加淀粉溶液,1号试管溶液颜色不变;2号试管溶液变为蓝色。可知该条件下KClO3的氧化能力NaClO(填“大于”或“小于”)。(5)、工业上采用电解NaCl溶液制备氯气,请将反应方程式补充完整,并用单线桥表示电子转移:。H2O+NaClCl2↑+NaOH+
27. 氧化还原反应是一类重要的化学反应,广泛存在于生产生活中。(1)、下列变化中,与氧化还原反应有关的是(填字母)。a.食物的腐败 b.钢铁的锈蚀 c.钟乳石的形成 d.Fe(OH)3胶体的制备
(2)、汽车尾气中的CO和NO在催化剂作用下发生反应,生成CO2和N2。写出化学方程式:。(3)、黑火药爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。在该反应中,氧化剂是(填化学式),每生成0.25molN2转移的电子数约为。(4)、FeSO4、K2FeO4是水处理中常用的物质。①选择两种属于不同基本反应类型的方法制取FeSO4 , 用离子方程式表示该方法:。
②依据“性质决定用途”的学科观念,分析K2FeO4的性质,预测K2FeO4在处理含NH的废水中的作用。简述分析过程:。
28. 关注物质的宏观组成和微观构成,是研究物质性质及其转化的基本出发点。(1)、从物质分类看,Na2CO3和NaHCO3均属于(选填序号),因此具有某些相似的化学性质。a.氧化物 b.酸 c.碱 d.盐
(2)、探究Na2CO3和NaHCO3的相互转化。【实验1】加热碳酸氢钠固体,装置如图所示。

①利用上述装置可实现NaHCO3 , 向Na2CO3发生转化,试管中发生反应的化学方程式为。
【实验2】分别向滴有2滴酚酞的NaHCO3和Na2CO3溶液中滴加稀盐酸,实验记录如表:
实验内容
实验现象

实验2-1
溶液浅红色褪去,立即产生大量气泡。

实验2-2
开始时,溶液的红色没有明显变化,也没有明显的气泡产生。继续滴加盐酸,当溶液的红色明显变浅时,气泡的数量也逐渐增多。当溶液的颜色变为浅红色,继续滴加盐酸,溶液的浅红色褪去,有大量气泡出现。
②实验2-1中,反应的离子方程式是。
③实验2-2中,实现碳酸钠向碳酸氢钠转化的现象是。
④通过上述实验,从物质组成上分析Na2CO3 , 转化为NaHCO3 , 加入盐酸的作用是。
(3)、探究NaCl转化为NaHCO3。资料i:
物质
NaCl
NaHCO3
NH4HCO3
NH4Cl
20℃时的溶解度(g/100gH2O)
36.0
9.6
21.7
37.2
资料ii:氨气(NH3)可与水发生反应,生成一水合氨(NH3•H2O),一水合氨属于一种碱。
向饱和NaCl溶液中通入足量CO2 , 无NaHCO3生成,原因是。
②向饱和NaCl溶液中先通入NH3 , 再通入CO2 , 在溶液中可析出NaHCO3晶体,该反应的化学方程式。
-