山东省烟台市海阳市2022-2023学年九年级上学期期中化学试题
试卷更新日期:2022-12-09 类型:期中考试
一、单选题
-
1. 将一定量的下列固体放入适量水中,能形成溶液且温度明显升高的是( )A、CaCO3 B、NaOH C、NaCl D、NH4NO32. 新冠防疫提出明确要求,要保持良好个人卫生。要勤洗手,用香皂或洗手液和流动水洗手,或用手消毒剂消毒。不同品牌的洗手液pH一般不同,25℃时四种洗手液的pH如图所示。下列说法错误的是( )
 A、洗手液a用蒸馏水稀释后pH减小 B、洗手液b的酸性比a弱 C、洗手液c能使石蕊试液变蓝色 D、洗手液d和a混合液的pH可能等于73. 稀释浓硫酸并进行硫酸性质实验的下列操作,正确的是( )A、
A、洗手液a用蒸馏水稀释后pH减小 B、洗手液b的酸性比a弱 C、洗手液c能使石蕊试液变蓝色 D、洗手液d和a混合液的pH可能等于73. 稀释浓硫酸并进行硫酸性质实验的下列操作,正确的是( )A、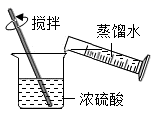 稀释浓硫酸
B、
稀释浓硫酸
B、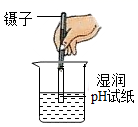 测稀硫酸的pH
C、
测稀硫酸的pH
C、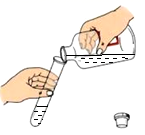 倾倒稀硫酸
D、
倾倒稀硫酸
D、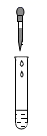 滴加稀硫酸
4. 下列洗涤方法主要利用了物质化学性质的是( )A、无水酒精擦洗手机屏幕 B、食醋洗去水壶内的水垢 C、清水洗涤衣服上的泥土 D、汽油清洗工具上的油污5. 下列有关溶液的说法错误的是( )A、溶液是均一、稳定的混合物 B、溶液中的溶质可以是固体、液体或气体 C、饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液 D、洗涤剂能洗去衣服上的油污,原因是洗涤剂具有乳化作用6. 下列有关硫酸的认识或做法,正确的是( )A、组成:硫酸溶液中H+和 的数目相同 B、性质:能与CO2、SO2等非金属氧化物反应 C、用途:用于生产化肥、农药、火药、染料等 D、生产:含硫酸的工业废水,用CaCl2处理后直接排放7. 中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是( )A、生石灰用于加热即热食品 B、氢氧化铝用于治疗胃酸过多 C、熟石灰用于改良酸性土壤 D、硼酸用于处理皮肤上沾有的碱8. 在氢氧化钠溶液中加入盐酸至恰好完全反应,反应的微观示意图见如图。下列有关认识错误的是( )
滴加稀硫酸
4. 下列洗涤方法主要利用了物质化学性质的是( )A、无水酒精擦洗手机屏幕 B、食醋洗去水壶内的水垢 C、清水洗涤衣服上的泥土 D、汽油清洗工具上的油污5. 下列有关溶液的说法错误的是( )A、溶液是均一、稳定的混合物 B、溶液中的溶质可以是固体、液体或气体 C、饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液 D、洗涤剂能洗去衣服上的油污,原因是洗涤剂具有乳化作用6. 下列有关硫酸的认识或做法,正确的是( )A、组成:硫酸溶液中H+和 的数目相同 B、性质:能与CO2、SO2等非金属氧化物反应 C、用途:用于生产化肥、农药、火药、染料等 D、生产:含硫酸的工业废水,用CaCl2处理后直接排放7. 中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是( )A、生石灰用于加热即热食品 B、氢氧化铝用于治疗胃酸过多 C、熟石灰用于改良酸性土壤 D、硼酸用于处理皮肤上沾有的碱8. 在氢氧化钠溶液中加入盐酸至恰好完全反应,反应的微观示意图见如图。下列有关认识错误的是( ) A、反应结束时溶液的pH=7 B、反应前后元素的种类没有变化 C、盐酸与氢氧化钠的反应属于中和反应 D、该微观图还可说明氢氧化钠是由分子构成的9. 实验室有两瓶失去标签的溶液,一瓶是稀盐酸,另一瓶是氢氧化钠溶液,下列试剂中不能将它们鉴别出来的是( )A、酚酞试液 B、镁条 C、硝酸钾溶液 D、硫酸铜溶液10. 配制130g溶质质量分数为6%的氯化钠溶液时,下列操作会导致结果偏大的是( )
A、反应结束时溶液的pH=7 B、反应前后元素的种类没有变化 C、盐酸与氢氧化钠的反应属于中和反应 D、该微观图还可说明氢氧化钠是由分子构成的9. 实验室有两瓶失去标签的溶液,一瓶是稀盐酸,另一瓶是氢氧化钠溶液,下列试剂中不能将它们鉴别出来的是( )A、酚酞试液 B、镁条 C、硝酸钾溶液 D、硫酸铜溶液10. 配制130g溶质质量分数为6%的氯化钠溶液时,下列操作会导致结果偏大的是( )①称量的氯化钠固体中含有不溶性杂质
②用量筒量取水时俯视读数
③将氯化钠固体放在托盘天平的右盘称量(1g以下用游码)
④往烧杯中加水时有水洒出
⑤转移配好的溶液时有少量溅出
A、②③ B、①④ C、②④ D、③⑤11. 推理是化学学习中常用的思维方法。下列推理正确的是( )A、酸中都含有氢元素,所以含有氢元素的化合物一定是酸 B、酸溶液的pH小于7,所以硫酸溶液的pH一定小于7 C、中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 D、溶液具有均一性和稳定性,具有均一性和稳定性的液体一定是溶液12. 下列实验不能达到实验目的的是( )A、利用此实验比较不同物质在同种溶剂中的溶解性 B、实验探究氢氧化钠与盐酸能否发生反应
B、实验探究氢氧化钠与盐酸能否发生反应  C、利用此实验验证稀盐酸和氢氧化钠溶液反应放热
C、利用此实验验证稀盐酸和氢氧化钠溶液反应放热  D、除去CO2中混有HCl气体
D、除去CO2中混有HCl气体 
二、多选题
-
13. 如图为甲、乙、丙三种物质的溶解度曲线。下列说法正确的是( )
 A、将甲的饱和溶液由t1℃升温至t2℃,溶质质量分数不变 B、将甲、乙、丙的饱和溶液从t2℃降到t1℃,析出晶体质量最大的是甲 C、t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等 D、t2℃时,等质量的甲、乙、丙三种物质分别溶于水得到饱和溶液,甲需要的水质量最大14. 如图表示化学反应中溶液的颜色变化,下列叙述错误的是( )
A、将甲的饱和溶液由t1℃升温至t2℃,溶质质量分数不变 B、将甲、乙、丙的饱和溶液从t2℃降到t1℃,析出晶体质量最大的是甲 C、t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等 D、t2℃时,等质量的甲、乙、丙三种物质分别溶于水得到饱和溶液,甲需要的水质量最大14. 如图表示化学反应中溶液的颜色变化,下列叙述错误的是( ) A、若X是稀硫酸,则a可能是紫色石蕊试液 B、若X是稀硫酸,则d就是CuO固体 C、若X是稀盐酸,则c一定是单质 D、若b是Fe2O3 , 则黄色溶液可能是氯化铁15. 下列图像能正确反映其对应关系的是( )A、
A、若X是稀硫酸,则a可能是紫色石蕊试液 B、若X是稀硫酸,则d就是CuO固体 C、若X是稀盐酸,则c一定是单质 D、若b是Fe2O3 , 则黄色溶液可能是氯化铁15. 下列图像能正确反映其对应关系的是( )A、 向饱和的氢氧化钙溶液中加入少量的氧化钙
B、
向饱和的氢氧化钙溶液中加入少量的氧化钙
B、 某温度下,向接近饱和的硝酸钠溶液中加入硝酸钠固体
C、
某温度下,向接近饱和的硝酸钠溶液中加入硝酸钠固体
C、 向一定量Na2CO3和NaOH的混合溶液中逐滴加入稀盐酸
D、
向一定量Na2CO3和NaOH的混合溶液中逐滴加入稀盐酸
D、 向一定溶质质量分数的NaOH溶液中加水稀释
向一定溶质质量分数的NaOH溶液中加水稀释
三、填空题
-
16. 化学来源于生活又服务于生活,它为满足人类不断增长的物质、精神需求作出了巨大的贡献。(1)、胃酸的主要成分是盐酸,胃舒平主要成分【Al(OH3)】常用于治疗胃酸过多症,写出用胃舒平治疗胃酸过多症时的化学方程式。(2)、了解土壤酸碱度是科学种植最基础的工作,其测量的方法是:取田里少量土壤样品、称量,放入烧杯,再加入五倍土壤样品质量的蒸馏水,充分搅拌后静置,用测澄清液体的酸碱度:水稻最适宜在pH是6~7的土壤中生长,若测得澄清液体的pH是4,应在该田的土壤中施加适量来调节土壤的pH。(3)、切圆葱时眼睛常常被刺激而流泪。查阅资料得知:①圆葱被切开时因破坏了细胞组织,生成了多种挥发性的能刺激眼睛的物质(其中含有少量SO3)这些挥发性物质是“催人泪下”的元凶。②SO3跟CO2的化学性质相似。请你运用类比推理,写出三氧化硫跟水反应的化学方程式。若要避免切圆葱时眼睛流泪,请你给出一条建议。(4)、2021年5月15山,天问一号探测器着陆火星。火星上含有丰富的二氧化碳酸和镁资源。科学家设想用镁作为未来火星上的燃料,因为镁能在二氧化碳中燃烧放出大量的热,同时生成一种氧化物和一种单质。该反应的化学方程式为。17. 构建知识网络模型是化学学习中重要的学习方法。如图1是小明同学利用左手构建的酸的化学性质知识网络(其中A、B表示反应物,C表示生成物)。


请完成下列问题:
(1)、如用湿润的pH试纸测定盐酸的pH,则结果会(填“偏大”“偏小”或“无影响”)。(2)、图1中①的现象是。(3)、世界卫生组织推广使用中国铁锅,使用铁锅炒菜时,放点食醋可以补充人体中构成血红素的(填“Fe2+”或“Fe3+”),该反应的原理是利用了酸的(填序号“②”“③”“④”或“⑤”)化学性质。(4)、小明用图2来说明稀硫酸与氢氧化钠溶液反应的过程,该过程不发生变化的微粒是(用符号表示),该反应的微观实质可表示为 。依此类推当图1中③是向稀盐酸中滴加硝酸银溶液时,反应的微观实质用同样的方法可表示为。(5)、图1中⑤的性质可用于除铁锈,反应的化学方程式为。(6)、盐酸、硫酸、食醋具有相似化学性质是因为它们水溶液中都含有(用符号表示)。18.(1)、Ⅰ:在农业上通常用12%的氯化钠溶液选种。实验室欲配制该质量分数的溶液60g,操作如图,请回答下列问题:

请用图中的序号表示配制溶液的正确操作顺序。
(2)、认真观察②,其中的不正确操作是:。若不进行改正,其他操作步骤正确,则所配溶液的溶质的质量分数(填“大于”、“小于”或“等于”)12%。(3)、改正②不正确后,若配制所得的氯化钠溶液溶质质量分数偏小,可能的原因是____。(填字母序号)A、转移已称好的氯化钠固体时,部分洒落在烧杯外 B、用量筒量取水时俯视读数 C、转移已配好的溶液时,有少量溶液溅出(4)、Ⅱ:根据下面NaNO3在不同温度时的溶解度表回答问题。(忽略溶解时的热量变化)
20℃时,将90 g NaNO3固体加入盛有100g水的烧杯中,充分搅拌后,得到溶液的质量为g。给烧杯加热,使溶液温度升至40℃时,溶液中溶质与溶剂的最简质量比为。温度/℃
10
20
30
40
50
60
70
80
溶解度/g
80.8
87.6
94.9
103
113
124
136
149
(5)、80℃时,将249 g NaNO3饱和溶液降温至℃时,溶液质量变为224g。(6)、50℃时将200g溶质质量分数为50%的NaNO3溶液变为该温度下的饱和溶液,至少应向溶液中再加入g NaNO3固体。四、综合题
-
19. 为了探究影响物质溶解性的因素,小林设计并进行了如下实验。(1)、探究溶质的种类对物质溶解性的影响。
在实验中要改变的因素是。
要保持不变的因素是、、溶质的质量。
操作步骤:在常温下,用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入氯化钠、硝酸钾、氢氧化钙各2g,振荡,观察各物质的溶解情况。
实验现象:试管①中有少量氯化钠未溶,试管②中硝酸钾全部溶解,试管③中有多量氢氧化钙未溶。
实验结论:相同温度,相同溶剂的条件下, 。
(2)、探究温度(以硝酸钾为例)对物质溶解性的影响。在实验中要改变的因素是;要保持不变的因素是溶质的种类(硝酸钾)和质量、。
操作步骤:用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入5g硝酸钾晶体,将试管①保持在常温下,将试管②加热并保持在40℃,将试管③加热并保持在60℃,振荡,观察各试管中硝酸钾的溶解情况。
实验现象:试管①中有多量硝酸钾未溶,试管②中有少量硝酸钾未溶,试管③中硝酸钾全部溶解。
实验结论:。
20. 我国已向世界承诺在 2060 年实现“碳中和”。某工厂为实现本厂“碳中和”目标,设计了一种“捕捉”CO2的减排方案,流程如下图所示: (1)、“捕捉室”中NaOH溶液常喷成雾状,优点是。(2)、在“反应、分离室”发生反应的化学方程式为 , 该反应的基本类型为。(3)、该流程中可循环利用的物质除水外,还有。(4)、工厂要实施这一流程,还需设计“高温反应炉”零排放供热的配套方案。下列方案中可以选用的是____(填编号)。A、燃煤供热 B、燃油供热 C、聚集太阳能供热 D、燃天然气供热(5)、请写出反应①的化学方程式。(6)、实验室用检验CO2也是“捕捉”CO2的过程。工厂却不宜采用作为“捕捉”CO2的减排方案,原因是。21. 实验室有一瓶敞口放置的NaOH固体样品,为探究样品中的成分,小李同学进行如下实验:
(1)、“捕捉室”中NaOH溶液常喷成雾状,优点是。(2)、在“反应、分离室”发生反应的化学方程式为 , 该反应的基本类型为。(3)、该流程中可循环利用的物质除水外,还有。(4)、工厂要实施这一流程,还需设计“高温反应炉”零排放供热的配套方案。下列方案中可以选用的是____(填编号)。A、燃煤供热 B、燃油供热 C、聚集太阳能供热 D、燃天然气供热(5)、请写出反应①的化学方程式。(6)、实验室用检验CO2也是“捕捉”CO2的过程。工厂却不宜采用作为“捕捉”CO2的减排方案,原因是。21. 实验室有一瓶敞口放置的NaOH固体样品,为探究样品中的成分,小李同学进行如下实验: (1)、操作①是加水充分溶解,操作②的名称是。(2)、有沉淀B生成,说明NaOH固体样品中一定含有的物质是(填化学式)。(3)、有红褐色沉淀D生成的化学反应方程式为。(4)、通过实验验证,小李认为样品中一定还含有氢氧化钠请你评价小李的判断是否正确,并说明理由。22. 已知A、B、C、D、E分别为稀盐酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液、硫酸铜溶液中的一种,为鉴别该五种溶液,化学兴趣小组同学设计绘制的思维导图如图所示:
(1)、操作①是加水充分溶解,操作②的名称是。(2)、有沉淀B生成,说明NaOH固体样品中一定含有的物质是(填化学式)。(3)、有红褐色沉淀D生成的化学反应方程式为。(4)、通过实验验证,小李认为样品中一定还含有氢氧化钠请你评价小李的判断是否正确,并说明理由。22. 已知A、B、C、D、E分别为稀盐酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液、硫酸铜溶液中的一种,为鉴别该五种溶液,化学兴趣小组同学设计绘制的思维导图如图所示: (1)、C中的溶质为(填化学式);(2)、若A能使紫色石蕊试液变红,则D为(填物质名称);(3)、为鉴别B和E,加入的物质X为(写出一种即可),其中与氢氧化钙溶液反应的化学方程式为。23. 某兴趣小组选取四种碱来验证碱的化学性质,设计如下图所示实验:
(1)、C中的溶质为(填化学式);(2)、若A能使紫色石蕊试液变红,则D为(填物质名称);(3)、为鉴别B和E,加入的物质X为(写出一种即可),其中与氢氧化钙溶液反应的化学方程式为。23. 某兴趣小组选取四种碱来验证碱的化学性质,设计如下图所示实验: (1)、实验A中观察到的明显现象是。(2)、实验B中澄清石灰水变浑浊,说明可溶性碱能够与(填物质类别)反应。(3)、实验D发生反应的化学方程式为。(4)、对实验D反应后的混合物进行过滤,滤液中溶质有什么呢?
(1)、实验A中观察到的明显现象是。(2)、实验B中澄清石灰水变浑浊,说明可溶性碱能够与(填物质类别)反应。(3)、实验D发生反应的化学方程式为。(4)、对实验D反应后的混合物进行过滤,滤液中溶质有什么呢?【提出问题】同学们对滤液中溶质的成分进行了如下的猜想。
【猜想假设】猜想一:溶质只有NaOH;
猜想二:溶质为(写化学式)。
猜想三:溶质为NaOH和Ba(OH)2
(5)、【实验探究】实验操作
实验现象
实验结论
a。取少量滤液于试管中,加入过量的稀盐酸
由a、b两个实验的现象,得出猜想一正确
b。另取少量滤液于试管中,加入碳酸钠溶液
【实验反思】①实验操作a中加入过量稀盐酸的目的是。
②同学们经过讨论认为,如果只向滤液中加入过量的一种试剂,也能得出猜想一正确的结论,该试剂为。
五、计算题
-
24. 实验室中有一包CaCl2和CaCO3的混合物,化学活动小组同学为测定该混合物中CaCO3的含量,取20g样品于烧杯中,向其中加入足量的稀盐酸,测得生成的气体与加入稀盐酸的质量关系如图所示,请回答下列问题:
 (1)、恰好完全反应时,产生的气体质量为g。(2)、求样品中CaCO3的质量分数。(3)、求恰好完全反应时,所得溶液中溶质的质量分数。
(1)、恰好完全反应时,产生的气体质量为g。(2)、求样品中CaCO3的质量分数。(3)、求恰好完全反应时,所得溶液中溶质的质量分数。