辽宁省鞍山市千山区2022-2023学年九年级上学期期中化学试题
试卷更新日期:2022-12-09 类型:期中考试
一、单选题
-
1. 下列选项中不属于化学研究领域的是( )A、开发新能源应对能源危机 B、生成农药和化肥提升粮食产量 C、研发5G网络技术提升网络质量 D、研制新型可降解塑料减少环境污染2. 抗击疫情,人人有责。下列防疫措施中一定发生化学变化的是( )A、佩戴口罩 B、测量体温 C、酒精消毒 D、清水洗手3. 下列物质属于纯净物的是( )A、空气 B、牛奶 C、84消毒液 D、蒸馏水4. 下列净水操作中,单一操作净化程度最高的是( )A、蒸馏 B、沉淀 C、过滤 D、吸附5. 物质的用途在很大程度由物质的性质决定。下列物质的用途,是利用其物理性质的是( )A、氮气用于生产硝酸和氮肥 B、稀有气体可用于生产霓虹灯 C、氮气充入灯泡,延长灯泡使用寿命 D、氧气用于火箭发动机的助燃剂6. 下列物质中既有分子又有离子的是( )A、铜 B、冰水混合物 C、氧气 D、氯化钠水溶液7. 下列图示的实验操作正确的是( )A、
 溶解固体
B、
溶解固体
B、 过滤浑浊河水
C、
过滤浑浊河水
C、 把橡胶塞塞入试管
D、
把橡胶塞塞入试管
D、 检查气密性
8. 下列有关分子、原子的说法中,正确的是( )A、分子可能是由原子构成的 B、一种原子只能构成一种分子 C、气压增大,分子之间间隔变小 D、分子是保持物质性质的最小粒子9. 铜可与稀硝酸发生如下反应:。则X的化学式为( )A、NO B、NO2 C、N2 D、N2O10. 最近科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也称为“零号元素”。有关该粒子的说法正确的是( )A、不显电性 B、失去一个中子后显+1价 C、一个该粒子的质量相当于二个氢原子的质量 D、在元素周期表中与氢元素位置占同一位置11. 钛和钛合金是制造飞机的重要材料,钛酸亚铁(FeTiO3)中钛元素的化合价为( )A、+2 B、+3 C、+4 D、+512. 鉴别下列各组物质,所选的试剂或方法错误的是( )
检查气密性
8. 下列有关分子、原子的说法中,正确的是( )A、分子可能是由原子构成的 B、一种原子只能构成一种分子 C、气压增大,分子之间间隔变小 D、分子是保持物质性质的最小粒子9. 铜可与稀硝酸发生如下反应:。则X的化学式为( )A、NO B、NO2 C、N2 D、N2O10. 最近科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也称为“零号元素”。有关该粒子的说法正确的是( )A、不显电性 B、失去一个中子后显+1价 C、一个该粒子的质量相当于二个氢原子的质量 D、在元素周期表中与氢元素位置占同一位置11. 钛和钛合金是制造飞机的重要材料,钛酸亚铁(FeTiO3)中钛元素的化合价为( )A、+2 B、+3 C、+4 D、+512. 鉴别下列各组物质,所选的试剂或方法错误的是( )选项
要鉴别的物质
试剂或操作方法
A
水与过氧化氢溶液
加入少量二氧化锰粉末
B
氧气与氮气
用燃着的木条
C
酒精与糖水
闻气味
D
木炭与四氧化三铁
观察颜色
A、A B、B C、C D、D13. 推理是化学学习中常用的思维方法,下列推理正确的是( )A、离子是带电的粒子,所以带电的粒子一定是离子 B、氧化物都是由两种元素组成的纯净物,所以由两种元素组成的纯净物一定是氧化物 C、化学变化伴随有能量变化,所以有能量变化的一定是化学变化 D、元素是具有相同质子数的一类原子的总称,所以质子数相同的原子一定是同种元素14. 一定条件下,在密闭容器内发生某一化学反应,测得反应前后各物质的质量如下表所示。物质
甲
乙
丙
丁
反应前的质量/g
3.2
16.8
0.8
0.1
反应后的质量/g
x
8.4
3.0
1.0
下列说法错误的是( )
A、x=8.5 B、反应中生成丙与丁的质量比为3:1 C、乙一定是化合物 D、丙和丁的相对分子质量之比可能为22:915. 将16g纯净物R在足量氧气中完全燃烧,生成44g二氧化碳和36g水。下列判断正确的是( )A、R只含碳、氢元素 B、消耗氧气32g C、R含碳、氢、氧三种元素 D、R中碳元素的质量分数为70%二、填空题
-
16. 请用化学用语填空:(1)、2个汞原子;(2)、3个铵根离子;(3)、氧化铝中铝元素的化合价;(4)、含氧量最高的氧化物。17. 科学家开发出一种催化剂,光照下能将二氧化碳转化为甲烷,微观示意图如下。
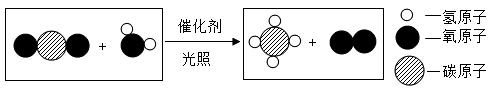
请回答:
(1)、该反应中反应前后没有改变的粒子是。(2)、参加反应的反应物的分子个数比是。18. “芯片”是电子产品的核心部件,氮化镓是制造芯片的材料之一,如图是镓元素(Ga)的原子结构示意图及元素周期表的一部分。请回答下列问题: (1)、根据镓元素的原子结构示意图判断:m= , 镓化学性质比较活泼,其阳离子符号是。(2)、镓元素属于(选填“金属”“非金属”或“稀有气体”)元素,位于元素周期表中的第周期,在(选填“X”、“Y”或“Z”)处。19. 水是一切生命体存在所必须的物质,我们必须爱护水资源,回答下列问题:(1)、电解水的实验说明水是由组成的。(2)、明矾可用于净水,是因为明矾溶于水生成的胶状物可以悬浮于水中的杂质而沉降下来。(3)、向某水样中加入肥皂水,振荡,观察到现象,说明该水样是硬水。生活中常用的方法降低水的硬度。(4)、爱护水资源,既要节约用水,也要防治水体污染,下列做法合理的是____(填字母序号)A、生活污水集中处理后再排放 B、洗脸水冲厕所 C、农业上合理使用农药和化肥 D、为降低成本,工业废水直接排放20. “醋”字可拆解为“二十一日酒变醋”,指的是一段时间内酒精 在微生物的作用下与氧气反应生成醋酸(CH3COOH)。(1)、醋酸由种元素组成。(2)、醋酸中碳元素的质量分数为。
(1)、根据镓元素的原子结构示意图判断:m= , 镓化学性质比较活泼,其阳离子符号是。(2)、镓元素属于(选填“金属”“非金属”或“稀有气体”)元素,位于元素周期表中的第周期,在(选填“X”、“Y”或“Z”)处。19. 水是一切生命体存在所必须的物质,我们必须爱护水资源,回答下列问题:(1)、电解水的实验说明水是由组成的。(2)、明矾可用于净水,是因为明矾溶于水生成的胶状物可以悬浮于水中的杂质而沉降下来。(3)、向某水样中加入肥皂水,振荡,观察到现象,说明该水样是硬水。生活中常用的方法降低水的硬度。(4)、爱护水资源,既要节约用水,也要防治水体污染,下列做法合理的是____(填字母序号)A、生活污水集中处理后再排放 B、洗脸水冲厕所 C、农业上合理使用农药和化肥 D、为降低成本,工业废水直接排放20. “醋”字可拆解为“二十一日酒变醋”,指的是一段时间内酒精 在微生物的作用下与氧气反应生成醋酸(CH3COOH)。(1)、醋酸由种元素组成。(2)、醋酸中碳元素的质量分数为。三、综合题
-
21. 小玉同学用如图所示的装置一测定空气中氧气的含量(已知:实验过程中,集气瓶和量筒中的导管口始终在水面以下)。

 (1)、用力将灼热的铜丝按下与白磷接触,观察到整个实验过程中,集气瓶中液面变化情况是。(2)、写出该实验中白磷燃烧反应的化学方程式。(3)、与装置二相比,装置一的优点是____(填字母序号)。A、结果更准确 B、减少污染 C、操作更简单(4)、下列有关说法正确的是____(填字母序号)。A、白磷量不足会导致实验结果偏小 B、装置气密性不好会导致实验结果偏小 C、灼热的铜丝消耗氧气会导致实验结果偏小 D、集气瓶内导管未伸入液面下会导致实验结果偏小22. 氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应。下面是三个检验氧气性质的实验。
(1)、用力将灼热的铜丝按下与白磷接触,观察到整个实验过程中,集气瓶中液面变化情况是。(2)、写出该实验中白磷燃烧反应的化学方程式。(3)、与装置二相比,装置一的优点是____(填字母序号)。A、结果更准确 B、减少污染 C、操作更简单(4)、下列有关说法正确的是____(填字母序号)。A、白磷量不足会导致实验结果偏小 B、装置气密性不好会导致实验结果偏小 C、灼热的铜丝消耗氧气会导致实验结果偏小 D、集气瓶内导管未伸入液面下会导致实验结果偏小22. 氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应。下面是三个检验氧气性质的实验。 (1)、实验甲中木炭燃烧结束时,可向集气瓶中加入(填试剂名称)来检验燃烧的生成物。(2)、实验乙中淡黄色固体X燃烧时,生成一种有刺激性气味的气体,产生火焰的颜色是色。(3)、实验乙、丙集气瓶中水的作用(填“相同”或“不相同”)。(4)、实验丙中发生反应的化学方程式是 , 实验发现,浓度较高的氧气是该实验成功的重要保证,现用一集气瓶(容积为250mL)收集一瓶体积分数为90%的氧气,则该集气瓶预先应先装 mL的水(计算结果保留到整数,空气中氧气的体积分数以1/5计算)。23. 微观世界缤纷多彩。小明学习了分子的性质后设计了如下实验。
(1)、实验甲中木炭燃烧结束时,可向集气瓶中加入(填试剂名称)来检验燃烧的生成物。(2)、实验乙中淡黄色固体X燃烧时,生成一种有刺激性气味的气体,产生火焰的颜色是色。(3)、实验乙、丙集气瓶中水的作用(填“相同”或“不相同”)。(4)、实验丙中发生反应的化学方程式是 , 实验发现,浓度较高的氧气是该实验成功的重要保证,现用一集气瓶(容积为250mL)收集一瓶体积分数为90%的氧气,则该集气瓶预先应先装 mL的水(计算结果保留到整数,空气中氧气的体积分数以1/5计算)。23. 微观世界缤纷多彩。小明学习了分子的性质后设计了如下实验。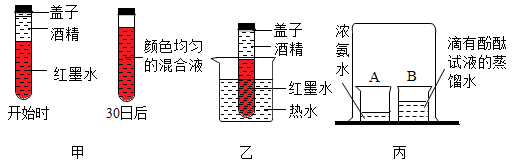 (1)、如图甲所示,先在一支试管中装大半管红墨水,再在液面上注满酒精(缓缓注入),加盖密封后静置,30日后再观察。小明做的实验除了说明分子在不断运动,还能说明的分子性质是 , 混合均匀后,分子(填“继续”或“停止”)运动。(2)、如果继续完成图乙实验操作,对比实验甲可以得出的结论是。(3)、相比于教材中的实验设计(如图丙所示),小明的实验改进最主要的优点有(答出一点即可)。24. 如图是实验室制取气体常用的装置,请回答下列问题:
(1)、如图甲所示,先在一支试管中装大半管红墨水,再在液面上注满酒精(缓缓注入),加盖密封后静置,30日后再观察。小明做的实验除了说明分子在不断运动,还能说明的分子性质是 , 混合均匀后,分子(填“继续”或“停止”)运动。(2)、如果继续完成图乙实验操作,对比实验甲可以得出的结论是。(3)、相比于教材中的实验设计(如图丙所示),小明的实验改进最主要的优点有(答出一点即可)。24. 如图是实验室制取气体常用的装置,请回答下列问题: (1)、仪器①的名称。(2)、实验室用氯酸钾和二氧化锰混合物制取氧气反应的化学方程式 , 若用D装置收集氧气,验满的方法是。(3)、实验室可用加热氯化铵固体和氢氧化钠固体混合物来制取氨气。氨气密度比空气小,极易溶于水,应选择的发生装置是(填字母序号),若用F装置收集,氨气从端进入(填“a”或“b”)。25. A~F是目前我们已学过的六种常见的物质,各物质之间的转化关系如图所示(“→”表示通过一步反应可以转化为该物质,部分反应条件、反应物、生成物已略去)。已知:这六种物质中都含有同一种元素,D是一种单质。请回答下列问题:
(1)、仪器①的名称。(2)、实验室用氯酸钾和二氧化锰混合物制取氧气反应的化学方程式 , 若用D装置收集氧气,验满的方法是。(3)、实验室可用加热氯化铵固体和氢氧化钠固体混合物来制取氨气。氨气密度比空气小,极易溶于水,应选择的发生装置是(填字母序号),若用F装置收集,氨气从端进入(填“a”或“b”)。25. A~F是目前我们已学过的六种常见的物质,各物质之间的转化关系如图所示(“→”表示通过一步反应可以转化为该物质,部分反应条件、反应物、生成物已略去)。已知:这六种物质中都含有同一种元素,D是一种单质。请回答下列问题: (1)、写出①反应的化学方程式;该反应的基本反应类型是反应。(2)、写出②反应的化学方程式。26. CuSO4是化学实验中常见的试剂。(1)、验证质量守恒定律。
(1)、写出①反应的化学方程式;该反应的基本反应类型是反应。(2)、写出②反应的化学方程式。26. CuSO4是化学实验中常见的试剂。(1)、验证质量守恒定律。
步骤一:如图1所示,称量装有CuSO4溶液的烧杯和几根用砂纸打磨干净的铁钉的总质量,并记录。
步骤二:将铁钉浸入该烧杯的CuSO4溶液中一段时间,观察现象。
步骤三:待步骤二的烧杯中有明显现象后,如图2所示,称量烧杯及其所盛物质的总质量,并记录。
请回答下列问题:
①用砂纸将铁钉打磨干净的作用是。
②步骤二中可观察到明显的实验现象是。
③若将上述CuSO4溶液和铁钉分别换成稀盐酸和碳酸钠粉末进行实验,能否用于验证质量守恒定律(填“能”或“否”),原因是。
(2)、探究CuSO4溶液对H2O2分解具有催化作用。【实验探究】甲同学按如下方案进行实验。
实验步骤
实验现象
实验结论

步骤①木条不复燃;
步骤②产生气泡,溶液变蓝色;
步骤③。
硫酸铜能作过氧化氢分解的催化剂,该反应的化学方程式为。
【评价改进】大家认为甲同学的实验结论不严谨。若要确定该实验结论正确,还需证明硫酸铜的在反应前后都没有发生改变。
【继续探究】乙同学重做了以下实验,进而确认了甲同学的实验结论。
步骤一:称量mg硫酸铜固体(白色)。
步骤二:按照甲同学实验步骤重新实验。
步骤三:将实验后试管中的溶液蒸发、干燥得到白色固体,再称其质量为g,然后将此固体加入到5%的过氧化氢溶液中,仍然可以加速过氧化氢分解。
【拓展延伸】比较硫酸铜和二氧化锰对过氧化氢制氧气的催化效果,实验过程中不需要控制的条件是。(填字母序号)。
A.溶液的起始温度 B.催化剂的质量 C.溶液的浓度 D.反应起始时间
四、计算题
-
27. 工业上煅烧25t石灰石(主要成分是CaCO3)制取氧化钙(CaO),充分反应后,剩余固体16.2t,则所用石灰石中碳酸钙的质量分数为多少?(已知:石灰石中的杂质不参加反应,且残留在氧化钙中,该反应的化学方程式为:)