山东省潍坊安丘市2022-2023学年高二上学期期中考试化学试题
试卷更新日期:2022-12-07 类型:期中考试
一、单选题
-
1. 化学与生活、生产、科技等密切相关。下列说法错误的是( )A、草木灰与铵态氮肥不能混合施用 B、热的纯碱溶液去油污效果更好 C、明矾既可以净化水体,又可以杀菌消毒 D、在轮船外壳上镶入锌块可减缓船体的腐蚀速率2. 一定温度下,密闭容器中发生反应:。当反应达到平衡后,下列各项措施不能提高SO3转化率的是( )A、升高反应的温度 B、增大容器的体积 C、分离出部分氧气 D、容积不变,通入气体He3. 蚂蚁体内分泌的蚁酸(即甲酸,化学式为HCOOH,属于有机酸)会使皮肤发痒。下列说法错误的是( )A、被蚂蚁叮咬后及时涂抹肥皂水,能起到止痒作用 B、加热或稀释HCOOH溶液,其电离程度均增大 C、HCOOH的电离和电解都需要通电 D、的HCOOH和HCOONa混合溶液中4. 探究水的行为有重要意义。下列说法错误的是( )A、将水加热,增大,pH减小,但仍呈中性 B、向水中加入少量金属钠,水的电离平衡正向移动,增大 C、向醋酸溶液中加水,溶液中水电离产生的将减小 D、相同温度下,pH相同的NaOH溶液和氨水溶液中水的电离程度相同5. 常温下,溶液中存在平衡 , 滴加酚酞溶液呈红色。下列说法正确的是( )A、加入NaOH固体,溶液pH减小 B、加入固体,浓度变大 C、升高温度,溶液红色变浅 D、稀释溶液,减小6. 已知反应。下列说法错误的是( )A、其他条件不变,压缩体积,正逆反应速率增大 B、C(s)的质量不再改变说明反应已达平衡状态 C、其他条件不变,升高温度,平衡正向移动,平衡常数不变 D、一定条件下,1mol C(s)和1mol (g)反应达到平衡时转化率为10% ,吸收的热量为;相同条件下,1mol (g)和1mol CO(g)反应达到平衡时转化率为10%,放出的热量为 , 则等于7. 上海交通大学仇毅翔等研究了不同催化剂催化乙烯加成制取乙烷[ ]的反应历程如图所示。下列说法错误的是( )
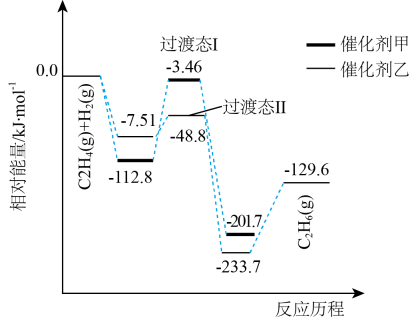 A、 B、该历程中最大活化能 C、催化剂甲催化效果好,反应速率快 D、乙烯制乙烷反应的原子利用率是100%8. 二氧化氯()是一种高效、广谱、快速、安全的杀菌消毒剂。目前一种电解法制取新工艺的工作原理如图,电极材料均为石墨烯。下列说法错误的是( )
A、 B、该历程中最大活化能 C、催化剂甲催化效果好,反应速率快 D、乙烯制乙烷反应的原子利用率是100%8. 二氧化氯()是一种高效、广谱、快速、安全的杀菌消毒剂。目前一种电解法制取新工艺的工作原理如图,电极材料均为石墨烯。下列说法错误的是( ) A、产物X是 B、离子交换膜属于阳离子交换膜 C、阳极反应为 D、生成0.1mol 时,阴极生成0.5mol NaOH9. 硝酸厂常用催化还原法处理尾气,在催化条件下可以将还原为 , 反应原理为 , 的平衡转化率随温度或压强的变化如图所示。下列说法正确的是( )
A、产物X是 B、离子交换膜属于阳离子交换膜 C、阳极反应为 D、生成0.1mol 时,阴极生成0.5mol NaOH9. 硝酸厂常用催化还原法处理尾气,在催化条件下可以将还原为 , 反应原理为 , 的平衡转化率随温度或压强的变化如图所示。下列说法正确的是( )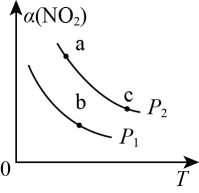 A、速率大小: B、 C、平衡常数: D、使用合适的催化剂,的平衡转化率增大10. 恒温恒容的密闭容器中,在催化剂表面发生分解反应 , 在不同的起始浓度和催化剂表面积条件下,测得浓度随时间的变化如下表。下列说法错误的是( )
A、速率大小: B、 C、平衡常数: D、使用合适的催化剂,的平衡转化率增大10. 恒温恒容的密闭容器中,在催化剂表面发生分解反应 , 在不同的起始浓度和催化剂表面积条件下,测得浓度随时间的变化如下表。下列说法错误的是( )编号
时间/min
表面积/
0
20
40
60
80
①
a
2.40
2.00
1.60
1.20
0.80
②
a
1.20
0.80
0.40
x
③
2a
2.40
1.60
0.80
0.40
0.40
A、实验①,20~ 40min, B、实验②,60min时处于平衡状态,则 C、相同条件下,的浓度增大,反应速率无影响 D、相同条件下,催化剂的表面积增大,反应速率增大11. 一种新型可充电钠离子电池的工作原理如图所示。下列说法正确的是( ) A、放电时,Mo箔为正极 B、充电时,通过交换膜从右室移向左室 C、放电时,外电路中通过0.1mol电子时,左室中生成 D、充电时,阴极反应为12. 一定条件下,向体积为1L的密闭刚性容器中充入4mol和1mol , 发生反应 , 反应过程中测得温度对的平衡转化率和催化剂催化效率的影响如图所示。已知:M点总压强为1MPa,气体分压=气体总压×体积分数。下列说法错误的是( )
A、放电时,Mo箔为正极 B、充电时,通过交换膜从右室移向左室 C、放电时,外电路中通过0.1mol电子时,左室中生成 D、充电时,阴极反应为12. 一定条件下,向体积为1L的密闭刚性容器中充入4mol和1mol , 发生反应 , 反应过程中测得温度对的平衡转化率和催化剂催化效率的影响如图所示。已知:M点总压强为1MPa,气体分压=气体总压×体积分数。下列说法错误的是( ) A、 B、N点压强大于1MPa C、M点时,用平衡分压代替平衡浓度表示的化学平衡常数 D、其他条件不变,若不使用催化剂,则250℃时的平衡转率可能位于点
A、 B、N点压强大于1MPa C、M点时,用平衡分压代替平衡浓度表示的化学平衡常数 D、其他条件不变,若不使用催化剂,则250℃时的平衡转率可能位于点二、多选题
-
13. 下列有关实验的操作、现象和结论都正确的是( )
选项
实验操作
现象
结论
A
将装有和混合气体的烧瓶分别浸入冷水和热水中,并与常温情况进行对比()
冷水中烧瓶内气体颜色变浅,热水中烧瓶内气体颜色加深
升高温度,化学平衡向吸热方向移动,降低温度,向放热方向移动
B
在两个烧杯中分别盛有等体积、等浓度的烧碱溶液和氨水,插入电极,连接灯泡,接通电源,分别进行导电实验
盛有烧碱溶液的灯泡亮度大
强电解质导电能力大于弱电解质
C
向盛有溶液(显黄色)的①、②两只试管中分别滴加淀粉溶液、溶液
①中溶液变蓝,②中产生黄色沉淀
溶液中存在平衡:
D
用pH试纸分别测定等物质的量浓度的和NaClO的pH
pH:
酸性:
A、A B、B C、C D、D14. 室温下,向20mL 的HA溶液中逐滴加入NaOH溶液(忽略溶液体积变化),溶液中由水电离出的浓度的负对数与NaOH溶液体积关系如图所示。下列说法错误的是( ) A、b点溶液中 B、c点和e点溶液均呈中性 C、在滴加过程中,先减小后增大 D、室温下,的HA溶液中15. 常温下,取10mL浓度均为的溶液和溶液,分别加水稀释,稀释过程中随溶液体积的对数值的变化曲线如图所示。
A、b点溶液中 B、c点和e点溶液均呈中性 C、在滴加过程中,先减小后增大 D、室温下,的HA溶液中15. 常温下,取10mL浓度均为的溶液和溶液,分别加水稀释,稀释过程中随溶液体积的对数值的变化曲线如图所示。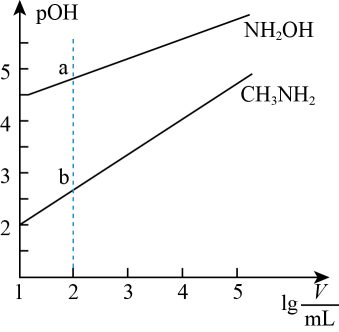
已知:
下列说法错误的是( )
A、 B、常温下,等物质的量浓度的和溶液,前者的pH小 C、用相同浓度的盐酸分别中和a和b点对应的溶液,所需盐酸体积相同 D、常温下,浓度均为的与的混合液显碱性三、综合题
-
16. 某小组在进行Cu与反应实验时,发现实验1比对照组反应速率快,对影响实验1速率的因素展开实验探究(实验用铜片规格相同)。
实验
实验操作
现象
对照组
向5.0mL 稀硝酸中加入铜片
加入铜片后短时间内无明显现象,一段时间后有少量气泡产生
实验1
向浓硝酸中加入少量铜粉完全溶解,然后稀释反应后混合溶液至其中硝酸浓度为 , 取5.0mL稀释液,加入铜片
加入铜片后立即产生气泡
回答下列问题:
(1)、实验1反应后混合液中可能含有(填化学式)、、少量、。(2)、预测和探究影响实验1速率加快的原因。假设1:对反应有催化作用
假设2:对反应有催化作用
假设3:对反应有催化作用
为验证预测是否正确,继续进行下列实验
实验
实验操作
实验现象
实验结论
实验2
向5.0mL 稀硝酸中加入铜片和少量 固体
溶液呈浅蓝色,速率没有明显变化
假设1不成立
实验3
方案1
向5.0mL 稀硝酸中通入少量 , 然后加入铜片
铜片表面立即产生气泡,反应持续进行
假设2成立
方案2
取5.0mL实验1稀释后溶液,先通入数分钟,再加入铜片
铜片表面产生气泡的速率比实验1明显变慢,比对照组略快
实验4
假设3成立
①实验2中加入的固体为(填化学式)。
②有同学认为实验3的方案1不严谨,应补充对比实验:向5.0mL 稀硝酸中加入数滴硝酸,加入铜片,反应速率无明显变化。补充该实验的原因是。实验3方案2中,铜片表面产生气泡的速率比实验1明显变慢的原因是。
③将实验4的实验操作和实验现象补充完整。
17. 研究溶于水后的行为对的吸收再利用有重要意义。常温下,水溶液中含碳微粒的pC( , c表示微粒浓度)随溶液pH的变化如图所示。回答下列问题:已知:25℃时,HBrO的电离平衡常数
 (1)、下列说法正确的是(填序号)。
(1)、下列说法正确的是(填序号)。a.A点,溶液中和浓度相同
b.当时,
c.A点时水的电离程度小于B点
(2)、向B点溶液中逐滴滴加NaOH溶液,溶液状态向(填“A”、“C”或“D”)变化,主要反应的离子方程式是。(3)、、HBrO的酸性由强到弱的顺序为 , 将少量气体通入NaBrO溶液中发生反应的离子方程式为;25℃,NaBrO溶液的。(4)、从盐类水解原理角度设计一个合理且易操作的方案(药品可任取),证明碳酸是弱电解质。。18. 游泳池水需定期杀菌消毒,常采用84消毒液、氯水等消毒剂。回答下列问题:(1)、84消毒液呈碱性,用离子方程式解释原因 , 某84消毒液中NaCl和NaClO的浓度均为 , 则该溶液中。(2)、学习小组在光照条件下用传感器技术测得常温下饱和氯水的pH及氯离子浓度随时间的变化如图所示。
①图中表示饱和氯水的pH随时间变化的曲线是(填“M”或“N”)。
②a点溶液中(用相关微粒的物质的量浓度表示),光照一段时间后,溶液颜色逐渐变浅,b点溶液中离子浓度的大小关系为。
③a、b、c三点水的电离程度由大到小为。
19. 工业以和为原料合成尿素(),在合成塔中存在如图转化:
回答下列问题:
(1)、的。(2)、保持容器体积不变,在(1)反应初期,下列措施可以提高转化率的是(填序号)。a.增大的浓度
b.增大水的分压(分压=总压×物质的量分数)
c.通入惰性气体
d.使用合适的催化剂
(3)、测得合成塔中液相反应的平衡转化率与温度、初始氨碳比[]、初始水碳比[]关系如图所示。
①图中(填“>”“<”或“=”下同),。
②其他条件不变,随温度升高,的平衡转化率先上升后下降,“先上升”的原因是。
③对于液相反应体系,常用某组分M达到平衡时的物质的量分数x(M)表示平衡常数()。若 , , 当反应达平衡时, , 则195℃时,反应的(保留小数点后两位)。
20. 草酸()是一种有机二元弱酸,在科学研究和工业生产中均有重要应用。回答下列问题:(1)、草酸可以使酸性高锰酸钾()溶液褪色,生成+2价锰离子,用在定量分析中测定高锰酸钾的浓度。①写出草酸使酸性高锰酸钾溶液褪色的离子方程式。
②常温下,用草酸晶体配一定浓度的草酸标准溶液,需经过称量、溶解、转移、定容等操作。则“定容”操作时,溶液中的值(填“变大”、“变小”或“不变”)。
(2)、常温下,向100mL溶液中加入NaOH溶液调节pH,加水控制溶液体积为200mL,测得溶液中微粒的随pH变化如图所示。[ , x代表、或]

的电离平衡常数;当 pH为时,溶液中;M点溶液中的物质的量浓度为。
(3)、工业上采用惰性电极电解饱和草酸可制得乙醛酸(OHC-COOH),阴极的电极反应式为。