辽宁省沈阳市五校协作体2022-2023学年高二上学期期中考试化学试题
试卷更新日期:2022-12-07 类型:期中考试
一、单选题
-
1. 近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是( )A、氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B、氢硫酸的导电能力低于相同浓度的亚硫酸 C、0.10mol/L的氢硫酸和亚硫酸的pH分别为4.5和2.1 D、氢硫酸的还原性强于亚硫酸2. 设为阿伏加德罗常数的值,下列说法正确的是( )A、常温下,的纯碱溶液中,由水电离产生的数目为 B、溶液中数目小于 C、室温下,相同的氯化铵溶液和硫酸铵溶液中浓度相同 D、的水溶液中含有的氧原子数目为3. 近年来我国科学家发现了一系列铁系超导材料,其中一类为Fe-Nd-B-N组成的化合物。下列说法正确的是( )A、硼元素电负性大于氮元素电负性 B、基态Fe原子核外电子占据的轨道总数为13 C、Nd的价层电子排布式为4f46s2 , 则Nd2+价层电子排布式为4f26s2 D、第二周期的基态原子与硼未成对电子数相等的元素(除硼之外)有2种4. 在25 ℃时,向V mL pH=a的盐酸中滴加pH=b的NaOH溶液10V mL,所得混合溶液中c(Na+)= c(Cl-),则此时a+b的值是( )A、15 B、14 C、13 D、不能确定5. 下列问题,与盐类水解有关的是( )
①与溶液可作焊接金属时的除锈剂
②与两种溶液用于制造泡沫灭火器
③将含有的水垢用溶液处理,使之转化为硫松、易溶于酸的
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干溶液得到固体
⑥热的纯碱溶液去除油污的效果好
A、①②③④ B、①②③④⑥ C、①②④⑤⑥ D、全部6. 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法错误的是( ) A、a管发生吸氧腐蚀,b管发生析氢腐蚀 B、一段时间后,a管液面高于b管液面 C、a处溶液的pH增大,b处溶液的pH减小 D、a、b两处具有相同的电极反应式:Fe-2e-=Fe2+7. 下列实验操作、实验现象及解释或结论都正确且有因果关系的是( )
A、a管发生吸氧腐蚀,b管发生析氢腐蚀 B、一段时间后,a管液面高于b管液面 C、a处溶液的pH增大,b处溶液的pH减小 D、a、b两处具有相同的电极反应式:Fe-2e-=Fe2+7. 下列实验操作、实验现象及解释或结论都正确且有因果关系的是( )实验操作
实验现象
解释或结论
A
向饱和硼酸溶液中加入少量粉末
无气泡冒出
酸性:碳酸>硼酸
B
将等物质的量的溶液与溶液混合
有白色沉淀和气体生成
二者水解相互促进生成氢氧化铝沉淀
C
向溶液滴加溶液,再向其中滴加溶液
先生成白色沉淀,后有黄色沉淀生成
D
常温下,用玻璃棒蘸取某浓度溶液滴在湿润的试纸中央,与标准比色卡对比
为13
该溶液的浓度为
A、A B、B C、C D、D8. 下列有关电化学的装置与阐述正确的是( )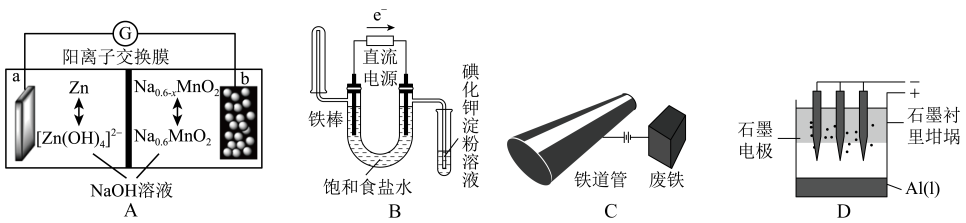 A、图A是新型可充电Na-Zn双离子电池,充电时阴极区溶液pH增大 B、图B是验证NaCl溶液(含酚酞)的电解产物 C、图C是外加电流法保护铁管道 D、图D是电解熔融氯化铝制备金属铝9. 氯碱工业的一种节能新工艺是将电解池与燃料电池相组合,相关物料的传输与转化关系如图所示(电极未标出)。下列说法正确的是( )
A、图A是新型可充电Na-Zn双离子电池,充电时阴极区溶液pH增大 B、图B是验证NaCl溶液(含酚酞)的电解产物 C、图C是外加电流法保护铁管道 D、图D是电解熔融氯化铝制备金属铝9. 氯碱工业的一种节能新工艺是将电解池与燃料电池相组合,相关物料的传输与转化关系如图所示(电极未标出)。下列说法正确的是( ) A、电解池的阴极反应式为2H2O+2e-=H2↑+2OH- B、通入空气的电极为负极 C、电解池中产生2 mol Cl2时,理论上燃料电池中消耗0.5 mol O2 D、a、b、c的大小关系为a>b=c10. 利用燃料电池电解制备并得到副产物 , 装置如图所示。下列说法错误的是( )
A、电解池的阴极反应式为2H2O+2e-=H2↑+2OH- B、通入空气的电极为负极 C、电解池中产生2 mol Cl2时,理论上燃料电池中消耗0.5 mol O2 D、a、b、c的大小关系为a>b=c10. 利用燃料电池电解制备并得到副产物 , 装置如图所示。下列说法错误的是( )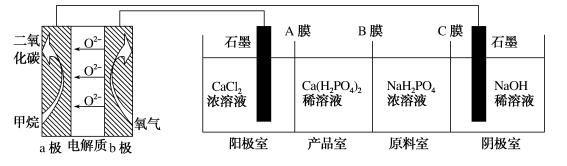 A、a极的电极反应式为 B、A膜和C膜均为阳离子交换膜 C、可用铁电极替换阴极的石墨电极 D、a极上通入(标准状况)甲烷,阳极室减少11. 由同周期元素原子W、X、Y、Z构成的一种阴离子(如图),Y的最外层电子数等于X的核外电子总数,四种原子最外层电子数之和为20。下列说法正确的是( )
A、a极的电极反应式为 B、A膜和C膜均为阳离子交换膜 C、可用铁电极替换阴极的石墨电极 D、a极上通入(标准状况)甲烷,阳极室减少11. 由同周期元素原子W、X、Y、Z构成的一种阴离子(如图),Y的最外层电子数等于X的核外电子总数,四种原子最外层电子数之和为20。下列说法正确的是( ) A、W、X、Y、Z第一电离能由大到小依次是: B、Y形成的简单离子的半径比Z形成的简单离子的半径小 C、X形成的最简单气态氢化物稳定性强于Z的气态氢化物稳定性 D、W、Z形成的化合物分子中各原子均满足8电子稳定结构12. 如下所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是( )
A、W、X、Y、Z第一电离能由大到小依次是: B、Y形成的简单离子的半径比Z形成的简单离子的半径小 C、X形成的最简单气态氢化物稳定性强于Z的气态氢化物稳定性 D、W、Z形成的化合物分子中各原子均满足8电子稳定结构12. 如下所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是( ) A、a是电源的负极 B、通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色 C、随着电解的进行,CuCl2溶液浓度变大 D、当 完全溶解时,至少产生气体336mL (折合成标准状况下)13. 室温下,将两种浓度均为的溶液等体积混合,假设混合后溶液的体积等于混合前两溶液的体积之和,下列各混合溶液中微粒的物质的量浓度关系正确的是( )A、的混合溶液: B、混合溶液: C、混合: D、混合溶液:14. 已知相同温度下, 。某温度下,饱和溶液中 、 、与 的关系如图所示。
A、a是电源的负极 B、通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色 C、随着电解的进行,CuCl2溶液浓度变大 D、当 完全溶解时,至少产生气体336mL (折合成标准状况下)13. 室温下,将两种浓度均为的溶液等体积混合,假设混合后溶液的体积等于混合前两溶液的体积之和,下列各混合溶液中微粒的物质的量浓度关系正确的是( )A、的混合溶液: B、混合溶液: C、混合: D、混合溶液:14. 已知相同温度下, 。某温度下,饱和溶液中 、 、与 的关系如图所示。
下列说法正确的是( )
A、曲线①代表 的沉淀溶解曲线 B、该温度下 的 值为 C、加适量 固体可使溶液由a点变到b点 D、 时两溶液中15. 已知亚磷酸(H3PO3)为二元弱酸。25℃时,向20 mL0.1 mol/L H3PO3溶液中滴加同浓度NaOH溶液,混合溶液中的有关粒子浓度之比的对数与溶液pH的关系如图所示,下列叙述正确的是( )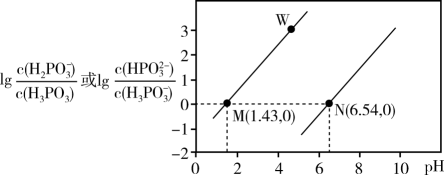 A、M、W两点所在的直线表示lg与pH的关系 B、当pH=3时,c(H2PO)>c(HPO)>c(H3PO3) C、N点:3c(H2PO)=c(Na+)+c(H+)-c(OH-) D、25℃时,HPO+H2OH2PO+OH-的平衡常数为10-12.57
A、M、W两点所在的直线表示lg与pH的关系 B、当pH=3时,c(H2PO)>c(HPO)>c(H3PO3) C、N点:3c(H2PO)=c(Na+)+c(H+)-c(OH-) D、25℃时,HPO+H2OH2PO+OH-的平衡常数为10-12.57二、综合题
-
16. 如表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。试回答下列问题:
 (1)、基态e原子中电子占据最高能级的符号是 , 占据该能级电子的电子云轮廓图为形,基态e原子核外共有种不同运动状态的电子。(2)、元素i位于元素周期表的区,基态核外电子的空间运动状态有种。(3)、g的元素符号 , 其基态原子的价电子排布式为。(4)、元素b、c、d的第一电离能从大到小的顺序是。(用元素符号表示)(5)、写出元素h的价层电子排布图。(6)、N能层只有一个电子的元素是17. 亚硝酸钠(NaNO2)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:HNO2为弱酸,在酸性溶液中,可将还原为Mn2+且无气体生成。(1)、 (一)亚硝酸钠固体含量的测定:
(1)、基态e原子中电子占据最高能级的符号是 , 占据该能级电子的电子云轮廓图为形,基态e原子核外共有种不同运动状态的电子。(2)、元素i位于元素周期表的区,基态核外电子的空间运动状态有种。(3)、g的元素符号 , 其基态原子的价电子排布式为。(4)、元素b、c、d的第一电离能从大到小的顺序是。(用元素符号表示)(5)、写出元素h的价层电子排布图。(6)、N能层只有一个电子的元素是17. 亚硝酸钠(NaNO2)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:HNO2为弱酸,在酸性溶液中,可将还原为Mn2+且无气体生成。(1)、 (一)亚硝酸钠固体含量的测定:称取NaNO2固体样品(杂质不与酸性KMnO4溶液反应)4.000 g溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.1000 mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数
1
2
3
4
KMnO4溶液体积/mL
20.60
20.02
20.00
19.98
第一组实验数据出现异常,造成这种异常的原因可能是____( (填字母)。
A、酸式滴定管用蒸馏水洗净后未用标准液润洗 B、锥形瓶洗净后未干燥 C、滴定结束后仰视读数(2)、滴定时,将高锰酸钾标准溶液注入(填“酸”或“碱”)式滴定管中。(3)、该实验滴定终点现象是。(4)、根据表中数据,计算所得固体中亚硝酸钠(M=69 g/mol)的质量分数是。(5)、 (二)反应废液的处理:反应后溶液中存在的硝酸根,可以采用电化学降解法进行处理。25℃时,反应进行10 min,溶液的pH由7变为12,电化学降解的原理如图所示。
电源正极为(填A或B),阴极反应式为。
 18. 自然界是各类物质相互依存、各种变化相互制约的复杂平衡体系,而水溶液中的离子平衡是其中一个重要方面。请根据所学知识,回答下列问题:(1)、Ⅰ.电离平衡常数是衡量弱电解质电离程度的量,已知如表数据(25℃):
18. 自然界是各类物质相互依存、各种变化相互制约的复杂平衡体系,而水溶液中的离子平衡是其中一个重要方面。请根据所学知识,回答下列问题:(1)、Ⅰ.电离平衡常数是衡量弱电解质电离程度的量,已知如表数据(25℃):化学式
CH3COOH
H2CO3
HA
HClO
HCOOH
电离常数
0.1 mol/L的CH3COOK溶液和0.1 mol/LHCOONa溶液相比,c(K+)-c(CH3COO-)c(Na+)-c(HCOO-) (填“<”、“=”或“>”)。
(2)、25℃时,向NaA溶液中通入少量CO2 , 所发生反应的化学方程式为。(3)、向0.1 mol/LHCOOH溶液中滴加相同浓度的NaOH溶液,当溶液中c(HCOOH):c(HCOO-)=5:9时,此时溶液的pH=。(4)、Ⅱ.常温下,向20 mL某浓度的硫酸中滴入0.1 mol/L氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示:
请回答下列问题:
a、b、c、d四个点水电离程度由大到小的顺序为。
(5)、V=mL,c点溶液中离子浓度由大到小顺序为。(6)、a、b、c、d四个点溶液显中性的是。(7)、NH3·H2O的电离常数K约为。19. 氧化钴在工业、电子、电讯等领域都有着广阔的应用前景。以铜钴矿石(主要成分为和 , 还有的氧化物)为原料制备氧化钴的工艺流程如图所示: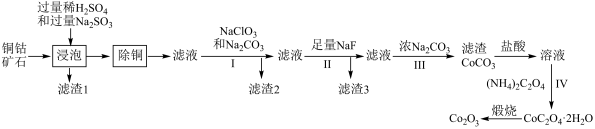
已知:常温下;完全沉淀的约为3.2。
请回答下列问题:
(1)、“浸泡”过程中,所得滤渣1中的物质是 , 写出此过程中与反应的离子方程式。(2)、“除铜”过程中需加入固体,写出该过程发生反应的离子方程式。(3)、为检验除铜后滤液中是否含有 , 取少量滤液,滴加2滴。溶液,反应的现象为产生特征的蓝色沉淀,其反应的离子方程式为:。(4)、过程Ⅰ加入溶液调节至4.0左右,其目的为。(5)、已知某温度下。该温度下,步骤Ⅱ中加入足量的溶液可将沉淀除去,若所得滤液中 , 则滤液中为。(6)、工业上采取电解精炼制取时,常选用为电解质溶液进行电解,“粗钴”应与电源(填“正”或“负”)极相连,另一极为石墨电极,则阴极的电极反应为。