辽宁省葫芦岛市四校2022-2023学年高二上学期期中联考化学试题
试卷更新日期:2022-12-07 类型:期中考试
一、单选题
-
1. 下列有关能源与能量的说法正确的是( )A、风能、太阳能、潮汐能等清洁能源的使用,有利于“碳达峰”的实现 B、化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种 C、已知 , 则金刚石比石墨稳定 D、所有反应的反应热都可以通过量热计直接测量2. 下列判断错误的是( )
①反应NH3(g)+HCl(g) ═ NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0
②CaCO3(s) ═ CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
③一定温度下,反应MgCl2(l) ═ Mg(l)+Cl2(g)的ΔH>0、ΔS>0
④常温下,反应C(s)+CO2(g) ═ 2CO(g)不能自发进行,则该反应的ΔH>0
A、①③ B、②③ C、②④ D、①②3. 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。下列有关说法错误的是( ) A、三点溶液中c(CH3COO-):b>a>c B、三点溶液中醋酸的电离程度:c>b>a C、三点溶液用等浓度的KOH溶液中和,消耗KOH溶液的体积:a=b=c D、若用湿润的pH试纸测量a处溶液的pH,测量结果偏大4. 根据下列实验操作和现象所得到的结论正确的是( )
A、三点溶液中c(CH3COO-):b>a>c B、三点溶液中醋酸的电离程度:c>b>a C、三点溶液用等浓度的KOH溶液中和,消耗KOH溶液的体积:a=b=c D、若用湿润的pH试纸测量a处溶液的pH,测量结果偏大4. 根据下列实验操作和现象所得到的结论正确的是( )选项
操作
现象
结论
A
用pH试纸分别测量NaNO2和CH3COONa溶液的pH
NaNO2溶液的pH约为8,CH3COONa溶液的pH约为9
Ka(HNO2)>Ka(CH3COOH)
B
用pH试纸测量0.1mol·L-1NaHSO3溶液的pH
pH约为5
溶液中HSO的电离>水解
C
向滴有酚酞的氨水中加入CH3COONH4固体
溶液的红色变浅
CH3COONH4溶液呈酸性
D
室温下,向密闭容器中充入NO2 , 达平衡后,再慢慢扩大容器体积
最终容器中气体颜色比初次平衡时浅
2NO2(g)N2O4(g)(无色)该平衡正向移动
A、A B、B C、C D、D5. 一元酸HX和HY都是20mL,分别用滴定,滴定曲线如图,下列说法正确的是( ) A、用滴定HX时,选用甲基橙做指示剂,测定结果偏低 B、HX可能是HCl,HY可能是 C、HX和HY的物质的量浓度可能都为1mol/L D、a和b对应溶液的导电性相同6. 关于如图所示各装置的叙述中,正确的是( )
A、用滴定HX时,选用甲基橙做指示剂,测定结果偏低 B、HX可能是HCl,HY可能是 C、HX和HY的物质的量浓度可能都为1mol/L D、a和b对应溶液的导电性相同6. 关于如图所示各装置的叙述中,正确的是( ) A、图1是原电池,总反应是: B、图2可验证铁的吸氧腐蚀,负极反应式为: C、图3装置可在待镀铁件表面镀铜 D、装置④中钢闸门应与外接电源的负极相连被保护,该方法叫做牺牲阳极法7. 下列各组溶液中的各种溶质的物质的量浓度均为0.1 mol•L-1:①H2S溶液、②KHS溶液、③K2S溶液、④H2S和KHS混合溶液(已知常温下KHS溶液的pH>7)。下列说法正确的是( )A、溶液的pH从大到小的顺序为③>②>①>④ B、在H2S和KHS混合溶液中:c(H2S)+c(HS-)+c(S2-)=c(K+) C、c(H2S)从大到小的顺序为①>④>③>② D、在KHS溶液中:c(H+)+c(K+)=c(HS-)+2c(S2-)+c(OH-)8. 科学工作者研发了一种SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法错误的是( )
A、图1是原电池,总反应是: B、图2可验证铁的吸氧腐蚀,负极反应式为: C、图3装置可在待镀铁件表面镀铜 D、装置④中钢闸门应与外接电源的负极相连被保护,该方法叫做牺牲阳极法7. 下列各组溶液中的各种溶质的物质的量浓度均为0.1 mol•L-1:①H2S溶液、②KHS溶液、③K2S溶液、④H2S和KHS混合溶液(已知常温下KHS溶液的pH>7)。下列说法正确的是( )A、溶液的pH从大到小的顺序为③>②>①>④ B、在H2S和KHS混合溶液中:c(H2S)+c(HS-)+c(S2-)=c(K+) C、c(H2S)从大到小的顺序为①>④>③>② D、在KHS溶液中:c(H+)+c(K+)=c(HS-)+2c(S2-)+c(OH-)8. 科学工作者研发了一种SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法错误的是( ) A、过程Ⅰ得到的中N元素-3价 B、过程II生成W的反应为 C、过程Ⅲ涉及的反应为 D、讨程Ⅲ中能量的转化形式为化学能转化为电能9. 温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和 , 发生反应: , 反应相同时间,测得各容器中的转化率与容器体积的关系如图所示。下列说法正确的是( )
A、过程Ⅰ得到的中N元素-3价 B、过程II生成W的反应为 C、过程Ⅲ涉及的反应为 D、讨程Ⅲ中能量的转化形式为化学能转化为电能9. 温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和 , 发生反应: , 反应相同时间,测得各容器中的转化率与容器体积的关系如图所示。下列说法正确的是( ) A、T℃时,该反应的化学平衡常数为 B、图中c点所示条件下, C、向a点平衡体系中充入一定量的 , 达到平衡时,的转化率比原平衡大 D、容器内的压强:10. 利用下列实验装置进行的实验不能达到相应实验目的的是( )
A、T℃时,该反应的化学平衡常数为 B、图中c点所示条件下, C、向a点平衡体系中充入一定量的 , 达到平衡时,的转化率比原平衡大 D、容器内的压强:10. 利用下列实验装置进行的实验不能达到相应实验目的的是( ) A、①测量中和反应的反应热 B、②测量锌与稀硫酸反应的反应速率 C、③探究温度对平衡的影响 D、④探究压强对平衡的影响11. 常温下,用盐酸滴定溶液,其滴定曲线如图所示。下列说法正确的是( )
A、①测量中和反应的反应热 B、②测量锌与稀硫酸反应的反应速率 C、③探究温度对平衡的影响 D、④探究压强对平衡的影响11. 常温下,用盐酸滴定溶液,其滴定曲线如图所示。下列说法正确的是( ) A、a点溶液中 B、b液中 C、的水解常数的数量级为 D、d点溶液中存在12. 已知:①
A、a点溶液中 B、b液中 C、的水解常数的数量级为 D、d点溶液中存在12. 已知:①②
③
④
下列说法正确的是( )
A、的燃烧热为 B、 C、相同质量的和完全燃烧,放出的热量多 D、 , 理论上可利用该反应设计成原电池13. 我国学者结合实验与计算机模拟结果,研究了均相NO—CO的反应历程,该反应经历了I、II、III三个过渡态。下图中显示的是反应路径中每一个阶段内各驻点的能量相对于此阶段内反应物能量的能量之差,则下列说法中错误的是( )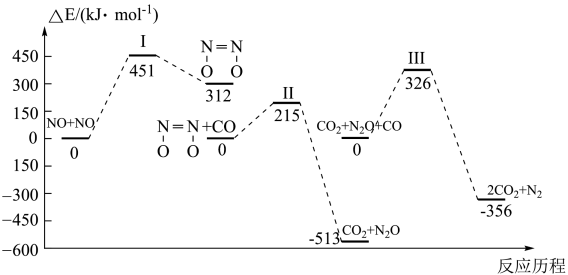 A、比
A、比 更容易与CO发生反应
B、
C、整个反应分为三个基元反应阶段,其中第一个反应阶段活化能最大
D、其他条件不变,增大压强可以增大反应速率同时提高反应物的转化率
14. 一定条件下,将TiO2和焦炭放入密闭真空容器中,反应TiO2 (s)+C(s)
更容易与CO发生反应
B、
C、整个反应分为三个基元反应阶段,其中第一个反应阶段活化能最大
D、其他条件不变,增大压强可以增大反应速率同时提高反应物的转化率
14. 一定条件下,将TiO2和焦炭放入密闭真空容器中,反应TiO2 (s)+C(s) Ti(s)+CO2 (g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法一定正确的是( ) A、平衡常数减小 B、TiO2的质量不变 C、CO2的浓度不变 D、Ti的质量增加15. 常温下,或的单一饱和溶液体系中,金属阳离子的物质的量浓度的负对数与溶液的变化关系如图所示。已知常温下, , 下列说法错误的是( )
Ti(s)+CO2 (g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法一定正确的是( ) A、平衡常数减小 B、TiO2的质量不变 C、CO2的浓度不变 D、Ti的质量增加15. 常温下,或的单一饱和溶液体系中,金属阳离子的物质的量浓度的负对数与溶液的变化关系如图所示。已知常温下, , 下列说法错误的是( ) A、曲线a表示饱和溶液中的变化关系,且 B、向X点对应的饱和溶液中加入少量固体,可转化为Y点对应的溶液 C、除去酸性溶液中含有的少量杂质,可加入适量 , 充分搅拌后过滤 D、当和两种沉淀共存时,溶液中
A、曲线a表示饱和溶液中的变化关系,且 B、向X点对应的饱和溶液中加入少量固体,可转化为Y点对应的溶液 C、除去酸性溶液中含有的少量杂质,可加入适量 , 充分搅拌后过滤 D、当和两种沉淀共存时,溶液中二、综合题
-
16. 测定盐酸和溶液反应的反应热的实验装置如图所示。

回答下列问题:
(1)、图中缺少的一种仪器是。(2)、实验时玻璃搅拌器的运动方向是____(填标号)。A、上下 B、左右 C、顺时针 D、逆时针填充物(3)、假设盐酸和氢氧化钠溶液的密度都是 , 又知中和反应后生成的溶液的比热容。实验记录数据如表:实验序号
起始温度
终止温度
盐酸
氢氧化钠溶液
混合溶液
1
20.0
20.1
23.2
2
20.2
20.4
23.4
3
20.5
20.6
23.6
则中和反应生成的(保留1位小数)
若计算结果与理论数据()相比较,有误差,则可能导致该误差的原因是。
a.实验装置保温、隔热效果差
b.用量筒量取盐酸的体积时仰视读数
c.分多次把溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸的起始温度后直接去测定溶液的温度
若改用盐酸和溶液进行反应,与上述实验相比,所求中和热(填“相等”或“不相等”)。
(4)、现将一定量的稀氢氧化钾溶液、稀氢氧化钠溶液、稀氨水分别和稀盐酸恰好完全反应,其反应热分别为、、 , 则、、的大小关系为。(5)、下列说法正确的是____(填标号)。A.向内筒中加入稀碱时,应当缓慢而匀速地加入A、将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差 B、用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平 C、内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成时所测得的中和反应的反应热无影响17. 湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉、钴等单质。用铜镉渣回收金属镉、铜等的工艺流程如图:
相关金属离子生成氢氧化物沉淀的(金属离子的起始浓度为)如下表:
氢氧化物
开始沉淀的
1.5
6.5
7.2
8.0
沉淀完全的
3.2
9.9
9.5
11.1
(1)、酸浸铜镉渣时,粉碎铜镉渣的目的是。(2)、完成操作I所得溶液中阳离子有、、、、 , 滤渣I主要成分为(填化学式)。(3)、操作III中先加入适量 , 发生反应的离子方程式为;再加入控制反应液的 , 范围为;选择(填“铁氰化钾”或“硫氰化钾”)试剂,能证明添加的已足量。(4)、常用沉淀转化法处理含废水,写出碳酸钙处理的离子方程式:;(5)、电解后的废液可用于电镀锌,电镀锌时阴极上主要发生的电极反应为。18. 研究碳、氮、硫及其化合物的转化对改善环境有重大意义。回答下列问题:(1)、某处碳循环如图1所示,结合平衡移动原理分析CaCO3溶解的原因。 (2)、利用“亚硫酸盐法”吸收工业废气中SO2。常温下,将工业废气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图2所示。
(2)、利用“亚硫酸盐法”吸收工业废气中SO2。常温下,将工业废气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图2所示。
①b点溶液中n():n()=。
②常温下, , 。0.1 mol/L的(NH4)2SO3溶液中离子浓度由大到小的顺序为(不考虑OH-)。
③尿素溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是。向浓度均为0.1 mol/L的CdCl2和ZnCl2混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中c(Zn2+):c(Cd2+)=。[已知 , ]
④用草酸晶体(H2C2O4·2H2O),(已知草酸溶液 , )标准液滴定NaOH溶液浓度的步骤如下:准确称取草酸晶体m g置于锥形瓶中,加入新制蒸馏水25.00 mL,加入两滴酚酞溶液,用待标定的NaOH溶液滴定至终点(pH约为8.3),消耗NaOH溶液的体积为V mL。滴定终点的现象为 , NaOH溶液的浓度为mol/L。
19. 我国力争于2030年前做到碳达峰,2060年前实现碳中和。利用反应: , 可减少排放,并合成清洁能源。(1)、该反应一般认为通过如下步骤来实现:①
②
则;已知反应①的 , (k正、k逆为速率常数,与温度、催化剂有关)若平衡后升高温度,则(填“增大”、“不变”或“减小”)
(2)、500℃时,在容积为2L的密闭容器中充入和 , 发生反应 , 测得时,反应达到平衡,体系的总压强为 , 此时。求该温度下反应的平衡常数。(注:用平衡分压代替平衡浓度计算,分压总压物质的量分数)(3)、对于反应 , 将和以一定的比例在密闭容器中通过两种不同的催化剂(I、Ⅱ)进行反应,相同时间内,的转化率随温度变化曲线如图所示。
①T2温度时便用催化剂Ⅰ,能否便转化率高于a%(填“能”或“不能”)
②催化剂Ⅱ条件下,当温度低于T6℃时,转化率随温度升高而升高的原因可能是。
(4)、利用电化学法还原二氧化碳制乙烯在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:

阴极电极反应式为 , 该装置中使用的是(填“阴”或“阳”)离子交换膜。