江苏省宿迁市沭阳县2022-2023学年高二上学期期中阶段测试化学试题
试卷更新日期:2022-12-07 类型:期中考试
一、单选题
-
1. 2022年北京冬奥会和冬残奥会通过科技助力“碳中和”,体现绿色环保理念。下列说法错误的是( )A、火炬“飞扬”采用氢能为燃料,体现“绿色低碳”的发展理念 B、火炬“飞扬”外壳由有机高分子材料碳纤维制成 C、奥运场馆使用的碲化镉发电玻璃,实现了太阳能向电能的转化 D、冬奥会使用的餐具均由可降解聚乳酸生物新材料制成,能有效减少白色污染2. 炒过菜的铁锅未及时洗净(残液中含 ),不久便会因被腐蚀而出现红褐色锈斑,腐蚀原理如图所示,下列说法正确的是( )
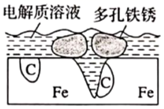 A、腐蚀过程中,负极是 ,发生电极反应: B、 失去电子经电解质溶液转移给C C、正极的电极反应式为 D、C是正极, 在C表面上发生还原反应3. 下列事实中,不能用勒夏特列原理解释的是( )A、向双氧水中加入少量二氧化锰快速生成氧气 B、用浓氨水和氢氧化钠固体快速制取氨气 C、向新制氯水中加入适量硝酸银固体,氯水颜色变浅 D、可口可乐打开瓶盖后有大量气泡冒出4. 在一定温度下某反应达到化学平衡,其反应过程对应能量变化如图。下列说法正确的是( )
A、腐蚀过程中,负极是 ,发生电极反应: B、 失去电子经电解质溶液转移给C C、正极的电极反应式为 D、C是正极, 在C表面上发生还原反应3. 下列事实中,不能用勒夏特列原理解释的是( )A、向双氧水中加入少量二氧化锰快速生成氧气 B、用浓氨水和氢氧化钠固体快速制取氨气 C、向新制氯水中加入适量硝酸银固体,氯水颜色变浅 D、可口可乐打开瓶盖后有大量气泡冒出4. 在一定温度下某反应达到化学平衡,其反应过程对应能量变化如图。下列说法正确的是( ) A、Ea为逆反应活化能,为正反应活化能 B、该反应中, C、所有活化分子的平均能量高于或等于所有分子的平均能量 D、温度升高,正反应速率加快幅度大于逆反应加快幅度,使平衡正移5. 下列有关实验内容、实验装置和对应的实验目的均正确的是( )
A、Ea为逆反应活化能,为正反应活化能 B、该反应中, C、所有活化分子的平均能量高于或等于所有分子的平均能量 D、温度升高,正反应速率加快幅度大于逆反应加快幅度,使平衡正移5. 下列有关实验内容、实验装置和对应的实验目的均正确的是( )A
B
C
D

将球浸泡在冷水和热水中
测定中和热
测定的生成速率
验证反应的吸放热
比较温度对反应速率的影响
A、A B、B C、C D、D6. 一定温度下,在容积为2L的密闭容器中发生如下图化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( ) A、该反应的化学方程式为 B、反应进行到1s时, C、反应进行到5s时,各物质的反应速率相等 D、反应进行到5s时,B的平均反应速率7. 下列有关的叙述错误的是( )A、的水溶液能导电,是电解质 B、用NaOH等碱性溶液吸收尾气中的 , 体现了的酸性氧化物的性质 C、在大气中能转化为 , 体现了的还原性 D、的水溶液久置于空气中,水溶液的酸性会增强8. 已知反应: , 运用该反应处理废气时有关说法正确的是( )A、增大压强有利于反应自发进行 B、为了完全消除废气,可延长其反应时间 C、降低反应温度可提高去除效率 D、标准状况下,该反应中每生成11.2L NO转移电子的数目约为9. 已知反应: , 标准状况下, 。下列有关说法错误的是( )A、该反应的 B、该反应的 C、若生成=消耗,则该反应到达平衡状态 D、反应过程中及时分离 , 有利于废气的转化10. 支撑海港码头基础的钢管桩,常用外加电流法进行防腐,工作原理如图所示。其中高硅铸铁为惰性辅助电极。下列有关表述错误的是( )
A、该反应的化学方程式为 B、反应进行到1s时, C、反应进行到5s时,各物质的反应速率相等 D、反应进行到5s时,B的平均反应速率7. 下列有关的叙述错误的是( )A、的水溶液能导电,是电解质 B、用NaOH等碱性溶液吸收尾气中的 , 体现了的酸性氧化物的性质 C、在大气中能转化为 , 体现了的还原性 D、的水溶液久置于空气中,水溶液的酸性会增强8. 已知反应: , 运用该反应处理废气时有关说法正确的是( )A、增大压强有利于反应自发进行 B、为了完全消除废气,可延长其反应时间 C、降低反应温度可提高去除效率 D、标准状况下,该反应中每生成11.2L NO转移电子的数目约为9. 已知反应: , 标准状况下, 。下列有关说法错误的是( )A、该反应的 B、该反应的 C、若生成=消耗,则该反应到达平衡状态 D、反应过程中及时分离 , 有利于废气的转化10. 支撑海港码头基础的钢管桩,常用外加电流法进行防腐,工作原理如图所示。其中高硅铸铁为惰性辅助电极。下列有关表述错误的是( ) A、通入保护电流使钢管桩表面的腐蚀电流接近于零 B、通电后,外电路电子从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为阳极材料被损耗和传递电流 D、该保护装置属于电解池11. 下列依据热化学方程式得出的结论正确的是( )A、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ·mol-1 , 则含1molNaOH的稀溶液与稀醋酸完全中和,放出热量小于57.3kJ B、已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1 , 则氢气的燃烧热为241.8kJ·mol-1 C、已知2C(s)+ O2(g)=2CO2(g) ΔH=a 2C(s)+O2(g)=2CO(g) ΔH=b,则a>b D、已知P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定12. 某种熔融碳酸盐燃料电池以 、 为电解质、以 为燃料时,该电池工作原理如图。下列说法正确的是( )
A、通入保护电流使钢管桩表面的腐蚀电流接近于零 B、通电后,外电路电子从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为阳极材料被损耗和传递电流 D、该保护装置属于电解池11. 下列依据热化学方程式得出的结论正确的是( )A、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ·mol-1 , 则含1molNaOH的稀溶液与稀醋酸完全中和,放出热量小于57.3kJ B、已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1 , 则氢气的燃烧热为241.8kJ·mol-1 C、已知2C(s)+ O2(g)=2CO2(g) ΔH=a 2C(s)+O2(g)=2CO(g) ΔH=b,则a>b D、已知P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定12. 某种熔融碳酸盐燃料电池以 、 为电解质、以 为燃料时,该电池工作原理如图。下列说法正确的是( ) A、 为 , 为 B、 向正极移动 C、此电池在常温时也能工作 D、正极反应式为:13. 金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性),下列叙述正确的是( )A、阳极的电极反应式: B、电解后,电解槽底部的阳极泥中只有Cu和Pt C、电解后,溶液中存在的阳离子只有和 D、电解过程中,阳极质量的减少与阴极质量的增加相等14. 一定温度下,在2个容积均为1L的密闭容器中,充入一定量的反应物,发生反应: 。相关反应数据如下表所示:
A、 为 , 为 B、 向正极移动 C、此电池在常温时也能工作 D、正极反应式为:13. 金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性),下列叙述正确的是( )A、阳极的电极反应式: B、电解后,电解槽底部的阳极泥中只有Cu和Pt C、电解后,溶液中存在的阳离子只有和 D、电解过程中,阳极质量的减少与阴极质量的增加相等14. 一定温度下,在2个容积均为1L的密闭容器中,充入一定量的反应物,发生反应: 。相关反应数据如下表所示:容器编号
温度
起始物质的量/mol
10s时物质的量/mol
NO
I
0.2
0.2
0.05
II
0.2
0.2
0.05
下列说法正确的是( )
A、10s时,容器I中的化学反应速率 B、该反应在任何条件下均能自发进行 C、10s时,容器I中的反应处于平衡状态 D、若起始时,向容器II中充入0.08mol NO、0.1mol CO、0.04mol和0.1mol , 反应将向逆反应方向进行二、综合题
-
15. 运用化学反应原理研究氮的化合物的相关反应对治理环境污染具有重要意义。模拟汽车尾气中的和CO在转化器内的反应: , 在恒容密闭容器中,用传感器测得不同时间NO和CO的浓度如下表:
时间/s
0
1
2
3
4
5
10.0
8.0
7.0
6.2
4.0
4.0
8.0
6.0
5.0
4.2
2.0
2.0
(1)、前2s内的平均反应速率。(2)、反应达到平衡时CO的转化率为。(3)、下列条件的改变能使上述反应的速率加快的是____(填字母)。A、降低温度 B、充入He C、移走部分 D、使用催化剂(4)、平衡时容器内压强为 , 开始时压强为 , 则。(5)、对反应 , 在温度分别为、时,平衡体系中的体积分数随压强变化曲线如下图所示,下列说法正确的是。
a.A、C两点的化学平衡常数:A>C
b.A、C两点的转化率:A>C
c.由状态B到状态A,可以用加热的方法
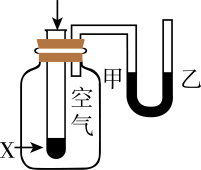
16. 二氧化氯()为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。下图是目前已开发出的用电解法制取的新工艺。装置如图所示: (1)、肼()-空气碱性燃料电池放电效率高,以该电池为电源模拟此工艺。
(1)、肼()-空气碱性燃料电池放电效率高,以该电池为电源模拟此工艺。①甲装置的能量转化形式主要是。
②乙装置中离子交换膜的类型是(填字母)。
A.质子交换膜 B.阳离子交换膜 C.阴离子交换膜
③铂电极为极(填“正”或“负”),石墨电极为极(填“阴”或“阳”)。
④写出铜电极的电极反应式:。
⑤写出产生的电极反应式:。
当铁电极产生标准状况下336mL气体时,通过离子交换膜离子的物质的量为。
(2)、若将肼()-空气碱性燃料电池改为甲醇燃料电池,原理如下图所示:
该电池的正极反应式为。
(3)、肼也可作发射火箭时的燃料,以作氧化剂,两者反应生成氮气和气态水。已知16g在上述反应中放出284kJ的热量,写出该反应的热化学方程式。17. 化学反应伴随能量变化,获取反应能量变化有多种途径。(1)、I.下列反应中,属于吸热反应的是____(填字母)。A、钠与水反应 B、甲烷的燃烧反应 C、与氯化铵反应 D、二氧化碳与焦炭反应(2)、II.获取能量变化的途径通过化学键的键能计算。
已知:
下表列出了3种化学键的键能:
化学键
H—H
I—I
H—I
键能/()
436
151
299
①
②该反应经历了如下反应历程:第一步 第二步
若第一步为快反应,下列示意图中能体现上述反应能量变化的是(填标号)。
A.
 B.
B.
C.
 D.
D.
③下列可证明反应已达平衡状态的是(填标号)。
A.一个I—I键断裂的同时有两个H—I键断裂
B.反应速率
C.温度和体积一定时,混合气体颜色不再变化
D.条件一定时,混合气体的平均相对分子质量不再变化
(3)、通过盖斯定律可计算。甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、和)在催化剂作用下可合成甲醇,发生的主要反应如下
i.
ii.
iii.
。
(4)、将2.0mol和3.0mol通入容积为3L的恒容密闭容器中,在一定条件下发生反应ii,测得的平衡转化率与温度的关系如图所示。
①100℃时反应ii达到平衡所需的时间为5min,则反应从起始至5min内,用表示该反应的平均反应速率为。
②100℃时,反应ii的平衡常数K=。
③已知:反应ii的瞬时速率表达式为 , (k为速率常数,只与温度有关)]。温度由100℃升高到300℃,活化分子百分数(填“增大”“减小”或“不变”)。300℃时,(填“大于”“小于”或“等于”)K(100℃)。
18. 碘化钾溶液露置在空气中容易被氧气氧化而显黄色。某兴趣小组进行如下实验探究:实验试剂:KI溶液、溶液、溶液、溶液、蒸馏水
实验仪器:试管、试剂瓶、胶头滴管、温度计
(1)、针对冬夏季节不同,KI溶液变色快慢不同,小组成员进行以下实验:实验编号
①
②
③
④
⑤
温度/℃
30
40
50
60
70
显色时间/s
160
80
40
20
10
回答下列问题:
①该实验的目的是探究对反应速率的影响。
②由上述实验记录可得出的结论是:温度每升高10℃,反应速率增大为原来的倍。
(2)、为探究溶液的酸性强弱对KI溶液变色速率的影响,小组成员进行以下实验:
10mLKI溶液5滴淀粉溶液
序号
加入试剂
变色时间
I
10mL蒸馏水
长时间放置,未见明显变化
II
10mL溶液
放置3min后,溶液变蓝
III
10mL溶液
放置1min后,溶液变蓝
IV
10mL溶液
长时间放置,未见明显变化
回答下列问题:
①写出实验II发生反应的离子方程式。
②实验I、II、III所得结论:。
③增大实验II反应速率还可以采取的措施。
④实验IV的作用是。