湖北省孝感市普通高中协作体2022-2023学年高二上学期期中联合考试化学试题
试卷更新日期:2022-12-07 类型:期中考试
一、单选题
-
1. 诗人陆游的笔记中记载“书灯勿用铜盏,想瓷盏最省油,蜀中有夹瓷盏……可省油之半。一端作小窍,注清冷水于其中,每夕一易之”,夹瓷盏被称为省油灯,用棉绳做炷(灯芯)上层盏盛油,下层盏盛水。其结构示意图如图。下列说法错误的是( )
 A、省油灯中的可燃物有两种 B、注清冷水于其中,每夕一易之,使用过程中水和油一起燃烧而减少 C、省油灯的原理是水吸收热量减少了油的挥发 D、灯盏中的油是油脂2. 下列说法中错误的是( )A、降低温度能使化学反应速率减小,主要原因是降低了反应物中活化分子的百分数 B、减小反应物浓度,可降低单位体积内活化分子的百分数,从而使有效碰撞次数减少 C、对反应来说,若增大压强,产生气泡的速率不变 D、催化剂可以改变化学反应速率,虽然在反应过程中参与反应,但反应前后的质量不变3. 已知煤转化成水煤气及其燃烧过程的能量变化如图,下列说法错误的是( )
A、省油灯中的可燃物有两种 B、注清冷水于其中,每夕一易之,使用过程中水和油一起燃烧而减少 C、省油灯的原理是水吸收热量减少了油的挥发 D、灯盏中的油是油脂2. 下列说法中错误的是( )A、降低温度能使化学反应速率减小,主要原因是降低了反应物中活化分子的百分数 B、减小反应物浓度,可降低单位体积内活化分子的百分数,从而使有效碰撞次数减少 C、对反应来说,若增大压强,产生气泡的速率不变 D、催化剂可以改变化学反应速率,虽然在反应过程中参与反应,但反应前后的质量不变3. 已知煤转化成水煤气及其燃烧过程的能量变化如图,下列说法错误的是( ) A、由△H3可知,该步反应的反应物键能总和小于生成物的键能总和 B、△H1-△H2+△H3=0 C、△H1<△H2 D、若用C(s)和H2O(l)转化为H2(g)和CO(g),则△H2变大4. 白磷与氧可发生如下反应:。已知断裂下列化学键需要吸收的能量分别为:P—P:、P—O:、P=O:、O=O:。根据图示的分子结构和有关数据估算白磷反应热 , 其中正确的是( )
A、由△H3可知,该步反应的反应物键能总和小于生成物的键能总和 B、△H1-△H2+△H3=0 C、△H1<△H2 D、若用C(s)和H2O(l)转化为H2(g)和CO(g),则△H2变大4. 白磷与氧可发生如下反应:。已知断裂下列化学键需要吸收的能量分别为:P—P:、P—O:、P=O:、O=O:。根据图示的分子结构和有关数据估算白磷反应热 , 其中正确的是( ) A、 B、 C、 D、5. 可逆反应mA(g)+nB(g) pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
A、 B、 C、 D、5. 可逆反应mA(g)+nB(g) pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是( )
A、②④⑤⑦ B、①④⑥⑧ C、②③⑤⑧ D、①③⑥⑦6. 火电厂利用燃煤发电,煤燃烧中的热化学方程式有:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
CO(g)+O2(g)=CO2(g) ΔH2=-283 kJ/mol
C(s)+O2(g)=CO(g) ΔH3=?
下列有关说法中错误的是( )
A、CO的燃烧热为283 kJ/mol B、二氧化碳分解为一氧化碳和氧气的反应是吸热反应 C、ΔH3=ΔH2-ΔH1=110.5 kJ/mol D、ΔH3=ΔH1-ΔH2=-110.5 kJ/mol7. “人工固氮”对农业生产至关重要。在常温、常压和光照条件下,N2在某种催化剂表面与水反应的热化学方程式为2N2(g) + 6H2O(l) = 4NH3(g) + 3O2(g) ∆H,反应过程中的能量变化如图所示。下列有关说法正确的是( ) A、该反应的焓变∆H<0 B、升高温度,活化分子数目增多 C、反应Ⅰ的活化能大,活化分子数目多 D、反应Ⅱ的转化率比反应Ⅰ的转化率高8. 有关热化学方程式书写与对应表述正确的是( )A、稀醋酸与溶液反应: B、在101kPa下的燃烧热为 , 则水分解的热化学方程式: C、已知的燃烧热为 , 则有 D、已知9.6g硫粉与11.2g铁粉混合加热生成时放出19.12kJ热量,则9. 关于一定条件下的化学平衡: 。下列说法正确的是( )A、恒温恒容,充入He,压强增大,v(正)增大 B、恒温恒容,充入 , v(正)增大,平衡右移 C、加压,v(正)、v(逆)不变,平衡不移动 D、升温,v(正)减小,v(逆)增大,平衡左移10. 对于反应 , R.A.Ogg提出如下反应历程:
A、该反应的焓变∆H<0 B、升高温度,活化分子数目增多 C、反应Ⅰ的活化能大,活化分子数目多 D、反应Ⅱ的转化率比反应Ⅰ的转化率高8. 有关热化学方程式书写与对应表述正确的是( )A、稀醋酸与溶液反应: B、在101kPa下的燃烧热为 , 则水分解的热化学方程式: C、已知的燃烧热为 , 则有 D、已知9.6g硫粉与11.2g铁粉混合加热生成时放出19.12kJ热量,则9. 关于一定条件下的化学平衡: 。下列说法正确的是( )A、恒温恒容,充入He,压强增大,v(正)增大 B、恒温恒容,充入 , v(正)增大,平衡右移 C、加压,v(正)、v(逆)不变,平衡不移动 D、升温,v(正)减小,v(逆)增大,平衡左移10. 对于反应 , R.A.Ogg提出如下反应历程:第一步 快速平衡
第二步 慢反应
第三步 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述错误的是( )
A、v(第一步的逆反应)>v(第二步反应) B、反应的中间产物只有 C、第二步中与的碰撞仅部分有效 D、第三步反应活化能比第二步的低11. 在2L恒容密闭容器中投入2mol CO和。进行反应:。在相同的时间段(5min)内,测得CO的转化率与温度的关系如图所示。下列说法正确的是( ) A、化学平衡常数: B、a点, C、d点等于a点 D、50℃时,该反应的化学平衡常数12. 下列有关电解质的说法正确的是( )A、二氧化碳的水溶液有微弱的导电性,故二氧化碳属于弱电解质 B、在电流的作用下,氯化钠在溶液中能完全电离成钠离子和氯离子 C、硫酸钡难溶于水,但硫酸钡属于强电解质 D、强电解质溶液的导电性一定比弱电解质溶液的导电性强13. 在一密闭容器中加入和一定量的催化剂(所占体积忽略不计)发生反应 达到平衡,下列说法正确的是( )
A、化学平衡常数: B、a点, C、d点等于a点 D、50℃时,该反应的化学平衡常数12. 下列有关电解质的说法正确的是( )A、二氧化碳的水溶液有微弱的导电性,故二氧化碳属于弱电解质 B、在电流的作用下,氯化钠在溶液中能完全电离成钠离子和氯离子 C、硫酸钡难溶于水,但硫酸钡属于强电解质 D、强电解质溶液的导电性一定比弱电解质溶液的导电性强13. 在一密闭容器中加入和一定量的催化剂(所占体积忽略不计)发生反应 达到平衡,下列说法正确的是( ) A、若容器容积不变,则反应速率与温度的关系如图1 B、若容器容积和温度不变,平衡后再充入和混合气体,达新平衡后百分含量一定增大 C、若容器压强和温度不变,平衡后时刻充入 , 速率与时间的关系如图2 D、若容器压强和温度不变,平衡后再充入一定量的 , 达新平衡后百分含量不变14. 1,3—丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3—丁二烯生成碳正离子;第二步Br-进攻碳正离子完成1,2—加成或1,4—加成。反应进程中的能量变化如图所示。
A、若容器容积不变,则反应速率与温度的关系如图1 B、若容器容积和温度不变,平衡后再充入和混合气体,达新平衡后百分含量一定增大 C、若容器压强和温度不变,平衡后时刻充入 , 速率与时间的关系如图2 D、若容器压强和温度不变,平衡后再充入一定量的 , 达新平衡后百分含量不变14. 1,3—丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3—丁二烯生成碳正离子;第二步Br-进攻碳正离子完成1,2—加成或1,4—加成。反应进程中的能量变化如图所示。
下列说法错误的是( )
A、1,4-加成产物比1,2-加成产物更稳定 B、1,3-丁二烯与HBr发生加成反应是放热反应 C、适当升高反应温度,可能有利于1,4-加成的进行 D、选择合适的催化剂加入,可使1,2-加成的焓变小于1,4-加成15. 常温下,向50mL溶有的氯水中滴加的NaOH溶液,溶液的pH()与所加NaOH溶液体积的变化如图所示。下列说法正确的是( ) A、若a点 , 且 , 则 B、若 , 则b点对应的溶液中: , 可用pH试纸测定其pH C、若 , 则c点对应溶液中: D、b~c段,随NaOH溶液的滴入,的值逐渐增大
A、若a点 , 且 , 则 B、若 , 则b点对应的溶液中: , 可用pH试纸测定其pH C、若 , 则c点对应溶液中: D、b~c段,随NaOH溶液的滴入,的值逐渐增大二、实验题
-
16.(1)、Ⅰ.利用如图装置测定中和热的实验步骤如下:

①用量筒量取硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
实验过程中用到只量筒,只温度计,测定一组数据需要测定次温度。
(2)、经测定中和热。则中和热热化学方程式:。向的NaOH溶液中加入下列物质:①稀醋酸,②稀盐酸,③浓硫酸,恰好完全反应时对应的热效应、、的关系正确的是
A. B.
C. D.
(3)、Ⅱ.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。
a、b、c三点的电离程度大小关系:。
(4)、a、b、c三点溶液用溶液中和,消耗NaOH溶液体积大小关系:。三、综合题
-
17. 甲烷以天然气和可燃冰两种主要形式存在于地球上,储量巨大,充分利用甲烷对人类的未来发展具有重要意义。(1)、利用、在一定条件下重整的技术可得到富含CO的气体,在能源和环境上具有双重重大意义。重整过程中的催化转化原理如图所示:

已知:
则:①过程Ⅱ中第二步反应的化学方程式为。
②只有过程Ⅰ投料比 , 过程Ⅱ中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为。
(2)、乙炔是重要的化工原料。工业上可用甲烷裂解法制取乙炔,反应为:。甲烷裂解时还发生副反应:。甲烷裂解时,几种气体平衡时分压(Pa)的对数即lg P与温度(℃)之间的关系如图1所示。
①1725℃时,向恒容密闭容器中充入 , 达到平衡时生成的平衡转化率为。
②1725℃时,若图中的 , 则反应的平衡常数(注:用平衡分压Pa代替平衡浓度进行计算)。
③根据图判断, 0(填“>”或“<”)。由图可知,甲烷裂解制乙炔过程中有副产物乙烯生成。为提高甲烷制乙炔的产率,除改变温度外,还可采取的措施有。
(3)、工业上用甲烷和水蒸气在高温和催化剂存在的条件下制得合成气(CO、),发生反应为: 图2中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷含量曲线,其中表示2MPa的是(填字母)。在实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑实际生产,说明选择该反应条件的主要原因是。18. 工业废水中常含有一定量的 , 易被人体吸收累积而导致肝癌。处理工业含铬废水的方法通常是将转化为 , 再将转化为沉淀。已知元素铬(Cr)在溶液中主要以(蓝紫色)、(绿色)、(橙红色)、(黄色)等形式存在,为难溶于水的灰蓝色固体。(1)、在强碱中可被双氧水氧化为 , 发生反应的离子方程式为。(2)、和在溶液中可相互转化。室温下,初始浓度为的溶液中随的变化如图所示。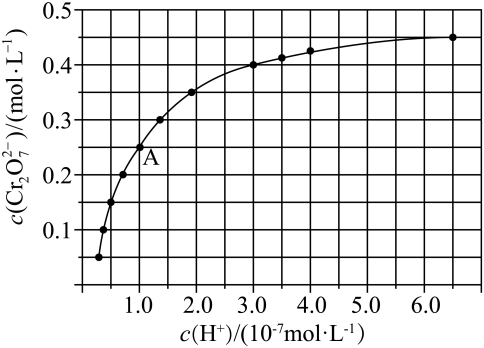
①由图可知,溶液酸性增大,的平衡转化率(填“增大“减小”或“不变”)。
②据A点数据,计算出该转化反应的平衡常数。
③初始浓度为的溶液中加入一定量的硝酸至溶液的 , 则溶液由转变到(填溶液颜色)。
19. 已知25℃时,五种酸的电离平衡常数如下:化学式
HClO
HCOOH
请回答下列问题:
(1)、等物质的量浓度的、、HCOOH、HClO、溶液中,的大小顺序为(填化学式),浓度分别为、 , 、混合溶液中。(2)、写出下列反应的离子方程式。(少量):;
(少量):。
(3)、体积均为10mL、浓度均为的上述五种酸溶液分别加水稀释至1000mL,稀释过程中溶液的变化如图所示,则曲线b代表。
-