福建省三明市五校协作2022-2023学年高二上学期期中联考化学试题
试卷更新日期:2022-12-07 类型:期中考试
一、单选题
-
1. 下列说法错误的是( )A、恒温恒压下,且的反应正向能自发进行 B、相同物质的量的同种物质气态时熵值最大,固态时熵值最小 C、反应在室温下可自发进行,则该反应的 D、非自发的反应一定可以通过改变条件使其成为自发反应2. 下列铁制品防护的装置或方法中,错误的是( )
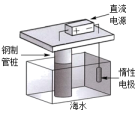

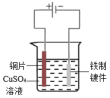

A.外加电流
B.牺牲阳极
C.表面镀铜
D.制成不锈钢
A、A B、B C、C D、D3. 已知: , 下列说法正确的是( )A、在相同条件下,1 mol A2(g)与1 mol B2(g)的能量总和小于2 mol AB气体的能量 B、1 mol A2与1 mol B2反应生成2 mol液态AB时△H>-46.6 kJ/mol C、在密闭容器中,投入1 mol A2(g)与1 mol B2(g)进行反应,当反应不再进行时,放出热量一定为46.6 kJ D、该逆反应过程的活化能Ea一定大于46.6 kJ/mol4. 下列关于水的电离H2OH++OH- △H>0的说法错误的是( )A、将水加热至80℃,水的电离平衡正向移动,水依然呈中性 B、向水中加入少量NaOH,水的电离平衡逆向移动,溶液呈碱性 C、在某温度时,纯水中水电离的c(H+)为1.0×10-6 mol/L,水呈酸性 D、25℃的某溶液中,水电离的c(H+)=1.0×10-12 mol/L时,溶液可能呈酸性5. 少量铁粉与100 mL 0.1 mol/L的稀盐酸反应,若想减慢此反应速率,而不改变H2的产量。可以使用如下方法中的( )A、加入少量硫酸铜溶液 B、加入少量KNO3溶液 C、加CH3COONa固体 D、加NaCl固体6. 一定温度下,100mLN2O5的CCl4溶液发生分解反应:2N2O5⇌4NO2+O2。不同时刻测得生成O2的体积,换算成对应时刻N2O5的浓度如下表。t/min
0
10
20
30
…
80
90
c(N2O5)/(mol·L−1)
1.40
0.96
0.66
0.45
…
0.11
0.11
下列说法错误的是( )
A、0~10min的平均反应速率:v(N2O5)=0.044mol·L−1·min−1 B、10~20min的平均反应速率:v(N2O5)<0.044mol·L−1·min−1 C、10~20min放出的O2体积为0.336L(标准状况) D、80min后反应达到平衡,2v正(N2O5)=v逆(O2)7. 某溶液中含有两种溶质CuSO4和NaCl,它们的物质的量之比为2:1,用石墨作电极电解该混合溶液时,下列叙述错误的是( )A、阳极先析出Cl2后析出O2 B、阳极析出Cl2时,阴极析出的一定只有Cu C、电解最后阶段为电解水 D、电解最后阶段溶液中pH会增大的8. 如图为某电化学装置的一部分,电极材料为单一物质。已知两极反应式分别为a极:Cu2++2e-=Cu,b极:Mg-2e-=Mg2+。下列说法错误的是( ) A、a电极上发生还原反应 B、b电极材料是镁 C、该装置一定是原电池装置 D、电解质溶液中含有Cu2+9. 某反应的反应机理、能量与反应进程的关系如下图所示,下列说法正确的是( )
A、a电极上发生还原反应 B、b电极材料是镁 C、该装置一定是原电池装置 D、电解质溶液中含有Cu2+9. 某反应的反应机理、能量与反应进程的关系如下图所示,下列说法正确的是( ) A、是该反应的催化剂 B、第一反应、第二步反应,和总反应都是放热反应| C、第一步反应决定总反应的速率 D、在第一步反应中作还原剂10. 下列事实一定能说明NH3·H2O是弱碱的是( )
A、是该反应的催化剂 B、第一反应、第二步反应,和总反应都是放热反应| C、第一步反应决定总反应的速率 D、在第一步反应中作还原剂10. 下列事实一定能说明NH3·H2O是弱碱的是( )①用NH3·H2O溶液做导电性实验,灯泡很暗;
②NH3·H2O能与HCl发生反应;
③常温下,0.1 mol/L NH3·H2O溶液的pH为11;
④NH3·H2O能与AlCl3溶液反应产生Al(OH)3;
⑤NH3·H2O与水能以任意比互溶;
⑥NH3·H2O能使紫色石试液变蓝
A、①③ B、②③⑤ C、③④⑥ D、③11. 关于下列电化学装置说正确的是( ) A、装置①中,构成电解池时Fe极质量既可增加也可减少 B、装置②表示锌粒与盐酸反应的速率随时间变化的曲线,则t1时刻溶液的温度最高 C、装置③盐桥中的阴离子流向乙池 D、装置④中电流由Zn经导线流向Fe12. 在体积固定的绝热密闭容器中,可逆反应:达到平衡状态,下列说法正确的是( )
A、装置①中,构成电解池时Fe极质量既可增加也可减少 B、装置②表示锌粒与盐酸反应的速率随时间变化的曲线,则t1时刻溶液的温度最高 C、装置③盐桥中的阴离子流向乙池 D、装置④中电流由Zn经导线流向Fe12. 在体积固定的绝热密闭容器中,可逆反应:达到平衡状态,下列说法正确的是( )①NO的体积分数不再改变的状态
②单位时间内生成n mol O2的同时生成2n mol NO
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
⑥混合气体中NO与O2的物质的量之比保持恒定
⑦混合气体中NO与NO2的物质的量之比保持恒定
A、①③⑤⑦ B、②④⑤ C、①③④ D、①②③④⑤13. 在恒容密闭容器中存在下列平衡:。平衡时,CO的物质的量浓度与温度T的关系如图所示。下列说法错误的是( ) A、通过加热可以使B点变到C点 B、在T2时若反应进行到状态D,则有v(正)>v(逆) C、当反应从D点到B点时,容器内气体密度变小 D、若T1、T2时的平衡常数分别为K1、K2 , 则K1<K214. 镍镉电池是二次电池,其工作原理如图(L为小灯泡,K1、K2为开关,a、b为直流电源两极)。下列说法错误的是( )
A、通过加热可以使B点变到C点 B、在T2时若反应进行到状态D,则有v(正)>v(逆) C、当反应从D点到B点时,容器内气体密度变小 D、若T1、T2时的平衡常数分别为K1、K2 , 则K1<K214. 镍镉电池是二次电池,其工作原理如图(L为小灯泡,K1、K2为开关,a、b为直流电源两极)。下列说法错误的是( ) A、断开K2、合上K1 , OH-从电极B移向电极A B、电极B发生还原反应过程中,溶液中的KOH浓度没有变化 C、断开K1、合上K2 , 电极A为阴极,发生还原反应 D、镍镉二次电池的总反应式:15. 在密闭容器中充入1mol CO和1 mol NO,在一定条件下发生反应: , 测得CO的平衡转化率与温度及压强的关系如图所示。实验测得,、(k正、k逆为速率常数,只与温度有关),下列说法错误的是( )
A、断开K2、合上K1 , OH-从电极B移向电极A B、电极B发生还原反应过程中,溶液中的KOH浓度没有变化 C、断开K1、合上K2 , 电极A为阴极,发生还原反应 D、镍镉二次电池的总反应式:15. 在密闭容器中充入1mol CO和1 mol NO,在一定条件下发生反应: , 测得CO的平衡转化率与温度及压强的关系如图所示。实验测得,、(k正、k逆为速率常数,只与温度有关),下列说法错误的是( ) A、达到平衡后,仅升高温度,k正增大的倍数 B、压强从大到小的顺序为P3>P2>P1 C、NO的物质的量:b点<a点 D、逆反应速率:a点>c点16. 通过甲醇羧基化法取甲酸甲酯(HCOOCH3):CH3OH(g)+CO(g)HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图中实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化),下列说法错误的是( )
A、达到平衡后,仅升高温度,k正增大的倍数 B、压强从大到小的顺序为P3>P2>P1 C、NO的物质的量:b点<a点 D、逆反应速率:a点>c点16. 通过甲醇羧基化法取甲酸甲酯(HCOOCH3):CH3OH(g)+CO(g)HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图中实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化),下列说法错误的是( )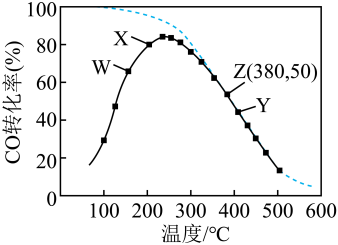 A、此制取甲酸甲酯的反应△H<0 B、图中X点,延长反应时间能提高CO转化率 C、图中W点,升高温度能提高CO转化率 D、380℃下,图中Z点,c起始(CH3OH)=5.0×10-4 mol/L,CO平衡转化率为50%,则平衡常数K(z)=2000
A、此制取甲酸甲酯的反应△H<0 B、图中X点,延长反应时间能提高CO转化率 C、图中W点,升高温度能提高CO转化率 D、380℃下,图中Z点,c起始(CH3OH)=5.0×10-4 mol/L,CO平衡转化率为50%,则平衡常数K(z)=2000二、填空题
-
17. 回答下列问题:(1)、某温度时,水的 , 该温度下,的溶液呈(填“酸性”“碱性”或“中性”)。(2)、在25℃时,的两种一元酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积V的关系如图所示,则下列说法正确的是____
 A、稀释后,A酸溶液的导电性比B酸溶液强 B、稀释前,两种酸溶液的物质的量浓度相等 C、若a=5,则A是强酸,B是弱酸 D、若 , 则A、B都是弱酸(3)、甲酸(HCOOH)和乙酸()一样属于一元弱酸,请写出甲酸的电离方程式: , 常温下,测的同浓度的甲酸溶液和乙酸溶液的pH,甲酸pH更小,则(填写“<”“>”“=”)。(4)、25℃时,0.1mol/L下列物质的溶液,水电离出的由大到小的顺序是(填序号)。
A、稀释后,A酸溶液的导电性比B酸溶液强 B、稀释前,两种酸溶液的物质的量浓度相等 C、若a=5,则A是强酸,B是弱酸 D、若 , 则A、B都是弱酸(3)、甲酸(HCOOH)和乙酸()一样属于一元弱酸,请写出甲酸的电离方程式: , 常温下,测的同浓度的甲酸溶液和乙酸溶液的pH,甲酸pH更小,则(填写“<”“>”“=”)。(4)、25℃时,0.1mol/L下列物质的溶液,水电离出的由大到小的顺序是(填序号)。① ② ③HCOOH ④
(5)、25℃时,的HA溶液中 , 此溶液的。(6)、25℃时,在体积为的的NaOH溶液中,加入体积为的的溶液。若反应后溶液的 , (反应后溶液体积等于NaOH溶液与溶液的体积之和),则。18. 以CH3OH燃料电池为电源电解法制取二氧化氯(ClO2),ClO2为一种黄绿色气体,是国际上公认的高、广谱、快速、安全的杀菌消毒剂。(1)、CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH(填“增大”、“减小”或“不变”),负极反应式为。 (2)、图中电解池用石墨作电极,在一定条件下,生成ClO2的电极与电源的(填“X”或“Y”)连接,产生ClO2的反应式为 , C口出来的溶液是。
(2)、图中电解池用石墨作电极,在一定条件下,生成ClO2的电极与电源的(填“X”或“Y”)连接,产生ClO2的反应式为 , C口出来的溶液是。 (3)、电解一段时间,从阴极处收集到的气体比阳极处收集到气体多6.72 L时(标准状况。忽略生成的气体溶解),电路通过的电子的物质的量为:mol。燃料电池消耗的O2的质量为g。19. 为流少大气污染。科学家采取多种措施处理工业废气中排放的氮氧化物()、、等。回答下列问题:
(3)、电解一段时间,从阴极处收集到的气体比阳极处收集到气体多6.72 L时(标准状况。忽略生成的气体溶解),电路通过的电子的物质的量为:mol。燃料电池消耗的O2的质量为g。19. 为流少大气污染。科学家采取多种措施处理工业废气中排放的氮氧化物()、、等。回答下列问题: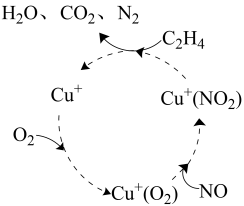 (1)、某脱硝反应机理如图所示,的作用为 , 此过程总反应的方程式为。(2)、选择性催化还原技术(SCR)是目前较为成熟脱硝技术,其反应原理主要为: 。
(1)、某脱硝反应机理如图所示,的作用为 , 此过程总反应的方程式为。(2)、选择性催化还原技术(SCR)是目前较为成熟脱硝技术,其反应原理主要为: 。①若反应过程放出热量为32.54 kJ,则除去的NO物质的量为。
②不考虑催化剂因素,催化还原时应控制反应温度在315~400℃之间,反应温度不宜过高的原因是。
(3)、是性能优良的脱硫脱硝试剂,常温下,的含的盐溶液中,能把氧化生成硫酸盐,自身被还原成 , 该反应的离子方程式为 , 反应一段时间后溶液pH(填“增大”或“减小”)20. 为实现生产生活的“碳减”和经济的可持续发展,科学工作者开展的价值型转化的相关研究。请回答以下有关问题:(1)、Ⅰ.利用太阳能分解获得氢气,再通过加氢制甲醇()等燃料,从而实现可再生能源和的资源化利用。
过程Ⅰ、Ⅱ典型的人工光合作用过程: , 该反应是反应 (填“吸热”或“放热)。
(2)、过程Ⅱ中催化加氢制取甲醇,反应如下:主反应:
副反应:
①CO、生成的热化学方程式是。
②一定条件下,向体积为V L的恒容密闭容器中通入1 mol 和3 mol 发生上述反应,达到平衡时,容器中为a mol,CO为b mol,此时的浓度为(用含a、b、V的代数式表示)。
③为提高在单位时间的产率,可采取措施:(写出一条即可)。
(3)、Ⅱ.催化加氢也可制取乙烯: , 在体积为2 L的恒容容器中制取乙烯,投料为x mol 和3 mol , 测得温度对的平衡转化率的影响,曲线a表示x=1,改变投料比测量后得到曲线b,
曲线b条件下投料比改变,则x1(填“>”、“<”或“=”);反应从开始分别进行到M、M1、N三点时,放出热量为、、 , 其由大到小的顺序为。
(4)、工业生产中采取较高温度(250℃左右),原因是。21. 某兴趣小组研究影响反应速率的因素:(溶液已酸化)和草酸)反应,离子方程式为:。某实验小组欲通过测定单位时间内生成的速率,探究某种影响化学反应速率的因素,设计实验方案如图所示:
实验序号
A溶液
B溶液
①
20 mL 溶液
30 mL 溶液
②
20 mL 溶液
30 mL 溶液
(1)、该实验探究的是因素对化学反应速率的影响。相同时间内针筒中所得的体积较多的是(填实验序号)。(2)、若实验①在2 min末收集了2.24 mL (标准状况下);则在2 min末,(假设混合溶液体积为50 mL)。(3)、除通过测定一定时间内的体积来比较反应速率,本实验还可通过测定来比较化学反应速率。