湖北省十堰市联合体2022-2023学年高一上学期10月期中联考化学试题
试卷更新日期:2022-12-07 类型:期中考试
一、单选题
-
1. 下列各物质或其主要成分的名称(或俗名)、化学式、类别一致的是( )A、胆矾 CuSO4·5H2O 混合物 B、氖气 Ne 单质 C、烧碱 NaOH 氧化物 D、纯碱 NaOH 碱2. 下列各组物质不属于同素异形体的是( )A、H2O和H2O2 B、O2和O3 C、金刚石和石墨 D、红磷和白磷3. 过氧化钠与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的是( )A、Na2CO3和Na2O2 B、只有Na2CO3 C、Na2CO3和NaOH D、Na2O2和NaHCO34. 下列物质都能导电,其中属于电解质的是( )A、熔融的NaOH B、铁丝 C、稀硫酸 D、NaCl溶液5. 下列反应能用H++OH-=H2O表示的是( )A、NaOH溶液和CO2的反应 B、Ba(OH)2溶液和稀H2SO4的反应 C、NaOH溶液和盐酸的反应 D、氨水和稀H2SO4的反应6. 下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是( )A、实验室中用稀硫酸与锌粒反应制取H2 B、实验室中用高锰酸钾加热分解制取O2 C、实验室中用H2O2与MnO2作用产生O2 D、实验室中用稀盐酸与石灰石反应制取CO27. 除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是( )
选项
待提纯的物质
选用的试剂
操作的方法
A
水
溶解、过滤、结晶
B
稀盐酸
溶解、过滤、洗涤、干燥
C
氢氧化钠溶液
过滤
D
氧气
点燃
A、A B、B C、C D、D8. 下列关于Na2CO3 和NaHCO3的叙述错误的是( )A、在相同情况下,Na2CO3 比NaHCO3易溶于水 B、温度相同,浓度相同Na2CO3 溶液的碱性比NaHCO3溶液碱性强 C、可用相同的离子方程式表示Na2CO3 和NaHCO3分别与Ca(OH)2溶液的反应 D、等质量的Na2CO3 和NaHCO3分别与足量的盐酸溶液反应,后者放出的CO2多9. 下列离子方程式正确的是( )A、将铜插入硝酸银溶液中: B、溶液与过量溶液反应:= C、用食醋除水垢: D、稀硫酸和溶液反应:10. 已知M2O7x- + 3 S2- + 14H+= 2M 3++ 3S↓+ 7H2O,则M2O7x-中的M的化合价为( )A、+2 B、+3 C、+4 D、+611. 化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有( ) A、3个 B、4个 C、5个 D、6个12. 下列反应中,电子转移发生在同种物质的同种元素之间的是( )A、2H2S+SO2=3S+2H2O B、2KMnO4K2MnO4+MnO2+O2↑ C、2KClO32KCl+3O2↑ D、Cu2O+H2SO4=CuSO4+Cu+H2O13. 在甲、乙两溶液中,分别含有下列离子(大量存在)中的三种:Cu2+、Na+、H+、、、OH-。已知甲溶液呈蓝色,则乙溶液中存在的离子是( )A、Cu2+、、 B、Na+、OH-、 C、、OH-、 D、Na+、、14. 有下列氧化还原反应:①2I-+Cl2=I2+2Cl-;②2Fe3++2I-=2Fe2++I2;③2Fe2++Cl2=2Fe3++2Cl-;④2MnO+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,根据上述反应,下列结论中正确的是( )A、要除去含有Fe2+、Cl-和I-的混合溶液中的杂质离子I- , 应通入过量的氯气 B、氧化性强弱顺序为MnO>Cl2>Fe3+>I2 C、Mn2+是MnO的氧化产物,I2是I-的还原产物 D、在溶液中不可能发生反应:MnO+5Fe2++8H+=Mn2++5Fe3++4H2O15. 根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )A、
A、3个 B、4个 C、5个 D、6个12. 下列反应中,电子转移发生在同种物质的同种元素之间的是( )A、2H2S+SO2=3S+2H2O B、2KMnO4K2MnO4+MnO2+O2↑ C、2KClO32KCl+3O2↑ D、Cu2O+H2SO4=CuSO4+Cu+H2O13. 在甲、乙两溶液中,分别含有下列离子(大量存在)中的三种:Cu2+、Na+、H+、、、OH-。已知甲溶液呈蓝色,则乙溶液中存在的离子是( )A、Cu2+、、 B、Na+、OH-、 C、、OH-、 D、Na+、、14. 有下列氧化还原反应:①2I-+Cl2=I2+2Cl-;②2Fe3++2I-=2Fe2++I2;③2Fe2++Cl2=2Fe3++2Cl-;④2MnO+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,根据上述反应,下列结论中正确的是( )A、要除去含有Fe2+、Cl-和I-的混合溶液中的杂质离子I- , 应通入过量的氯气 B、氧化性强弱顺序为MnO>Cl2>Fe3+>I2 C、Mn2+是MnO的氧化产物,I2是I-的还原产物 D、在溶液中不可能发生反应:MnO+5Fe2++8H+=Mn2++5Fe3++4H2O15. 根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )A、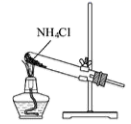 制取氨气
B、
制取氨气
B、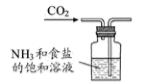 制取碳酸氢钠
C、
制取碳酸氢钠
C、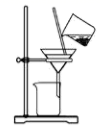 分离碳酸氢钠
D、
分离碳酸氢钠
D、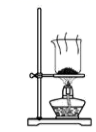 干燥碳酸氢钠
干燥碳酸氢钠
二、填空题
-
16.(1)、(一)有以下几种物质:①碳酸氢钠晶体 ②液态氯化氢 ③铁 ④蔗糖 ⑤酒精 ⑥熔融的K2SO4 ⑦干冰 ⑧石墨。试回答(填序号):
以上物质能导电的是。
(2)、以上物质中属于非电解质的是。(3)、以上物质中溶于水后水溶液能导电的是。(4)、①、②在水溶液中反应的离子方程式为。(5)、(二)某溶液的溶质可能由下列离子组成:Cl-、、CO32-、H+、Ba2+、Na+ , 某同学进行了如下实验:Ⅰ 向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
Ⅱ 向Ⅰ中滤液中加入AgNO3溶液,有白色沉淀产生;
Ⅲ 将Ⅰ中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。
依据以上实验可以推断,原溶液中一定含有 (用离子符号表示,下同);一定没有;可能含有 , 检验是否存在该离子的方法为。
17. 离子方程式是指用实际参加反应的离子符号表示离子反应的式子。(1)、实验室用碳酸钙与盐酸反应制取CO2气体,反应的离子方程式是;常用澄清石灰水检验CO2气体的离子方程式是。(2)、将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是;反应片刻后,可观察到有气体产生,其离子方程式是。(3)、人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为。
18. 根据表格信息,解答有关问题。氯气(Cl2)
KMnO4
PbO2
有刺激性气味,呈黄绿色,有毒气体
易溶于水,溶液呈紫红色,可用于杀菌消毒
Pb的最高化合价为+4,其稳定化合价为+2,难溶于水,灰色固体
(1)、在浓盐酸中加入少量KMnO4剧烈反应,产生黄绿色有刺激性气味的气体,溶液紫红色褪去,已知该反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑。其中氧化剂是 , 氧化产物是。每生成71g氯气,则被氧化的还原剂的质量为g。(2)、取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:滴加适量H2O2 , 紫红色褪去,并有无色气泡产生;再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
①在配制酸性KMnO4溶液时,能否用盐酸? , 原因是。
②KMnO4、H2O2、PbO2的氧化性由强到弱的顺序为。
(3)、根据上述反应能否比较Cl2与H2O2的氧化性强弱?(填“能”或“不能”)。19. 现有一不纯的小苏打样品(含杂质NaCl、Na2CO3·10H2O),为测定NaHCO3的质量分数,设计如图所示的实验装置(夹持仪器未画出)。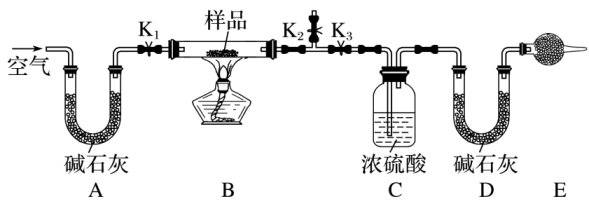
实验步骤如下:
①按图组装好实验装置并检查气密性。
②称取一定质量的样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2 , 关闭K3 , 缓缓鼓入空气数分钟。
④关闭活塞K1、K2 , 打开K3 , 点燃酒精灯加热至不再产生气体。
⑤打开活塞K1 , 缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
[资料]
i.浓硫酸常用于吸收水蒸气。
ii.碱石灰是固体氢氧化钠和氧化钙的混合物。
iii.Na2CO3·10H2ONa2CO3+10H2O↑。
回答下列问题:
(1)、仪器E的名称是 , 其中盛放的药品是;若无该装置,则会导致测得的NaHCO3的质量分数(填“偏大”“偏小”或“无影响”)。(2)、步骤③的目的是(3)、装置B中除反应Na2CO3·10H2ONa2CO3+10H2O↑外,还发生反应的化学方程式为。(4)、若实验中称取样品的质量为 50.0 g,反应后C、D装置增加的质量分别为12.6 g、8.8 g,则混合物中NaHCO3的质量分数为%(计算结果精确到0.1);若将等质量的该样品与足量稀硫酸混合,可得CO2的质量为g(计算结果精确到0.1)。