天津市五校2022-2023学年高三上学期期中联考化学试题
试卷更新日期:2022-12-07 类型:期中考试
一、单选题
-
1. 化学在生产和生活中有重要的应用。下列说法正确的是( )A、陶瓷坩埚和石英坩埚都是硅酸盐产品 B、乙醇、过氧化氢、次氯酸钠、K2FeO4等消毒液均可以将病毒氧化而达到消毒的目的 C、新型材料聚酯纤维、光导纤维都属于有机高分子材料 D、工业上利用合成氨实现人工固氮涉及氧化还原反应2. 下列有关物质性质与用途具有对应关系的是( )A、Na2O2吸收CO2产生O2 , 可用作呼吸面具供氧剂 B、Cl2具有还原性,可用于自来水的杀菌消毒 C、SO2具有氧化性,可用作葡萄酒抗氧化剂 D、NH3易溶于水,可用作制冷剂3. 下列试剂的保存方法中错误的是( )A、少量的钠保存在煤油中 B、新制的氯水保存在棕色玻璃瓶中 C、选用带塑料塞的容量瓶配制碳酸钠溶液 D、氢氟酸保存在玻璃瓶中4. 、的半衰期很短,自然界中不能稳定存在。人工合成反应如下:;。下列说法正确的是( )A、X的中子数为3 B、X、Y互为同位素 C、、可用作示踪原子研究化学反应历程 D、自然界不存在、分子是因其化学键不稳定5. 在指定环境中,下列各组离子一定可以大量共存的是( )A、FeSO4溶液:K+、NO、[Fe(CN)6]3-、Na+ B、在醋酸溶液中:NH 、SO、H+ 、Br- C、加入铝粉放出氢气的溶液:Na+、Cl-、NH、NO D、使无色酚酞试液显红色的溶液:S2-、K+、ClO-、Al3+6. 下列检验方法,利用该气体的还原性的是( )A、使品红溶液褪色 B、遇到空气变为红棕色 C、使湿润的红色石蕊试纸变蓝 D、使湿润的淀粉碘化钾试纸变蓝7. 下列有关物质分类的说法正确的是( )A、铝热剂属于纯净物 B、磁性氧化铁属于碱性氧化物 C、石墨烯属于有机物 D、三氧化硫属于酸性氧化物8. 根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )A、
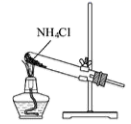 制取氨气
B、
制取氨气
B、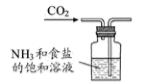 制取碳酸氢钠
C、
制取碳酸氢钠
C、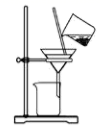 分离碳酸氢钠
D、
分离碳酸氢钠
D、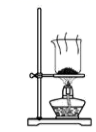 干燥碳酸氢钠
9. 根据原子结构及元素周期律的知识,下列推断正确的是( )A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 B、核外电子排布相同的微粒化学性质也相同 C、热稳定性:H2O>H2S>PH3 D、与得电子能力不同10. 设NA为阿伏加德罗常数的值,下列叙述错误的是( )A、18g重水(D2O)中含有的质子数为9NA B、含0.1mol FeCl3的饱和溶液滴入沸水制得的Fe(OH)3胶体中所含胶体粒子数小于0.1NA C、6.4g Cu与40mL 10mol·L-1浓HNO3作用,产生NO2分子的数目小于0.2NA D、标准状况下,11.2LSO3含有1.5NA个共价键11. 下列离子方程式正确的是( )A、向饱和溶液中滴加饱和溶液: B、向稀硝酸中滴加溶液: C、向新制氯水中滴加少量的溶液: D、向溶液中加入小颗粒钠:12. 含氮化合物过多蓄积会导致水体富营养化,需将其从水体中除去,该过程称为脱氮。常用的脱氮方法有吹脱法和折点氯化法。
干燥碳酸氢钠
9. 根据原子结构及元素周期律的知识,下列推断正确的是( )A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 B、核外电子排布相同的微粒化学性质也相同 C、热稳定性:H2O>H2S>PH3 D、与得电子能力不同10. 设NA为阿伏加德罗常数的值,下列叙述错误的是( )A、18g重水(D2O)中含有的质子数为9NA B、含0.1mol FeCl3的饱和溶液滴入沸水制得的Fe(OH)3胶体中所含胶体粒子数小于0.1NA C、6.4g Cu与40mL 10mol·L-1浓HNO3作用,产生NO2分子的数目小于0.2NA D、标准状况下,11.2LSO3含有1.5NA个共价键11. 下列离子方程式正确的是( )A、向饱和溶液中滴加饱和溶液: B、向稀硝酸中滴加溶液: C、向新制氯水中滴加少量的溶液: D、向溶液中加入小颗粒钠:12. 含氮化合物过多蓄积会导致水体富营养化,需将其从水体中除去,该过程称为脱氮。常用的脱氮方法有吹脱法和折点氯化法。吹脱法:调节水体至8左右,然后持续向水中吹入空气。
折点氯化法:调节水体至6左右,向水中加入适量。
下列分析错误的是( )
A、含氨和铵盐的水体中存在平衡: B、吹脱法的原理是通过鼓气降低浓度,从而降低水中与的含量 C、折点氯化法除的原理为: D、吹脱法无法对含的水体脱氮,但折点氯化法可以对含的水体脱氮二、综合题
-
13. A、B、C、D、E五种短周期元素,原子序数依次增大,其中只有C为金属元素。A、C原子序数之和等于E的原子序数,D与B同主族且D原子序数是B原子序数的2倍。AB2和DB2溶于水均得到酸性溶液,C2D溶于水得到碱性溶液。(1)、E元素在周期表中的位置为;C、D、E的简单离子的离子半径由大到小的顺序是(用离子符号表示)。工业上制取C单质的化学方程式为。(2)、C2B2电子式为 , 某溶液中含有①NO、②HCO、③SO、④CO、⑤SO 5种阴离子,向其中加入C2B2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积变化) 。
A.① B.①③⑤ C.①④⑤ D.①②④⑤
(3)、化合物C2D的水溶液在空气中久置后变质,生成一种单质,所得溶液呈强碱性,用化学方程式表示这一变化过程14. 硫酸是十分重要的化工原料。工业上用黄铁矿(FeS2)制备硫酸的工艺如图所示。 (1)、FeS2中硫元素的化合价是 , 写出过程Ⅱ发生反应的化学方程式。(2)、实验室各种浓度的硫酸是由浓硫酸稀释而得,
(1)、FeS2中硫元素的化合价是 , 写出过程Ⅱ发生反应的化学方程式。(2)、实验室各种浓度的硫酸是由浓硫酸稀释而得,①以下配制过程中各操作的先后顺序是。

②下列情况会使配制结果偏大的是
a.溶解后未冷却即转移、定容
b.定容时仰视容量瓶刻度线
c.用量筒量取一定体积的浓硫酸时俯视
d.将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶
(3)、图是模拟工业过程Ⅱ来探究SO2的催化氧化过程。
①装置甲的作用是。
②装置丙中盛放的是18.4mol/L的浓硫酸,目的是。反应结束后取1.0mL丙中的流液稀释为10.0mL的稀硫酸,滴加几滴酚酞试剂、缓慢加入1.0mol/L 的NaOH溶液,当混合溶液变红时,认为硫酸恰好完全反应,此时所用NaOH溶液体积大于mL,说明SO2催化氧化时有SO3生成。
③装置丁的作用是吸收并检验SO2已除净,现象是酸性高锰酸钾红色变浅,写出反应的离子方程式。
④装置戊中的现象是 , 说明SO2催化氧化时有O2剩余。
15. 自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用的自来水消毒剂有二氧化氯(ClO2)和高铁酸钾(K2FeO4)等。(1)、某研究小组用图装置制备少量ClO2(夹持装置已略去)。
资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为2NaClO3 + 4HCl= 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O。
①冰水浴的作用是。
②当烧瓶中的反应有0.4 mol电子发生转移时,得到的还原产物为mol;
NaOH溶液中发生的主要反应的离子方程式为。
(2)、将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4 , 振荡、静置,观察到 , 证明ClO2具有氧化性。(3)、ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO),需将其转化为Cl-除去。下列试剂中,可将ClO转化为Cl-的是(填字母序号)。a.FeSO4 b.O3 c.KMnO4 d.SO2
(4)、K2FeO4是一种新型、绿色的多功能水处理剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备K2FeO4的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。①上述制备K2FeO4反应的离子方程式为。
②将K2FeO4与水反应的化学方程式补充完整:。
4K2FeO4+ □ H2O= □ Fe(OH)3(胶体)+ □ + □ KOH
(5)、用高铁酸钾(K2FeO4)除废水中的锰:①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式。
②用K2FeO4处理一定量的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图所示,当K2FeO4超过20mg时,Mn元素的去除率下降的原因可能是。
 16. 氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:
16. 氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题: (1)、下列有关NH3的说法中,错误的是____。A、工业合成NH3需要在高温高压催化剂下进行 B、NH3可用来生产碳铵和尿素等化肥 C、NH3可用浓硫酸或无水氯化钙干燥 D、NH3受热易分解,须置于冷暗处保存(2)、NH3易溶于水,标准状况下,用充满NH3的烧瓶做喷泉实验(如图),引发喷泉的方法是 , 水充满整个烧瓶后所形成溶液的物质的量浓度为mol·L-1。
(1)、下列有关NH3的说法中,错误的是____。A、工业合成NH3需要在高温高压催化剂下进行 B、NH3可用来生产碳铵和尿素等化肥 C、NH3可用浓硫酸或无水氯化钙干燥 D、NH3受热易分解,须置于冷暗处保存(2)、NH3易溶于水,标准状况下,用充满NH3的烧瓶做喷泉实验(如图),引发喷泉的方法是 , 水充满整个烧瓶后所形成溶液的物质的量浓度为mol·L-1。 (3)、氨气在氧化炉中发生反应的化学方程式为。(4)、HNO3是一种重要的化工原料,工厂生产出的浓硝酸可用铝槽车或铁槽车来运输。在常温下能使铝、铁钝化,说明浓硝酸具有很强的性。(5)、“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
(3)、氨气在氧化炉中发生反应的化学方程式为。(4)、HNO3是一种重要的化工原料,工厂生产出的浓硝酸可用铝槽车或铁槽车来运输。在常温下能使铝、铁钝化,说明浓硝酸具有很强的性。(5)、“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为Na2CO3+NO2=NaNO3++CO2(不需配平,请填写缺少物质的化学式)。
②氨转化法。已知7 mol氨恰好能将含NO和NO2共6 mol 的混合气体完全转化为N2 , 则混合气体中NO和NO2的物质的量之比为。