辽宁省县级重点高中联合体2022-2023学年高二上学期期中考试化学试题
试卷更新日期:2022-12-02 类型:期中考试
一、单选题
-
1. 下列过程能实现化学能转化为电能的是( )




A.镍镉电池放电
B.电解熔融氯化钠
C.风力发电
D.太阳能发电
A、A B、B C、C D、D2. 新制氯水中加入下列物质后,能增强漂白性的是( )A、稀硫酸 B、 C、 D、3. 下列方程式中,属于水解反应的是( )A、 B、 C、 D、4. 如图所示装置中,不能形成原电池的是( )A、 B、
B、 C、
C、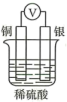 D、
D、 5. 下列关于原电池的说法中正确的是( )A、所有的氧化还原反应都可以设计成原电池 B、原电池的负极活动性一定比正极活动性强 C、铅蓄电池放电时,负极质量减小 D、电池工作时,电解质溶液中的阳离子向正极移动6. 窒温下,两种酸在水中的电离示意图(
5. 下列关于原电池的说法中正确的是( )A、所有的氧化还原反应都可以设计成原电池 B、原电池的负极活动性一定比正极活动性强 C、铅蓄电池放电时,负极质量减小 D、电池工作时,电解质溶液中的阳离子向正极移动6. 窒温下,两种酸在水中的电离示意图( 代表)如图,下列有关说法错误的是( )
代表)如图,下列有关说法错误的是( )  A、若图①溶液的 , 则将溶液稀释10倍后, B、两种酸溶液中均存在电离平衡: C、图②代表强酸在水中的电离情况 D、两种酸溶液中由水电离出的7. NA表示阿伏加德罗常数的值,下列说法正确的是( )A、常温下,的溶液中,含有的数目为0.02NA B、常温下,溶液中,含有的数目为NA C、常温下,的溶液,由水电离产生的数目为 D、标准状况下,被足量溶液吸收,所得溶液中和的总数为0.2NA8. 下列情景中对应铁电极上的电极反应式书写错误的是( )
A、若图①溶液的 , 则将溶液稀释10倍后, B、两种酸溶液中均存在电离平衡: C、图②代表强酸在水中的电离情况 D、两种酸溶液中由水电离出的7. NA表示阿伏加德罗常数的值,下列说法正确的是( )A、常温下,的溶液中,含有的数目为0.02NA B、常温下,溶液中,含有的数目为NA C、常温下,的溶液,由水电离产生的数目为 D、标准状况下,被足量溶液吸收,所得溶液中和的总数为0.2NA8. 下列情景中对应铁电极上的电极反应式书写错误的是( )选项
A
B
C
D
情景
钢铁发生析氢腐蚀
常温下,铁片和铜片在浓硝酸中组成原电池
铁片连电源正极,碳棒连电源负极,电解NaOH溶液
在铁片上镀铜
电极反应
A、A B、B C、C D、D9. 下列说法正确的是( )选项
A
B
C
D
装置




结论
Zn为阴极,为阳极
由b电极向a电极移动
锌筒因发生氧化反应而变薄
溶液的浓度始终不变
A、A B、B C、C D、D10. 下列说法正确的是( )A、难溶电解质的溶度积越大,溶解度越大 B、用溶液除去水垢中的利用了 C、25℃时,向含有沉淀的溶液中加入固体,溶液中的增大 D、25℃时,向饱和溶液中加水,的溶解度、均增大11. 科学家研制出一种新型短路膜电化学电池,利用这种电池可以消除空气中的 , 该装置的结构、工作原理如图所示。下列有关说法正确的是( ) A、乙电极为负极,发生氧化反应 B、电子移动方向:负极→电解质溶液→正极 C、当反应消耗时,理论上需要转移4mol电子 D、负极反应为12. 已知:常温下, , , 。在自然界中,闪锌矿(ZnS)和方铅矿(PbS)遇硫酸铜溶液均能转化成铜蓝(CuS)。下列说法正确的是( )A、饱和PbS溶液中, B、相同温度下,在水中的溶解度:ZnS>CuS>PbS C、向PbS固体中滴加一定量溶液,反应达到平衡时,溶液中 D、向含浓度相同的、、的混合溶液中逐滴加入稀溶液,先沉淀13. 是食品加工中最为广泛的食品添加剂,用于焙烤食品;在分析试剂、医药、电子工业中用途广泛,下列说法错误的是( )A、常温时,溶液存在: B、常温时,向溶液中滴加溶液,发生反应的离子方程式为 C、相同条件下,溶液中:溶液溶液 D、常温下,的溶液中存在:14. 二氧化碳的再利用是实现温室气体减排的重要途径之一。在稀中利用电催化可将同时转化为多种燃料,其原理如图所示,下列说法错误的是( )
A、乙电极为负极,发生氧化反应 B、电子移动方向:负极→电解质溶液→正极 C、当反应消耗时,理论上需要转移4mol电子 D、负极反应为12. 已知:常温下, , , 。在自然界中,闪锌矿(ZnS)和方铅矿(PbS)遇硫酸铜溶液均能转化成铜蓝(CuS)。下列说法正确的是( )A、饱和PbS溶液中, B、相同温度下,在水中的溶解度:ZnS>CuS>PbS C、向PbS固体中滴加一定量溶液,反应达到平衡时,溶液中 D、向含浓度相同的、、的混合溶液中逐滴加入稀溶液,先沉淀13. 是食品加工中最为广泛的食品添加剂,用于焙烤食品;在分析试剂、医药、电子工业中用途广泛,下列说法错误的是( )A、常温时,溶液存在: B、常温时,向溶液中滴加溶液,发生反应的离子方程式为 C、相同条件下,溶液中:溶液溶液 D、常温下,的溶液中存在:14. 二氧化碳的再利用是实现温室气体减排的重要途径之一。在稀中利用电催化可将同时转化为多种燃料,其原理如图所示,下列说法错误的是( ) A、一段时间后,阴极区溶液质量会减少 B、离子交换膜为阳离子交换膜 C、Pt电极上的电极反应式为 D、若阴极只生成0.15molCO和0.35molHCOOH,则电路中转移电子的物质的量为1mol15. 常温时,分别向起始体积均为的次磷酸( , 一元弱酸)溶液和氟硼酸溶液中加蒸馏水稀释,稀释后溶液的体积均为VL,两溶液的pH随的变化曲线如图所示。下列说法错误的是( )
A、一段时间后,阴极区溶液质量会减少 B、离子交换膜为阳离子交换膜 C、Pt电极上的电极反应式为 D、若阴极只生成0.15molCO和0.35molHCOOH,则电路中转移电子的物质的量为1mol15. 常温时,分别向起始体积均为的次磷酸( , 一元弱酸)溶液和氟硼酸溶液中加蒸馏水稀释,稀释后溶液的体积均为VL,两溶液的pH随的变化曲线如图所示。下列说法错误的是( ) A、的电离平衡常数的数量级为 B、溶液中存在: C、溶液显碱性的原因是的电离程度大于其水解程度 D、A,B,C三点溶液中水的电离程度由大到小的顺序是C>B>A
A、的电离平衡常数的数量级为 B、溶液中存在: C、溶液显碱性的原因是的电离程度大于其水解程度 D、A,B,C三点溶液中水的电离程度由大到小的顺序是C>B>A二、综合题
-
16. 中华人民共和国国家标准(GB2760-2011)规定葡萄酒中的最大使用量为。某化学兴趣小组用如图所示装置(夹持装置略)收集某葡萄酒中的 , 并对其含量进行测定。
 (1)、B中加入300.00mL葡萄酒和适量硫酸,加热使全部逸出并与C中完全反应,C中发生反应的化学方程式为。(2)、除去C中过量的后,用标准溶液进行滴定,该标准液应置于(填“酸式”或“碱式”)滴定管中,若用容量为50mL的滴定管进行实验,当滴定管中的凹液面最低处在刻度“15”处时,则管内液体的体积(填标号)。
(1)、B中加入300.00mL葡萄酒和适量硫酸,加热使全部逸出并与C中完全反应,C中发生反应的化学方程式为。(2)、除去C中过量的后,用标准溶液进行滴定,该标准液应置于(填“酸式”或“碱式”)滴定管中,若用容量为50mL的滴定管进行实验,当滴定管中的凹液面最低处在刻度“15”处时,则管内液体的体积(填标号)。A.=15mL B.=35mL C.<15mL D.>35mL
(3)、该兴趣小组选择用酚酞作指示剂,达到滴定终点的标志为。(4)、①滴定开始和结束时,滴定管中液面如图所示,则起始读数为mL,终点读数为mL,所用NaOH溶液的体积为mL。
②根据消耗的NaOH溶液的量,计算该葡萄酒中含量为。
(5)、下列操作可能使测定的葡萄酒中含量偏低的是___________(填标号)。A、滴定管未用标准液润洗就直接注入NaOH标准溶液 B、滴定管在滴定前无气泡,滴定后尖嘴处有气泡 C、滴定结束后,滴定管尖嘴处悬挂一滴液滴 D、读取NaOH溶液体积时,滴定前读数符合题意,滴定后俯视读数17. 两种电化学装置如图所示。
已知金属活泼性:。
回答下列问题:
(1)、从能量的角度分析,装置B将能转化为能。(2)、①装置A工作时,Zn电极为(填“正极”或“负极”),发生的电极反应为。②利用装置A进行实验,发现锌片、锰片质量均减轻,说明装置中除了发生电化学反应,还发生非电化学反应,该反应的离子方程式为。实验结束时测得电解质溶液增加32.8g,电流表中有1mol电子发生转移,则锌溶解了g。
(3)、①装置B工作时盐桥中的K+流向(填“”或“”)溶液。②若装置B中负极金属的消耗速率为 , 则盐桥中K+的迁移速率为。
18. 已知室温下有关弱酸的电离平衡常数如表所示:弱酸
电离平衡常数
回答下列问题:
(1)、的电离方程式为。(2)、上述、、三种酸的酸性由强到弱的顺序为(填分子式)。(3)、向浓度均为的溶液和溶液中加入:①若加稀释至相同的 , 则溶液中加入的体积:(填“>”、“<”或“=”)。
②若加稀释相同的倍数,则此时溶液的(填“>”、“<”或“=”)。
(4)、室温下,向未知浓度的溶液中加入溶液:①溶液中(填“增大”、“减小”、“不变”或“无法判断”)。
②滴加溶液至溶液中的 , 此时溶液的(填“>”、 “<”或“=”)7,判断的理由为。
(5)、若向的溶液中滴加等体积一定浓度的稀硫酸,此时测得溶液中的 , 则溶液中。19. 电芬顿法是利用电化学法产生的和作为芬顿试剂的持续来源,两者产生后立即作用生成具有高度活性的羟基自由基(·OH),能使有机污染物得到降解,可达到高效的废水净化效果,其耦合系统原理示意图如图所示(乙池中电解质溶液为稀硫酸)。
请回答下列问题:
(1)、工作时,将电能转化为化学能的装置是(填“甲”或“乙”)。(2)、b电极为(填“正极”、“负极”、“阳极”或“阴极”,下同),X电极为。(3)、上述装置工作时,a电极发生的电极反应为 , 一段时间后,甲池中溶液的pH(填“增大”、“减小”或“不变”)。(4)、Y电极发生的电极反应为 , 乙池生成具有高度活性的·OH时的化学方程式为;理论上当甲池消耗时,乙池中产生的·OH的物质的量为mol。(5)、如果污染物为甲醛(HCHO),那么其被降解的化学方程式为。