山东省德州市2022-2023学年高二上学期期中考试化学试题
试卷更新日期:2022-12-02 类型:期中考试
一、多选题
-
1. 化学与科技、生产、生活密切相关,下列有关说法错误的是( )A、火箭燃料偏二甲肼、氢气等属于可再生能源 B、离子交换膜有多种类型,氯碱工业中使用的是阳离子交换膜 C、“嫦娥五号”使用的太阳能电池阵和锂离子电池组,均可将化学能转化为电能 D、大桥钢架结构表面喷涂油漆目的是隔绝空气、水等,防止发生电化学腐蚀2. 加氢制甲醇作为一种新兴的绿色化工技术,其中的一步反应为 , 该反应中物质的相对能量及所含共价键的键能如下所示,下列说法正确的是( )
物质及共价键
键能/(kJ/mol)
799
436
463
x
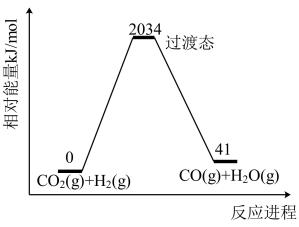
已知: A.图中所示反应的逆反应活化能为2034
A、x为1067 B、 C、反应物的总键能小于生成物的总键能3. 某实验室模拟反应2C(s)+2NO2(g)N2(g)+2CO2(g) ∆H=-64.2 kJ∙mol-1 , 在密闭容器中加入足量的碳和一定量的NO2气体,保持温度不变,测得相同时间内NO2的转化率随压强的变化关系如图所示。下列说法错误的是( ) A、b、e两点NO2的平衡转化率相同 B、1100时,NO2的体积分数为50% C、平衡常数 Kb=Kd D、反应速率4. 在2L密闭容器中充入气体A和B,发生反应: , 所得实验数据如下表。下列说法错误的是( )
A、b、e两点NO2的平衡转化率相同 B、1100时,NO2的体积分数为50% C、平衡常数 Kb=Kd D、反应速率4. 在2L密闭容器中充入气体A和B,发生反应: , 所得实验数据如下表。下列说法错误的是( )实验编号
温度/℃
起始时物质的量/
平衡时物质的量/
①
300
0.40
0.10
0.090
②
500
0.40
0.10
0.080
③
500
0.20
0.05
a
A、该反应 B、平衡时物质B的体积分数:②① C、实验③中达到平衡时,a值小于0.040 D、500℃该反应的平衡常数K的数值为0.32二、单选题
-
5. 下列有关热化学方程式的叙述中正确的是( )A、中和热的离子方程式为: B、已知 , 则 C、已知 , 则的摩尔燃烧焓为 D、已知C(石墨,s)C(金刚石,s) , 则金刚石比石墨稳定6. 金属的腐蚀与防护无处不在,下列说法错误的是( )A、纯铁在潮湿空气中不易被腐蚀 B、一次性保暖贴是利用电化学腐蚀提供热量 C、地下钢管与电源正极连接采用的是外加电流的阴极保护法 D、铺设在隧道中的钢轨每隔一根轨枕系一块锌片,采用的是牺牲阳极的阴极保护法7. 一定量的一氧化氮和足量碳在密闭容器中发生化学反应: , 下列有关叙述错误的是( )A、升高体系温度能缩短反应达到平衡的时间 B、增加的量,平衡不移动 C、恒温、恒压条件下,充入稀有气体 , 平衡不移动 D、容器内气体压强不再发生改变时,可判断反应达到平衡状态8. 铝合金(含Cu、Mg和Si等)用途广泛,利用电解原理处理铝合金废料可以实现铝的再生,从而使资源得到合理利用。下列说法正确的是( )A、阳极发生的反应为Al3++3e- =Al B、在电解槽底部产生含Cu、Si的阳极泥 C、电解质溶液可以是Al2(SO4)3溶液 D、阳极和阴极的质量变化相等9. 在恒温恒容的密闭容器中进行: , 一段时间后达到化学平衡状态,下列说法正确的是( )A、该反应低温下能自发进行,则 B、充入一定量的 , 反应速率加快 C、、的浓度之和保持不变时,说明该反应达到了平衡状态 D、平衡后,再充入一定量 , 达新平衡后的物质的量分数增大10. 下列电化学装置的相关叙述错误的是( )
 A、若甲装置中两电极为石墨,则U型管右侧溶液变红 B、乙装置中正极的电极反应为 C、丙为锂―空气电池的工作原理图,离子交换膜为阴离子交换膜 D、丁装置使用一段时间后,电解质溶液的酸性减弱,导电能力下降11. 在容积为2L的密闭容器中通入一定量的、 , 一定条件下发生反应:(忽略和的反应),容器中各物质的物质的量随时间的变化如图所示,下列说法错误的是( )
A、若甲装置中两电极为石墨,则U型管右侧溶液变红 B、乙装置中正极的电极反应为 C、丙为锂―空气电池的工作原理图,离子交换膜为阴离子交换膜 D、丁装置使用一段时间后,电解质溶液的酸性减弱,导电能力下降11. 在容积为2L的密闭容器中通入一定量的、 , 一定条件下发生反应:(忽略和的反应),容器中各物质的物质的量随时间的变化如图所示,下列说法错误的是( ) A、2min时改变的条件可能是升高温度 B、4min时正反应速率增大,逆反应速率减小 C、6min时的物质的量分数为41.32% D、0-5min内的反应速率12. 下列叙述与图中甲、乙、丙、丁相符合的是( )
A、2min时改变的条件可能是升高温度 B、4min时正反应速率增大,逆反应速率减小 C、6min时的物质的量分数为41.32% D、0-5min内的反应速率12. 下列叙述与图中甲、乙、丙、丁相符合的是( )

甲:FeCl3+3KSCN⇌Fe(SCN)3+3KCl
乙:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)


丙:H2(g)+I2(g)⇌2HI(g)
丁:2SO2(g)+O2 (g) ⇌2SO3 (g)
A、图甲是向平衡后的溶液中加入少量晶体,反应速率随时间变化的图像 B、图乙刚性密闭容器中,平衡时混合气体的平均摩尔质量: C、图丙中a改变的条件一定是加入催化剂 D、图丁中K为化学平衡常数, P点处化学反应速率13. T℃时,体积均为0.5L的两个恒温恒容密闭容器中发生可逆反应: ()。保持温度不变,实验测得起始和平衡时的有关数据如下表:实验编号
起始时各物质物质的量/
达平衡时体系能量的变化
①
3
1
0
放热
②
0.9
0.3
1.4
③
0.9
0.3
0.4
下列叙述中错误的是( )
A、实验①小于实验③中的百分含量 B、实验①和实验②平衡时的浓度相等 C、实验②达到平衡时吸收的热量 D、其它条件不变,若实验①保持恒容绝热,则达到平衡时放出热量小于14. 氟离子电池()是一种新型的二次电池,具有极高的能量密度,其放电时变化原理如图所示。下列说法错误的是( ) A、该装置必须采用非水相电解质 B、放电时负极的电极反应式为 C、电能转化为化学能时总反应: D、充电时当阴极减少38g时,电路中有2电子转移15. 科学研究人员结合实验与计算机模拟结果,研究了在催化剂表面上与的反应历程,前三步历程如图所示,其中吸附在催化剂表面上的物种用“●”标注,表示过渡态。
A、该装置必须采用非水相电解质 B、放电时负极的电极反应式为 C、电能转化为化学能时总反应: D、充电时当阴极减少38g时,电路中有2电子转移15. 科学研究人员结合实验与计算机模拟结果,研究了在催化剂表面上与的反应历程,前三步历程如图所示,其中吸附在催化剂表面上的物种用“●”标注,表示过渡态。
下列有关叙述正确的是( )
A、上述反应历程中每一步均存在氢氢键的断裂 B、上述反应历程中的速率由第1步反应决定 C、·HOCO转化为·CO和·OH需要吸热 D、催化剂通过参与化学反应,降低反应的活化能,提高反应物的平衡转化率三、综合题
-
16. 利用化学反应为人类提供能量,研究反应中的能量变化意义重大。
 (1)、和可发生反应 , 部分反应进程如图所示。
(1)、和可发生反应 , 部分反应进程如图所示。已知总反应分3步进行:
①。
②第1步基元反应为;第2步反应的活化能为。
(2)、华为全球首款旗舰5G芯片—麒麟990,其主要制作原料为高纯硅。工业上使用C还原制备高纯硅时,部分反应如下:反应1:
反应2:
反应3:
反应的(用a、b、c表示,下同)。已知该反应为吸热反应,当有18碳发生反应时,吸收热量。
(3)、用500.55盐酸与500.50溶液进行中和热的测定。实验数据如下:实验用品
溶液温度
生成1放出的热量
a
500.50
溶液
500.55
溶液
20℃
23.3℃
b
500.50
溶液
500.55
溶液
20℃
23.5℃
c
500.50
溶液
500.55
溶液
20℃
24.5℃
已知: , 反应后溶液的比热容c为4.18 , 各溶液的密度均为1。
①完成上表(保留1位小数) 。
②上述实验数值结果与57.3有偏差,产生偏差的原因不可能是 (填字母序号)。
A.实验装置保温、隔热效果差
B.分多次把溶液倒入盛有盐酸的小烧杯中
C.用温度计测定溶液起始温度后直接测定盐酸溶液的温度
D.用量筒量取溶液的体积时仰视读数
17. 甲醇是重要的有机化工原料,具有开发和应用的广阔前景。工业上通常采用 来合成甲醇。已知:在T℃时,向体积为2L的密闭容器中充入物质的量之和为3的和 , 反应达到平衡时的体积分数()与的关系如图所示。 (1)、反应的平衡常数表达式为 , B、C两点的平衡转化率(填“>、<或=”)(2)、当时,经过2min达到平衡,此时体系压强为p , 的转化率为60%,若 , 则0~2min内用压强表示该反应的平均反应速率(保留两位有效数字),若此时向容器中通入和各0.4 , 平衡向方向移动(填“正反应”或“逆反应”),理由是。(3)、当时,的平衡体积分数可能是图像中的(填“D”、“E”或“F”)点。(4)、理论上合成甲醇的适宜条件____。A、低温 高压 B、高温低压 C、起始投料比: D、起始投料比:18. 随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。(1)、方法1:以CO2和NH3为原料合成尿素 2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g) ∆H=-87 kJ∙mol-1。研究发现,合成尿素反应分两步完成。
(1)、反应的平衡常数表达式为 , B、C两点的平衡转化率(填“>、<或=”)(2)、当时,经过2min达到平衡,此时体系压强为p , 的转化率为60%,若 , 则0~2min内用压强表示该反应的平均反应速率(保留两位有效数字),若此时向容器中通入和各0.4 , 平衡向方向移动(填“正反应”或“逆反应”),理由是。(3)、当时,的平衡体积分数可能是图像中的(填“D”、“E”或“F”)点。(4)、理论上合成甲醇的适宜条件____。A、低温 高压 B、高温低压 C、起始投料比: D、起始投料比:18. 随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。(1)、方法1:以CO2和NH3为原料合成尿素 2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g) ∆H=-87 kJ∙mol-1。研究发现,合成尿素反应分两步完成。第1步:2NH3(g)+CO2(g)NH2COONH4(s) ∆H1=-159.47kJ∙mol-1
第2步:……
①第2步反应的热化学反应方程式为。
②一定条件下的恒容容器中,充入1.5mol NH3和1mol CO2 , 平衡时CO2的转化率为50%,则平衡时n(NH3):n(CO2)= , 已知第2步反应的Kp=mkPa,测得平衡时容器内总压为3 mkPa,则反应2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)的平衡常数Kp=。
③若要提高NH3平衡转化率,可采取的措施有(任写一条)。
(2)、方法2:电化学法还原二氧化碳制乙烯在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:

阴极电极反应式为 , 该装置中使用的是(填“阴”或“阳”)离子交换膜。
19. 电化学在物质制备、新材料和环境保护等方面具有独到的应用优势。(1)、高铁酸钠()是一种新型水处理剂,强碱性条件下稳定存在。电解法制备的工作原理如图所示,a是电源的极(填“正”或“负”)。阳极电极的电极反应式为 , 装置中可循环使用的物质的化学式是。 (2)、燃煤烟气中的可用如下装置进行处理。
(2)、燃煤烟气中的可用如下装置进行处理。
M极发生的电极反应式为 , 一段时间后N极附近溶液(填“增大”、“减小”或“不变”);当外电路通过0.2电子时,质子交换膜左侧溶液质量(填“增大”或“减小”)g。
20. 实验是化学研究的重要手段。已知:i.具有强氧化性,能完全电离,易被还原为;
ii.淀粉检测的灵敏度很高,遇低浓度的即可快速变蓝;
iii.溶液中存在:。
(1)、研究与的平均反应速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。编号
0.2溶液/
0.01溶液/
蒸馏水/
0.4%的淀粉溶液/
0.2溶液/
变色时间/s
1—1
2
0
2.7
0.1
0.2
立即
1—2
2
0.8
0.1
0.1
2
30
查阅文献知,实验1—2中的反应分两步进行,反应I:……;反应II:。
①反应I的离子方程式是;
②加入溶液后溶液变色的时间明显增长的原因。
③根据实验数据,计算30s内的平均反应速率。
(2)、研究反应速率与和的关系 , k为常数。实验数据如表:(所用试剂除标注外均为0.2)实验编号
溶液/
溶液/
0.05溶液/
溶液/
溶液/
0.2%淀粉溶液/
2—1
10
10
3
0
0
1
2—2
10
5
3
1
2—3
10
2.5
3
1
①加入、溶液的目的是控制实验条件,其中 ,
②若实验测得数据 , 则。
③此实验的结论为。