浙江省宁波市慈溪市2022-2023学年九年级上学期科学期中考试试卷
试卷更新日期:2022-12-01 类型:期中考试
一、选择题(本题共15小题,1—10小题,每题4分,11—15小题,每题3分,共55分。请选出每小题中一个符合题意的选项,不选、选错均不给分)
-
1. 2022年7月24日14时22分,搭载问天实验舱的长征五号B遥三运载火箭,在文昌航天发射场点火发射,发射取得圆满成功。运载火箭在工作中发生的反应为 , 则X的化学式是( )
 A、NO2 B、N2O3 C、N2O4 D、N2O52. 截止到2021年12月5日, “奋斗者”号潜水器完成21次万米深潜。我国发明的新型钛合金,为中国载人潜水器“奋斗者”号下潜万米海底、从事科考任务解决了材料难题。工业制取金属钛的主要反应是:
A、NO2 B、N2O3 C、N2O4 D、N2O52. 截止到2021年12月5日, “奋斗者”号潜水器完成21次万米深潜。我国发明的新型钛合金,为中国载人潜水器“奋斗者”号下潜万米海底、从事科考任务解决了材料难题。工业制取金属钛的主要反应是:①
②
由此判断下列说法合理的是( )
 A、FeTiO3属于氧化物 B、钛合金是一种金属单质 C、在反应②前后,镁元素的化合价升高 D、TiCl4在上述反应中起催化作用3. 天宫课堂上的泡腾片实验让我们再次感受化学的魅力。维生素C泡腾片中含有维生素C、柠檬酸(化学式为C6H8O7)、碳酸氢钠等物质,下列关于柠檬酸的说法正确的是( )A、柠檬酸是一种氧化物 B、柠檬酸中氧元素的质量分数最大 C、柠檬酸由21个原子构成 D、柠檬酸中碳、氢、氧三种元素的质量比是6:8:74. 2022年3·15晚会以“公平守正 安心消费”为主题,继续关注消费领域的违法侵权现象, 曝光名单之一:翡翠直播间借高价原石发廉价成品。翡翠的主要成分是硬玉[NaAl(SiO3)2]。其中Si的化合价为( )A、 +4 B、-4 C、+3 D、+25. 2022年5月10日凌晨,天舟四号货运飞船在位于海南文昌的中国文昌航天发射场由长征七号遥五运载火箭成功发射。空间站里的O2源自电解水,所得H2与CO2反应生成H2O和CH4 , 该反应的微观示意图如图所示。下列叙述错误的是( )
A、FeTiO3属于氧化物 B、钛合金是一种金属单质 C、在反应②前后,镁元素的化合价升高 D、TiCl4在上述反应中起催化作用3. 天宫课堂上的泡腾片实验让我们再次感受化学的魅力。维生素C泡腾片中含有维生素C、柠檬酸(化学式为C6H8O7)、碳酸氢钠等物质,下列关于柠檬酸的说法正确的是( )A、柠檬酸是一种氧化物 B、柠檬酸中氧元素的质量分数最大 C、柠檬酸由21个原子构成 D、柠檬酸中碳、氢、氧三种元素的质量比是6:8:74. 2022年3·15晚会以“公平守正 安心消费”为主题,继续关注消费领域的违法侵权现象, 曝光名单之一:翡翠直播间借高价原石发廉价成品。翡翠的主要成分是硬玉[NaAl(SiO3)2]。其中Si的化合价为( )A、 +4 B、-4 C、+3 D、+25. 2022年5月10日凌晨,天舟四号货运飞船在位于海南文昌的中国文昌航天发射场由长征七号遥五运载火箭成功发射。空间站里的O2源自电解水,所得H2与CO2反应生成H2O和CH4 , 该反应的微观示意图如图所示。下列叙述错误的是( ) A、反应前后原子数目不变 B、原子可以构成分子 C、反应中分子可以再分 D、参加反应的氢气和二氧化碳的分子个数比为1:16. 2022年5月21日,工业和信息化部赛迪研究院近日发布2021中国锂电产业发展指数白皮书。白皮书显示,从全球范围来看,中国已连续五年成为全球最大的锂电池消费市场。某种锂电池的总反应可表示为:Li+MnO2═LiMnO2 , 下列说法正确的是( )A、属于化合反应 B、属于分解反应 C、MnO2作催化剂 D、反应前后Li元素的化合价不变7. 2022年9月5日,四川省甘孜藏族自治州泸定县发生6.8级地震,地震后灾区要特别注意环境消毒,防止疫情发生。次氯酸(HClO)是灾区使用的消毒剂之一,根据如图所示消毒过程中发生反应的微观示意图,则有关说法正确的是( )
A、反应前后原子数目不变 B、原子可以构成分子 C、反应中分子可以再分 D、参加反应的氢气和二氧化碳的分子个数比为1:16. 2022年5月21日,工业和信息化部赛迪研究院近日发布2021中国锂电产业发展指数白皮书。白皮书显示,从全球范围来看,中国已连续五年成为全球最大的锂电池消费市场。某种锂电池的总反应可表示为:Li+MnO2═LiMnO2 , 下列说法正确的是( )A、属于化合反应 B、属于分解反应 C、MnO2作催化剂 D、反应前后Li元素的化合价不变7. 2022年9月5日,四川省甘孜藏族自治州泸定县发生6.8级地震,地震后灾区要特别注意环境消毒,防止疫情发生。次氯酸(HClO)是灾区使用的消毒剂之一,根据如图所示消毒过程中发生反应的微观示意图,则有关说法正确的是( ) A、图示中共有四种分子 B、此反应类型为化合反应 C、该反应中氯元素的化合价不变 D、图示不符合质量守恒定律8. 下列各组离子在pH=4的溶液中能大量共存,且形成无色溶液的是( )A、Na+、Ca2+、Cl- B、、K+、 C、Cu2+、Cl-、 D、Ba2+、Al3+、9. 周礼考工记》中记载制取氢氧化钾漂洗丝帛的工艺,流程是:将木头烧成灰,用其灰汁浸泡丝帛,再加入石灰即可。下列说法错误的是( )A、“灰”的主要成分是K2CO3 B、漂洗丝帛的液体可使酚酞显红色 C、“石灰”常用于改良碱性土壤 D、高温煅烧石灰石可以得到“石灰”10. 学习科学知识可以用来辨别“真”、“伪”。下列叙述属于“真”的是( )A、氮气化学性质不活泼,可用作粮食瓜果保护气 B、氧气具有助燃性,常作火箭推进燃料 C、氢氧化钠具有碱性,可用于治疗胃酸过多 D、活性炭具有吸附性,可使硬水软化11. 下列实验方法不能达到实验目的的是( )
A、图示中共有四种分子 B、此反应类型为化合反应 C、该反应中氯元素的化合价不变 D、图示不符合质量守恒定律8. 下列各组离子在pH=4的溶液中能大量共存,且形成无色溶液的是( )A、Na+、Ca2+、Cl- B、、K+、 C、Cu2+、Cl-、 D、Ba2+、Al3+、9. 周礼考工记》中记载制取氢氧化钾漂洗丝帛的工艺,流程是:将木头烧成灰,用其灰汁浸泡丝帛,再加入石灰即可。下列说法错误的是( )A、“灰”的主要成分是K2CO3 B、漂洗丝帛的液体可使酚酞显红色 C、“石灰”常用于改良碱性土壤 D、高温煅烧石灰石可以得到“石灰”10. 学习科学知识可以用来辨别“真”、“伪”。下列叙述属于“真”的是( )A、氮气化学性质不活泼,可用作粮食瓜果保护气 B、氧气具有助燃性,常作火箭推进燃料 C、氢氧化钠具有碱性,可用于治疗胃酸过多 D、活性炭具有吸附性,可使硬水软化11. 下列实验方法不能达到实验目的的是( )实验目的
实验方法
A
鉴别羊毛线和棉线
取样,在空气中灼烧
B
鉴别木炭粉和氧化铜粉
取样,在空气中灼烧
C
除去氯化钙固体中的碳酸钙
加足量水,过滤
D
除去硝酸钠溶液中的氯化钠
加适量硝酸银溶液,过滤
A、A B、B C、C D、D12. 下列有关物质的除杂方法不正确的是( )选项
物质
所含杂质
除杂方法
A
CO2
O2
将气体通过灼热的铜网,充分反应
B
NaOH溶液
Na2CO3
加入适量稀盐酸,充分反应
C
Al2(SO4)3溶液
CuSO4
加入适量的铝粉充分反应后,过滤
D
KCl固体
MnO2
加水溶解后,过滤,蒸发结晶
A、A B、B C、C D、D13. 如图所示转化关系中的反应均为初中化学常见的反应,“→”表示反应可以一步实现(反应条件已省略),下表中甲、乙、丙三种物质符合图示转化关系的是( )
选项
甲
乙
丙
A
CuCl2
Cu
CuO
B
CO2
Na2CO3
CaCO3
C
CaO
Ca(OH)2
CaCl2
D
Fe
Fe2(SO4)3
Fe(OH)3
A、A B、B C、C D、D14. 向 100g 硫酸铜和盐酸混合液中逐滴加入10%的氢氧化钠溶液,产生沉淀的质量与滴入氢氧化钠溶液的质量关系如图所示,其中 A 点坐标(40,0),下列说法不正确的是( ) A、OA 段与氢氧化钠反应的是盐酸 B、B 点对应的溶液中溶质是氢氧化铜 C、C 点对应溶液的pH>7 D、混合溶液中盐酸的溶质质量分数为 3.65%15. 铜元素的“化合价与物质类别”对应关系如下图。下列有关说法不正确的是( )
A、OA 段与氢氧化钠反应的是盐酸 B、B 点对应的溶液中溶质是氢氧化铜 C、C 点对应溶液的pH>7 D、混合溶液中盐酸的溶质质量分数为 3.65%15. 铜元素的“化合价与物质类别”对应关系如下图。下列有关说法不正确的是( ) A、Cu(OH)2属于碱 B、物质a的化学式为Cu2O C、Cu可与稀硫酸反应生成CuSO4 D、CuSO4溶液可与氢氧化钠溶液反应生成Cu(OH)2
A、Cu(OH)2属于碱 B、物质a的化学式为Cu2O C、Cu可与稀硫酸反应生成CuSO4 D、CuSO4溶液可与氢氧化钠溶液反应生成Cu(OH)2二、填空题(本题有6小题,每空格2分,共34分)
-
16. 化学在生产、生活中有着广泛应用。(1)、现有三种物质:A.氧气 B.金刚石 C.氯化钾,选择适当的物质填空(填字母序号)。
①可用于医疗急救的是;②可用来裁玻璃的是;
(2)、疫情防控,处处蕴含化学知识。①正确佩戴口罩能有效预防新冠肺炎,制作口罩用的无纺布主要成分是聚丙烯,聚丙烯属于____(填字母序号)。
A、天然有机高分子材料 B、合成有机高分子材料17. 西汉刘安所著《淮南万毕术》记载的湿法炼铜术,表明我国是最早利用硫酸铜的国家。(1)、微观认识:构成硫酸铜的粒子是(填符号)。(2)、宏观分析:用硫酸铜炼铜的化学反应中,铜元素的化合价由价变成价。(3)、用途推测:硫酸铜是白色粉末,遇水变成蓝色,推测其用途为。18. 用下图装置研究酸、碱的性质。 (1)、向1中滴加Na2CO3溶液,观察到的现象是。(2)、向2、3中滴加无色酚酞溶液,溶液变红的是(填序号);再向3中滴加NaOH溶液,NaOH与盐酸反应的化学方程式为。19. 在化学学习和研究中有很多规律可循。应用规律可以让我们获取新知识。(1)、碱性强弱规律
(1)、向1中滴加Na2CO3溶液,观察到的现象是。(2)、向2、3中滴加无色酚酞溶液,溶液变红的是(填序号);再向3中滴加NaOH溶液,NaOH与盐酸反应的化学方程式为。19. 在化学学习和研究中有很多规律可循。应用规律可以让我们获取新知识。(1)、碱性强弱规律大量实验证明:金属越活泼。其对应的碱的碱性越强(碱的碱性强弱与碱的溶解性无关)。下列关于碱性强弱判断正确的是______。(填字母序号)
A、KOH>NaOH>Ca(OH)2 B、KOH >Ca(OH)2>NaOH C、NaOH > Ca(OH)2>KOH(2)、强酸制备弱酸规律较强酸能制备较弱酸。已知酸性强弱:HCl>H2SO4>H2CO3>H2S,则下列反应不可能发生的是______(填字母序号)
A、 B、 C、(3)、物质命名规律:某些类别的物质命名与化合价有关:如:HClO4(高氯酸)、HClO3(氯酸)、HClO2(亚氯酸)、HClO(次氯酸)。磷的含氧酸有H3PO4、H3PO3、H3PO2 , 其中H3PO4为磷酸,则H3PO2的名称为。
20. 我国化学工程专家侯德榜于1943年在实验室完成了“侯氏制碱法”,并于1953年7月1日获得了新中国第一号发明专利证书。“侯氏制碱法”的反应原理可简单表示为:①
②
(1)、“侯氏制碱法”得到的“碱”是(填“烧碱”或“纯碱”)。(2)、反应①条件下,NaCl、NH4Cl、NaHCO3三种物质中溶解度最小的是。(3)、反应②的反应类型是。21. 构建思维导图是一种重要的学习方法。请根据酸和碱的化学性质思维导图,回答下列问题。(“一”表示相连的两类物质之间可以发生化学反应) (1)、请写出图中甲表示的物质类别。(2)、酸与碱作用生成盐和水的反应,叫做中和反应。请写出一个中和反应的化学方程式。(3)、酸和碱能与指示剂反应,而使指示剂显示不同的颜色。如NaOH溶液能使无色酚酞变成色。
(1)、请写出图中甲表示的物质类别。(2)、酸与碱作用生成盐和水的反应,叫做中和反应。请写出一个中和反应的化学方程式。(3)、酸和碱能与指示剂反应,而使指示剂显示不同的颜色。如NaOH溶液能使无色酚酞变成色。三、实验探究题(本题共3小题,每空3分,共36分)
-
22. 请根据下列实验装置图回答问题。
 (1)、实验室制取氧气有多种方法。
(1)、实验室制取氧气有多种方法。用装置A制取氧气,反应的化学方程式为。用装置E收集氧气,检验是否集满的方法是(写出操作、现象和结论)。
(2)、实验室制取二氧化碳的化学方程式为。选择的装置组合是(填字母),23. 某化学兴趣小组同学在探究碱的化学性质时,设计并完成了如下实验:
【实验探究】
Ⅰ、向滴加有酚酞的NaOH溶液中慢慢滴入稀盐酸(如图1所示),边滴加边振荡,测得试管①中最终溶液的pH=2。
Ⅱ、分别称取0.5g氢氧化钙粉末置于两支试管中,各滴加2mL水,振荡;再向试管②中加入2mL水、试管③中加入2mL稀盐酸(如图2所示)。振荡并观察现象。
Ⅲ、向盛有氢氧化钠溶液的试管④中加入少量硫酸铜溶液,振荡。静置后测得上层清液的pH=12,继续向其中滴加几滴稀盐酸(如图3所示),试管⑤中无明显现象。
(1)、实验Ⅰ中,能证明盐酸和氢氧化钠发生了化学反应的实验现象是。试管①最终溶液中含有的溶质有(酚酞除外)。(2)、实验Ⅱ中用水作对照实验,其目的是。(3)、试管④中发生反应的化学方程式是。【分析讨论】甲同学通过“试管⑤中无明显现象”得出“盐酸不能与Cu(OH)2发生反应”
 结论。24. )同学们在学习“化学反应中的能量变化”时,进行了如下探究实验。
结论。24. )同学们在学习“化学反应中的能量变化”时,进行了如下探究实验。
Ⅰ.实验中,触摸试管外壁,都有发热现象,说明实验甲和实验乙的反应均为(填“吸热”或“放热”)反应。II.拓展探究
【提出问题】实验乙反应后的溶液中溶质成分是什么?
【进行猜想】猜想一:可能是氯化镁 猜想二:可能是氯化镁和。
【实验探究】为验证猜想,设计并进行了如下实验:
实验操作
实验现象
实验结论
小明取少量该溶液于试管中,滴加2~3滴无色酚酞溶液
溶液不变色
猜想一成立
小红取少量该溶液于试管中,逐滴加入氢氧化钠溶液
先无明显现象后出现
猜想二成立
【交流讨论】同学们提出小明的实验结论不正确,理由是。
四、解答题(本题共6小题,第25、28、29、小题各8分,第26、27小题各6分,30题7分,共43分)
-
25. 近日浙江杭州的王大妈因食用冰箱里泡了2天的黑木耳而造成中毒。原因是久泡的黑木耳中滋生了致命毒素米酵菌酸(C28H38O7)。(1)、米酵菌酸由 种元素组成。(2)、一个米酵菌酸分子由个原子构成。(3)、米酵菌酸中碳氢氧元素的质量比是 。(4)、米酵菌酸的相对分子质量是26. 将40g稀盐酸逐滴加入20g溶质质量分数为4%的氢氧化钠溶液中,边滴边搅拌。随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。试分析:
 (1)、图二从A到B过程中,溶液pH逐渐(选填“增大”或“减小”)。(2)、图二表示C点时的溶质是 。(3)、计算稀盐酸中溶质的质量分数。27. 铜锌合金外观似金子,化学小组为检测其中锌的质量分数,按下列流程进行探究实验,充分反应,所得数据如图所示(忽略盐酸的挥发):
(1)、图二从A到B过程中,溶液pH逐渐(选填“增大”或“减小”)。(2)、图二表示C点时的溶质是 。(3)、计算稀盐酸中溶质的质量分数。27. 铜锌合金外观似金子,化学小组为检测其中锌的质量分数,按下列流程进行探究实验,充分反应,所得数据如图所示(忽略盐酸的挥发):
求:
(1)、生成氢气的总质量为g。(2)、合金中锌的质量分数。(3)、稀盐酸中溶质的质量分数。28. 固体混合物中可能含有氢氧化钠、硝酸钠、氯化钠、硫酸钠、碳酸钠。为了研究该混合物的成分,某同学按下列流程进行了实验(各步均恰好完全反应):
根据流程图回答问题:
(1)、反应③的化学方程式为。(2)、根据实验现象推断该混合物中一定含有的物质是。(填化学式)。(3)、该同学为了进步确定固体混合物的组成,取样品32.8g (其中含钠元素质量为13.8g),按上述流程图进行实验,产生23.3g白色沉淀A,产生4.4g气体W。通过计算,确定该混合物中还含有的物质是(填化学式),其质量为g。29. 实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小榕同学称取了10g氢氧化钠样品放入烧杯中,加入40g水完全溶解,将150g稀盐酸平均分6份依次加入烧杯中(烧杯质量为50g)。每次充分反应后都用电子天平进行称量(假设产生的气体完全逸出),实验数据如表所示。如图所示为产生气体的质量与加入稀盐酸溶液质量的关系。
实验次数
1
2
3
4
5
6
加入稀盐酸的质量(g)
25
25
25
25
25
25
电子天平的示数(g)
125
150
175
199.7
M
248.9
(1)、当稀盐酸加入100g时,溶液中含有的溶质为。(2)、分析表格数据和图像,判断表中M的值为。(3)、第5次加入盐酸后产生CO2的总质量是g。(4)、计算氢氧化钠样品中Na2CO3的质量分数。30. 举重前运动员常常会抓一把“镁粉”在手里搓,以起到防滑效果。某种“镁粉”中只含有MgO、Mg(OH)2、MgCO3中的一种或几种固体。某兴趣小组对其成分展开了探究:分别取4.2克MgO、Mg(OH)2、MgCO3和“镁粉”置于烧杯中,逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。四种固体消耗稀盐酸的质量如表所示,且烧杯③和烧杯④中产生了大量气泡。请结合实验现象和数据回答问题。
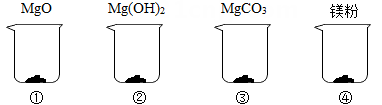
物质
MgO
Mg(OH)2
MgCO3
“镁粉”
消耗稀盐酸的质量/克
121.8
m
58.0
61.9
(1)、烧杯③中产生的气体是。(2)、“镁粉”中不只含有MgCO3一种物质,理由是。(3)、表格中m的值为多少?(请写出计算过程)(4)、为确定“镁粉”的具体成分,兴趣小组补充了如下实验:取“镁粉”和MgCO3各4.2克,加入足量稀盐酸,生成相同条件下的气体体积分别为952毫升和1120毫升。由此可知该种“镁粉”的成分是。