浙江省宁波市北仑区2022-2023学年九年级上学期科学期中考试试卷
试卷更新日期:2022-12-01 类型:期中考试
一、选择题(本题共15小题,1—10小题,每题4分,11—15小题,每题3分,共55分。请选出每小题中一个符合题意的选项,不选、选错均不给分)
-
1. 实验操作已是中考的一部分,具有规范的实验操作是同学们学好科学的必备前提,下列操作正确的是( )A、
 B、
B、 C、
C、 D、
D、 2. 下列物质名称、俗称、化学式不能表示同一物质的是( )A、氧化铁、铁锈、Fe3O4 B、氢氧化钠、烧碱、NaOH C、氢氧化钙、消石灰、Ca(OH)2 D、氧化钙、生石灰、CaO3. 庆祝建军90周年时我国在内蒙古朱日举行了大阅兵。期间特别瞩目的歼20战斗机的机身使用了钛合金等多种特殊材料。关于金属“钛”,下列说法错误的是( )A、钛合金是金属钛和其他金属(或非金属)经高温熔合而成的物质,是一种化合物 B、钛合金能承受剧烈的温差考验,可适应战斗机机在不同温度大气层高速飞行 C、金属钛密度低于铁、铜等金属,可减少战斗机的自重 D、已知金属钛的化学性质类似于金属铝,可推理得钛在空气中耐腐蚀4. 2005年2月18日,英国食品标准局向英国民众发出警告,公布了359种含有可能致癌的“苏丹红一号(Cl6H12N2O)”色素的食品清单.下列关于苏丹红一号的说法正确的是( )A、 它由16个碳元素.12个氢元素.2个氮元素和1个氧元素组成 B、它不是一种氧化物 C、组成元素中碳.氢.氮.氧的质量比为16:12:2:1 D、每个苏丹红一号分子由30个原子构成5. 下列各组物质,能在无色溶液中大量共存的是( )A、NaOH、HNO3、CaCl2 B、Ba(NO3)2、H2SO4、KNO3 C、K2SO4、CuCl2、HCl D、NaCl、K2CO3、KOH6. 用一种试剂分别滴入Ba(NO3)2、AgNO3、K2CO3三种溶液,能观察到三种不同现象的试剂是( )A、硫酸钾 B、盐酸 C、氢氧化钠 D、氯化钠7. 如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球体积的影响)。则滴管和烧瓶中所用试剂可能是( )
2. 下列物质名称、俗称、化学式不能表示同一物质的是( )A、氧化铁、铁锈、Fe3O4 B、氢氧化钠、烧碱、NaOH C、氢氧化钙、消石灰、Ca(OH)2 D、氧化钙、生石灰、CaO3. 庆祝建军90周年时我国在内蒙古朱日举行了大阅兵。期间特别瞩目的歼20战斗机的机身使用了钛合金等多种特殊材料。关于金属“钛”,下列说法错误的是( )A、钛合金是金属钛和其他金属(或非金属)经高温熔合而成的物质,是一种化合物 B、钛合金能承受剧烈的温差考验,可适应战斗机机在不同温度大气层高速飞行 C、金属钛密度低于铁、铜等金属,可减少战斗机的自重 D、已知金属钛的化学性质类似于金属铝,可推理得钛在空气中耐腐蚀4. 2005年2月18日,英国食品标准局向英国民众发出警告,公布了359种含有可能致癌的“苏丹红一号(Cl6H12N2O)”色素的食品清单.下列关于苏丹红一号的说法正确的是( )A、 它由16个碳元素.12个氢元素.2个氮元素和1个氧元素组成 B、它不是一种氧化物 C、组成元素中碳.氢.氮.氧的质量比为16:12:2:1 D、每个苏丹红一号分子由30个原子构成5. 下列各组物质,能在无色溶液中大量共存的是( )A、NaOH、HNO3、CaCl2 B、Ba(NO3)2、H2SO4、KNO3 C、K2SO4、CuCl2、HCl D、NaCl、K2CO3、KOH6. 用一种试剂分别滴入Ba(NO3)2、AgNO3、K2CO3三种溶液,能观察到三种不同现象的试剂是( )A、硫酸钾 B、盐酸 C、氢氧化钠 D、氯化钠7. 如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球体积的影响)。则滴管和烧瓶中所用试剂可能是( )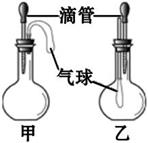
甲
乙
A.
稀硫酸和铜片
水和硝酸铵固体
B.
水和氢氧化钠固体
AgNO3溶液和稀盐酸
C.
双氧水和MnO2
NaOH溶液和CO2
D.
Na2CO3溶液和稀硫酸
水和浓硫酸
A、A B、B C、C D、D8. 在催化剂作用下,二氧化碳能高效转化为甲醇(CH3OH),相关反应如下图所示,其中“ ”、“
”、“  ”、“
”、“  ”表示不同的原子。下列说法错误的是( )
”表示不同的原子。下列说法错误的是( )  A、该反应的四种物质中有两种氧化物 B、该反应前后氢元素的化合价改变 C、该反应的催化剂在反应前后化学性质不改变 D、参加反应的乙和生成的丙的质量比为1∶169. 下列根据实验目的所设计的实验方案中,正确的是( )
A、该反应的四种物质中有两种氧化物 B、该反应前后氢元素的化合价改变 C、该反应的催化剂在反应前后化学性质不改变 D、参加反应的乙和生成的丙的质量比为1∶169. 下列根据实验目的所设计的实验方案中,正确的是( )选项
实验目的
实验方案
A
除去稀硫酸中的FeSO4
加入适量锌粉
B
除去CO2中的CO
将气体通入NaOH溶液
C
除去CaCl2溶液中的HCl
加过量CaCO3 , 过滤
D
除去铝粉中的铜粉
加适量稀硫酸,过滤
A、A B、B C、C D、D10. 小丁同学认为氢氧化钠溶液与稀硫酸混合没有明显现象,于是他想借助下列溶液或试纸来验证反应是否真的发生,你觉得不可行的是( )A、无色酚酞试液 B、FeCl3 溶液 C、BaCl2 溶液 D、pH试纸11. 在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图,下列说法中正确的是( ) A、该反应为化合反应 B、丙一定为该反应的催化剂 C、反应掉的乙和生成的丁的质量比为3∶2 D、丁的相对分子质量是甲的2倍12. 现有1.6g某物质在氧气中完全燃烧生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列推断:①一定含有C、H;②一定不含O ③可能含有O ④一定含有O ⑤分子中C、H的原子个数比为1:2 ⑥分子中C、H的原子个数比为1:4( )A、①②⑥ B、①②⑤ C、①③⑥ D、①④⑤13. 现有含杂质的硝酸钠溶液,为确定其组成设计了如下实验。下列判断正确的是( )
A、该反应为化合反应 B、丙一定为该反应的催化剂 C、反应掉的乙和生成的丁的质量比为3∶2 D、丁的相对分子质量是甲的2倍12. 现有1.6g某物质在氧气中完全燃烧生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列推断:①一定含有C、H;②一定不含O ③可能含有O ④一定含有O ⑤分子中C、H的原子个数比为1:2 ⑥分子中C、H的原子个数比为1:4( )A、①②⑥ B、①②⑤ C、①③⑥ D、①④⑤13. 现有含杂质的硝酸钠溶液,为确定其组成设计了如下实验。下列判断正确的是( ) A、无色溶液B的溶质只有硝酸钙 B、白色沉淀A中有2种沉淀 C、该实验中涉及的基本反应类型不止一种 D、原溶液中杂质可能由氯化钙、硝酸钙、氯化钠组成14. 将等质量的CaCO3(块状)和Na2CO3(粉末),分别浸入一定量10%盐酸和10%硫酸溶液中,产生CO2的质量随时间变化曲线如图所示,则反应结束后( )
A、无色溶液B的溶质只有硝酸钙 B、白色沉淀A中有2种沉淀 C、该实验中涉及的基本反应类型不止一种 D、原溶液中杂质可能由氯化钙、硝酸钙、氯化钠组成14. 将等质量的CaCO3(块状)和Na2CO3(粉末),分别浸入一定量10%盐酸和10%硫酸溶液中,产生CO2的质量随时间变化曲线如图所示,则反应结束后( ) A、CaCO3一定没有剩余 B、消耗的HCl与H2SO4质量之比为73:98 C、消耗的CaCO3与Na2CO3质量之比为1:1 D、反应产生水的质量不相等15. 往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为 m 的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中错误的是( )
A、CaCO3一定没有剩余 B、消耗的HCl与H2SO4质量之比为73:98 C、消耗的CaCO3与Na2CO3质量之比为1:1 D、反应产生水的质量不相等15. 往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为 m 的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中错误的是( )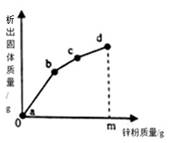 A、bc 段(不含两端点)析出的金属是 Cu B、ab 段(不含两端点)对应溶液中含有四种金属阳离子 C、线段 bc 和 cd 相比,会略“陡”一些,但不一定会更长 D、若 bc 段和 cd 段中析出固体质量相等,参加反应的锌粉质量分别为 m1 和 m2 , 则 m1>m2
A、bc 段(不含两端点)析出的金属是 Cu B、ab 段(不含两端点)对应溶液中含有四种金属阳离子 C、线段 bc 和 cd 相比,会略“陡”一些,但不一定会更长 D、若 bc 段和 cd 段中析出固体质量相等,参加反应的锌粉质量分别为 m1 和 m2 , 则 m1>m2二、填空题(本题共7小题,每空2分,共36分)
-
16. 按要求,从A.烧碱.B.盐酸.C.熟石灰.D.大理石.E.硫酸中选出适当的物质,填入相应的横线上(用化学式表示)(1)、少量存在于人的胃液中,能帮助消化的是(2)、可用于砌砖,抹墙和改良土壤酸性的是(3)、可用作某些气体的干燥剂,具有强烈的腐蚀性的固体17. 2020年6月23日9时43分,我国长征三号乙运载火箭北斗系统第55颗导航卫星成功送入预定轨道,标志着我国北斗卫星导航系统正式建成。长征三号乙运载火箭是一种三级大型液体捆绑式运载火箭,它的第一、二级使用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作为推进剂,其反应原理为:
C2H8N2+2N2O4=2CO2+3X+4H2O,反应放出大量的热产生推力,第三级则使用效能更高的液氢和液氧作为推进剂。请根据以上信息回答下列问题:
(1)、四氧化二氮中氮元素的化合价为 , 物质X的化学式为(2)、火箭第三级中发生反应的化学方程式为 。18. 根据如图所示装置,回答有关问题: (1)、装置B中,仪器X的名称为;(2)、实验室用大理石和稀盐酸来制取二氧化碳,则选取的发生装置为(填字母序号);(3)、若用装置C收集氧气,则氧气应从(填“m”或“n”)端导管口通入。19. 下图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。
(1)、装置B中,仪器X的名称为;(2)、实验室用大理石和稀盐酸来制取二氧化碳,则选取的发生装置为(填字母序号);(3)、若用装置C收集氧气,则氧气应从(填“m”或“n”)端导管口通入。19. 下图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。 (1)、氢氧化钠和盐酸恰好完全反应时,溶液的pH7(填“大于”或“小于”或“等于”)。(2)、根据曲线判断,该反应是将溶液(填“氢氧化钠”或“盐酸”)滴入另一种溶液中。(3)、当滴入溶液的体积为20mL时,若在此溶液中滴入石蕊试液,溶液显色。20. 如图,某固体氧化物X,经过如图①②两步反应后,得到红色固体单质C,溶液B只含一种溶质,且是盐,试回答:
(1)、氢氧化钠和盐酸恰好完全反应时,溶液的pH7(填“大于”或“小于”或“等于”)。(2)、根据曲线判断,该反应是将溶液(填“氢氧化钠”或“盐酸”)滴入另一种溶液中。(3)、当滴入溶液的体积为20mL时,若在此溶液中滴入石蕊试液,溶液显色。20. 如图,某固体氧化物X,经过如图①②两步反应后,得到红色固体单质C,溶液B只含一种溶质,且是盐,试回答: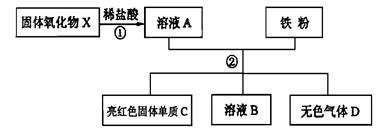 (1)、固体氧化物X的化学式是(2)、第①步加的盐酸是否过量?(填“是”或“否”)(3)、图示过程中,总共发生了几个化学反应21. 化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如表(微溶物视为可溶物):
(1)、固体氧化物X的化学式是(2)、第①步加的盐酸是否过量?(填“是”或“否”)(3)、图示过程中,总共发生了几个化学反应21. 化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如表(微溶物视为可溶物):实验
A+B
A+C
A+D
B+C
现象
产生气体
产生沉淀
产生沉淀
产生沉淀
(1)、写出溶液A与D反应的化学方程式:(2)、我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理如下:NaCl+H2O+nh3+CO2=NaHCO3↓+X;2NaHCO3Na2CO3+H2O+CO2↑等。则
①X的化学式为
②将碳酸钠和碳酸氢钠的混合物10g充分加热至质量不再改变,冷却,称量剩余固体质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为(写最简比)。
三、实验探究题(本题共4小题,每空3分,共36分)
-
22. 在制作“叶脉书签”中,需用到10%的氢氧化钠溶液。现配制80g质量分数为10%的氢氧化钠溶液。(1)、若用氢氧化钠固体配制,需称量氢氧化钠的质量为g。(2)、用氢氧化钠固体配制10%的氢氧化钠溶液过程中需要用到的仪器除了托盘天平、药匙、量筒、烧杯、胶头滴管、试剂瓶外,还需要的一个玻璃仪器是。(3)、本实验中,下列操作正确的是 ________(可多选)。A、称量氢氧化钠固体时,右盘放砝码 B、在托盘天平的左右托盘上垫滤纸称量氢氧化钠固体 C、天平平衡后的称量过程中,若指针略偏左,则可向右调节游码 D、将准确称量的氢氧化钠固体放入装有水的量筒中溶解 E、氢氧化钠固体易潮解,称量过程尽量要缩短时间23. 暑假期间,宁波某学校的科学兴趣班参观了北仑的一家大型冶炼企业。大家了解到:黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质,处理黄铜渣可得到产品之一——硫酸锌晶体(杂质不溶于水、不参与反应)。同学们又深入车间亲眼目睹了其主要生产流程,总结简化之后,如图所示。请完成以下实验记录:
 (1)、步骤Ⅰ、Ⅱ中的主要操作均为。(2)、整个实验过程中发生的化学反应,置换反应(填“全部是”、“全不是”或“不全是”)。(3)、溶液B中溶质的质量,与溶液A中的溶质质量相比(填“变大了”、“变小了”或“没有变化”)。24. 实验课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,依次开展了以下探究,请完成其中的三个空。
(1)、步骤Ⅰ、Ⅱ中的主要操作均为。(2)、整个实验过程中发生的化学反应,置换反应(填“全部是”、“全不是”或“不全是”)。(3)、溶液B中溶质的质量,与溶液A中的溶质质量相比(填“变大了”、“变小了”或“没有变化”)。24. 实验课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,依次开展了以下探究,请完成其中的三个空。[提出问题 1] 该氢氧化钠溶液是否变质了呢?
[实验探究 1]
实验操作
实验现象
实验结论
取少量该溶液于试管中,向溶液中滴加足量的稀盐酸,并不断振荡
氢氧化钠溶液一定变质了。
[提出问题 2] 该氢氧化钠溶液是全部变质还是部分变质呢?
[猜想与假设]
猜想 1:氢氧化钠溶液部分变质。猜想 2:氢氧化钠溶液全部变质。
[实验探究 2]
实验步骤
实验现象
实验结论
⑴取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡。
有白色沉淀生成。
说明原溶液中一定有碳酸钠。
⑵取步骤(1)试管中的少量上层清液,滴加酚酞溶液。
溶液变红色。
说明原溶液中一定有。
[实验结论]该氢氧化钠溶液部分变质。猜想 2 正确。
[思考与讨论]有同学认为,探究 1 已经证明了碳酸钠的存在,所以实验探究 2 中的实验步骤(1)是多余,只要如实验步骤(2),样品溶于水后,直接滴入酚酞即可的。该同学的看法是否正确?为什么?。
25. 大理石中含少量硫化物,使制得的CO2中混有H2S气体。欲获取纯净、干燥的CO2 , 需对发生装置中产生的气体进行除杂,实验装置如下:
查阅资料:I.H2S能与NaOH等碱溶液、CuSO4溶液反应。
Ⅱ.CO2中混有的HCl气体可用饱和NaHCO3溶液吸收。
(1)、图1装置甲中所盛试剂应选用________(填字母)。A、浓硫酸 B、NaOH溶液 C、澄清石灰水 D、CuSO4溶液(2)、图1装置丙的作用是。(3)、二氧化碳气体的收集装置可以选用图2中的。四、解答题(本题共7小题,第26、27、28、29、30、31小题各6分,第32小题7分,共43分)
-
26. 芯片是所有电脑、“智能家电”的核心部件,它是以高纯度的单质硅(硅的元素符号为Si)为材料制成的。用化学方法制得高纯硅的反应原理为:
①SiO2+2C Si+2CO↑ ②Si+2Cl2 SiCl4 ③SiCl4+2H2 Si+4HCl
(1)、上述反应中基本反应类型有种;(2)、在物质类别中,SiO2属于 , 其中的硅元素的化合价为。27. 浓硫酸具有脱水性,可理解为:能把小木棍、蔗糖等中的氢元素和氧元素“脱出”结合生成水。(1)、用小木棍蘸取浓硫酸少许,一段时间后,小木棍上出现的实验现象是。(2)、在蔗糖(Cl2H22O11)分子中,氢、氧原子个数比是。如果蔗糖完全脱水,则生成C和H2O的质量比是。28. 有2.3 g某物质在纯氧中完全燃烧,只生成4.4 g二氧化碳和2.7 g水,(1)、该过程消耗氧气的质量为g(2)、则该物质中一定含有元素 (填元素符号),它们的元素质量比为。29. 化学实验小组同学为研究某公共场所铁制护栏锈蚀的程度,将12.8g已生锈的铁片,放入一定浓度的稀盐酸中充分反应,测得产生的气体质量与加入的稀盐酸的质量关系如下图所示(假设铁片除有Fe2O3外,不含其他杂质)。求: (1)、所用稀盐酸溶液的溶质的质量分数。(2)、该铁片中Fe2O3的质量分数。30. 图甲是实验室常见的制取并检验CO2的装置,图乙是对图甲实验装置进行“微型”化改进后的装置。
(1)、所用稀盐酸溶液的溶质的质量分数。(2)、该铁片中Fe2O3的质量分数。30. 图甲是实验室常见的制取并检验CO2的装置,图乙是对图甲实验装置进行“微型”化改进后的装置。
 (1)、图乙中微型塑料滴管在实验中的作用与图甲中的仪器相同(填仪器名称)。(2)、某学校化学兴趣小组的同学对甲中反应后的废液进行溶质成分的鉴定.取废液上层清液50克,逐滴加入质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克时开始出现白色沉淀,继续滴加至沉淀不再产生,对沉淀进行对应处理后,测得沉淀的质量为5克,并绘制了图象丙。则分析可得废液中含有的溶质有(写化学式)。(3)、根据第(2)小题中的数据和丙图,通过计算说明a、b的数值分别为多少。31. 实验室有一变质的氢氧化钠样品(样品中只有一种杂质,且成分均匀),为测量样品中NaOH 的质量分数,小明进行了如下实验。
(1)、图乙中微型塑料滴管在实验中的作用与图甲中的仪器相同(填仪器名称)。(2)、某学校化学兴趣小组的同学对甲中反应后的废液进行溶质成分的鉴定.取废液上层清液50克,逐滴加入质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克时开始出现白色沉淀,继续滴加至沉淀不再产生,对沉淀进行对应处理后,测得沉淀的质量为5克,并绘制了图象丙。则分析可得废液中含有的溶质有(写化学式)。(3)、根据第(2)小题中的数据和丙图,通过计算说明a、b的数值分别为多少。31. 实验室有一变质的氢氧化钠样品(样品中只有一种杂质,且成分均匀),为测量样品中NaOH 的质量分数,小明进行了如下实验。①取质量、大小相同的 3 个烧杯,分别加入一定质量分数的稀盐酸 100 克;
②向上述 3 个烧杯中分别加入 3 份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。实验数据记录如下:
实验一
实验二
实验三
反应前稀盐酸+烧杯质量(克)
150
150
150
反应前固体样品质量(克)
4
8
12
反应后烧杯内物质+烧杯质量(克)
m
155.8
158.7
(1)、表中的 m 值为。(2)、根据实验数据计算样品中 NaOH 的质量分数。(3)、若要计算、确定所用的 100 克的稀盐酸的溶质质量分数,表格中的三次实验数据是否足够?(填“是”或“否”)32. 将铜粉和铁粉的混合物10克放入烧杯中, 向烧杯中不断缓慢加入质量分数为20%的FeCl3溶液,测得烧杯中剩余固体的质量与加入FeCl3溶液质量的关系如图所示。
【小资料】铁和铜都能与FeCl3溶液发生反应,反应的先后顺序取决于金属的活动性顺序,金属的活动性越强,反应越优先,反应的化学方程式分别为:
①Fe+2FeCl3=3FeCl2;
②Cu+2FeCl3=2FeCl2+CuCl2
(1)、图中线段MN代表与FeCl3溶液反应的过程。(2)、计算m的值(要求写出计算过程)。(3)、如果往此金属混合物中加入的FeCl3溶液的质量分数增大,则剩余固体的质量与加入溶液的质量关系图将会发生变化,请在原图中大致画出。