浙江省舟山市定海区四校联考2022-2023学年九年级上学期科学期中考试试卷
试卷更新日期:2022-11-29 类型:期中考试
一、选择题(本题有15小题,第1-10题,每小题3分,11-15每小题4分,共50分。请选出一个符合题意的正确选项,不选、多选、错选,均不给分)
-
1. 我们身边的高层建筑越来越多,同时高空抛物也存在巨大的安全隐患,2021 年 3 月 1 日起 高空抛物入刑法,因为高处下落的物体具有较大的( )A、弹性势能 B、重力势能 C、体积 D、阻力2. 下列实验操作符合规范要求的是( )A、闻气体气味
 B、测溶液pH
B、测溶液pH C、稀释浓H2SO4
C、稀释浓H2SO4 D、取用固体粉末
D、取用固体粉末 3. 3月22日,世界上第一颗使用磁系统收集大空垃圾的卫星发射升空。太空垃圾碎片中,不能与稀盐酸发生反应的材料是( )A、铜 B、锌 C、铝 D、镁4. “测土配方施肥”技术能有效解决施肥比例不合理的问题,如下为农技人员通过该技术对某农田开出的施肥配方,有NH4H2PO4、K2SO4、KCl、NH4NO3等肥料。其中属于复合肥料的是( )A、NH4H2PO4 B、K2SO4 C、KCl D、NH4NO35. 在“欢迎来找茬”的趣味活动中,老师举出四个错误实例,在学生的错因分析中错误的是( )
3. 3月22日,世界上第一颗使用磁系统收集大空垃圾的卫星发射升空。太空垃圾碎片中,不能与稀盐酸发生反应的材料是( )A、铜 B、锌 C、铝 D、镁4. “测土配方施肥”技术能有效解决施肥比例不合理的问题,如下为农技人员通过该技术对某农田开出的施肥配方,有NH4H2PO4、K2SO4、KCl、NH4NO3等肥料。其中属于复合肥料的是( )A、NH4H2PO4 B、K2SO4 C、KCl D、NH4NO35. 在“欢迎来找茬”的趣味活动中,老师举出四个错误实例,在学生的错因分析中错误的是( )序号
错误实例
错因分析
A
铁与稀硫酸反应生成硫酸铁
反应产物不正确
B
SO2+NaOH=Na2SO4+H2O
只缺少沉淀符号
C
Fe+S=FeS
反应条件不正确
D
氢氧化钠俗名烧碱或纯碱
俗名纯碱不正确
A、A B、B C、C D、D6. 下列烧杯中盛装的溶液属于酸溶液的是( )A、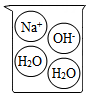 B、
B、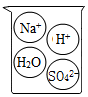 C、
C、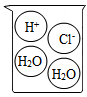 D、
D、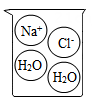 7. 现有下列试剂:①石灰水;②食醋③食盐水④纯碱溶液 ⑤烧碱溶液。其中验证贝壳的主要成分为碳酸盐的必须要用到的是( )A、①② B、②⑤ C、②④ D、①③8. XSO4可溶于水,金属x在金属活动顺序表中的位置如图所示。则下列化学方程式错误的是( )
7. 现有下列试剂:①石灰水;②食醋③食盐水④纯碱溶液 ⑤烧碱溶液。其中验证贝壳的主要成分为碳酸盐的必须要用到的是( )A、①② B、②⑤ C、②④ D、①③8. XSO4可溶于水,金属x在金属活动顺序表中的位置如图所示。则下列化学方程式错误的是( ) A、X+H2SO4=XSO4+H2↑ B、Mg+XSO4=MgSO4+X C、Fe+XSO4=FeSO4+X D、X+CuSO4=XSO4+Cu9. 用“
A、X+H2SO4=XSO4+H2↑ B、Mg+XSO4=MgSO4+X C、Fe+XSO4=FeSO4+X D、X+CuSO4=XSO4+Cu9. 用“ ”和“
”和“ ”表示不同元素的原子,下列微观示意图能表示化合物的是( ) A、
”表示不同元素的原子,下列微观示意图能表示化合物的是( ) A、 B、
B、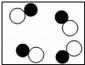 C、
C、 D、
D、 10. 某同学在学习了金属及其化合物之间的转化规律后,给制了可以通过一步反应制取MgSO4的思维导图,其中所选用的物质错误的是( )
10. 某同学在学习了金属及其化合物之间的转化规律后,给制了可以通过一步反应制取MgSO4的思维导图,其中所选用的物质错误的是( )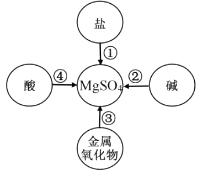 A、①—Mg B、②—MgCl2 C、③—H2SO4 D、④—Mg(OH)211. 如图所示,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列说法错误的是( )
A、①—Mg B、②—MgCl2 C、③—H2SO4 D、④—Mg(OH)211. 如图所示,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列说法错误的是( ) A、反应条件都需要加热 B、通过气体之前,都需要检验纯度 C、制铜时,实际消耗的CO、H2都比理论消耗的要多 D、实验中氢气和一氧化碳具有氧化性12. 推理是一种重要的思维方法,以下推理合理的是( )A、氧化物中一定含有氧元素,所以含有氧元素的物质一定是氧化物 B、置换反应有单只生成,所以有单质生成的反应一定是置换反应 C、酸碱反应生成盐和水,所以生成盐和水的反应都是酸碱反应 D、酸性溶液能使石蕊变红,所以能使石蕊变红的溶液都是酸性溶液13. 下列图象能正确反映其对应关系的是( )
A、反应条件都需要加热 B、通过气体之前,都需要检验纯度 C、制铜时,实际消耗的CO、H2都比理论消耗的要多 D、实验中氢气和一氧化碳具有氧化性12. 推理是一种重要的思维方法,以下推理合理的是( )A、氧化物中一定含有氧元素,所以含有氧元素的物质一定是氧化物 B、置换反应有单只生成,所以有单质生成的反应一定是置换反应 C、酸碱反应生成盐和水,所以生成盐和水的反应都是酸碱反应 D、酸性溶液能使石蕊变红,所以能使石蕊变红的溶液都是酸性溶液13. 下列图象能正确反映其对应关系的是( )
 A、图①:向一定量的石灰石中加入过量的稀盐酸. B、图②:探究重力势能大小与物体高度之间的关系 C、图③:浓盐酸盛于烧杯中,敞口放置后则其质量和放置天数的关系 D、图④:向等质量的锌和铁中加入同种等浓度稀盐酸至过量14. 稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,下列操作及实验现象(或结果),不能证明反应发生的是( )
A、图①:向一定量的石灰石中加入过量的稀盐酸. B、图②:探究重力势能大小与物体高度之间的关系 C、图③:浓盐酸盛于烧杯中,敞口放置后则其质量和放置天数的关系 D、图④:向等质量的锌和铁中加入同种等浓度稀盐酸至过量14. 稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,下列操作及实验现象(或结果),不能证明反应发生的是( ) A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH=715. 某同学为研究相同条件下一氧化碳和氢气哪个还原氧化铁的量更多,将一氧化碳和氢气等体积混合后先通过图甲装置,再通过图乙中的仪器组合。为达到实验目的,图乙中仪器选择和连接最好的是( )
A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH=715. 某同学为研究相同条件下一氧化碳和氢气哪个还原氧化铁的量更多,将一氧化碳和氢气等体积混合后先通过图甲装置,再通过图乙中的仪器组合。为达到实验目的,图乙中仪器选择和连接最好的是( )
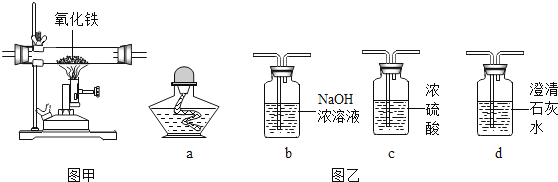 A、cba B、cda C、cbd D、bca
A、cba B、cda C、cbd D、bca二、填空题(本题有8小题,20空,每空2分,共40分)
-
16. 图中这是一款世界首款飞行汽车-Transition,它拥有两个座位、四个轮子和能够折叠的翅膀,使用汽油为燃料,既能像轿车一样在公路上行驶,又能像直升飞机一样实现起降、悬停、飞行。
 (1)、当飞行汽车从地面上加速上升时,其机械能(填“增大”、“不变”或“减小”)。(2)、这种飞行汽车行驶、飞行所需的能量来自汽油,这种储存在汽油里的能量形式是。17. 如图为U盘的外观和内部结构示意图。
(1)、当飞行汽车从地面上加速上升时,其机械能(填“增大”、“不变”或“减小”)。(2)、这种飞行汽车行驶、飞行所需的能量来自汽油,这种储存在汽油里的能量形式是。17. 如图为U盘的外观和内部结构示意图。 (1)、图中含有的金属材料是(填1种)。(2)、将铜加工成铜箔基板利用的铜的性质是。18. 丽水纳爱斯集团是全球洗涤用品行业前五强企业。其产品之一雕牌超能皂(如图)的主要生产原料是油脂、氢氧化钠和水等。(1)、生产肥皂的主要反应原理: , 则X的化学式为。(2)、该皂液中所含的氢氧化钠常能与氯化铜溶液反应产生沉淀,请写出相关的一个化学方程式:。(3)、如果想要检测该皂液的酸碱性强弱,可以使用pH试纸,请你写出合理的操作过程:19. 某实验小组有一份混合溶液,其主要含食盐,还有少量的碳酸钠杂质,他们为了检验并得到纯净的氯化钠进行了方案设计,请你完成下列问题:(1)、检验环节:同学A在该混合溶液中滴加足量的盐酸,若有则说明溶液中含碳酸钠;(2)、除杂环节:同学B在该混合溶液中需加入适量的物质(要求物质类别属于盐),过滤后得到的溶液进行蒸发等操作,得到纯净的氯化钠。20. 乙醇俗称酒精,化学式为C2H6O,可用作医用消毒,也常作燃料。乙醇属于(填“有机物”或“无机物”),其完全燃烧的化学方程式可表示为:。21. 将稀硫酸逐滴加入到滴有酚酞试液的氢氧化钠溶液中,直至过量。如图是实验操作和反应的微观示意图,请回答下列问题:
(1)、图中含有的金属材料是(填1种)。(2)、将铜加工成铜箔基板利用的铜的性质是。18. 丽水纳爱斯集团是全球洗涤用品行业前五强企业。其产品之一雕牌超能皂(如图)的主要生产原料是油脂、氢氧化钠和水等。(1)、生产肥皂的主要反应原理: , 则X的化学式为。(2)、该皂液中所含的氢氧化钠常能与氯化铜溶液反应产生沉淀,请写出相关的一个化学方程式:。(3)、如果想要检测该皂液的酸碱性强弱,可以使用pH试纸,请你写出合理的操作过程:19. 某实验小组有一份混合溶液,其主要含食盐,还有少量的碳酸钠杂质,他们为了检验并得到纯净的氯化钠进行了方案设计,请你完成下列问题:(1)、检验环节:同学A在该混合溶液中滴加足量的盐酸,若有则说明溶液中含碳酸钠;(2)、除杂环节:同学B在该混合溶液中需加入适量的物质(要求物质类别属于盐),过滤后得到的溶液进行蒸发等操作,得到纯净的氯化钠。20. 乙醇俗称酒精,化学式为C2H6O,可用作医用消毒,也常作燃料。乙醇属于(填“有机物”或“无机物”),其完全燃烧的化学方程式可表示为:。21. 将稀硫酸逐滴加入到滴有酚酞试液的氢氧化钠溶液中,直至过量。如图是实验操作和反应的微观示意图,请回答下列问题: (1)、图中甲表示的微粒是(填符号)。(2)、为验证反应后的溶液中含有稀硫酸,可行的操作是 。A、取样,滴加少量紫色石蕊试液 B、取样,滴加少量CuSO4溶液 C、取样,加入少量Na2CO3粉末 D、取样,滴加少量Ba(NO3)2溶液22. 小科设计了一个“物语”信封,信封上五个点代表不同的化学物质,“——”表示两只物质之间可以相互反应。已知A˜E分别是铁、氢氧化钙、盐酸、碳酸钠、硫酸铜中的一种。E的溶液呈蓝色,A、B反应能产生气泡。
(1)、图中甲表示的微粒是(填符号)。(2)、为验证反应后的溶液中含有稀硫酸,可行的操作是 。A、取样,滴加少量紫色石蕊试液 B、取样,滴加少量CuSO4溶液 C、取样,加入少量Na2CO3粉末 D、取样,滴加少量Ba(NO3)2溶液22. 小科设计了一个“物语”信封,信封上五个点代表不同的化学物质,“——”表示两只物质之间可以相互反应。已知A˜E分别是铁、氢氧化钙、盐酸、碳酸钠、硫酸铜中的一种。E的溶液呈蓝色,A、B反应能产生气泡。
 (1)、E物质的化学式为(2)、写出A与C反应的化学方程式;
(1)、E物质的化学式为(2)、写出A与C反应的化学方程式;该反应的基本类型属于。
23. 某气体可能由CO、H2、水蒸气中的一种或几种组成。小科利用下图的装置探究其成分,已知无水硫酸铜遇水会变蓝色。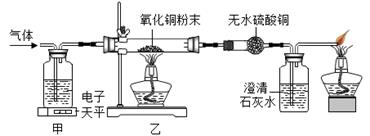 (1)、甲装置中盛放的液体是。(2)、实验过程中观察到无水硫酸铜不变色,澄清石灰水变浑浊,则原气体中一定含有(填化学式),同时乙装置中黑色固体变色。(3)、 俗称熟石灰,请你举例其在工农业上的一种用途。
(1)、甲装置中盛放的液体是。(2)、实验过程中观察到无水硫酸铜不变色,澄清石灰水变浑浊,则原气体中一定含有(填化学式),同时乙装置中黑色固体变色。(3)、 俗称熟石灰,请你举例其在工农业上的一种用途。三、实验探究题(本题有5小题,15空格,第24-25题,每空2分,第26-28题,每空3分,共40分)
-
24. 全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一。下面是对铁的腐蚀条件的探究。(H2O2溶液在MnO2催化下分解产生氧气。)
铁生锈所需要时间较长,某实验小组的同学设计如图所示实验。
 (1)、检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接入到装有水的烧杯中,微热甲装置,说明气密性良好的现象是。(2)、4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮,该实验说明铁生锈主要与有关。25. 为研究动能大小的影响因素有哪些,小明进行了如下实验:
(1)、检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接入到装有水的烧杯中,微热甲装置,说明气密性良好的现象是。(2)、4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮,该实验说明铁生锈主要与有关。25. 为研究动能大小的影响因素有哪些,小明进行了如下实验:
I 取一根塑料管,沿中间轴均匀地切成两个半凹型的塑料管;
II 将两根半凹型的塑料管连接起来,如图所示;
III 塑料管外壁标上刻度;
IV 将一颗钢珠从管口静止释放,观察并记录钢珠推动木块的距离。
(1)、实验中是通过来判断钢珠的动能大小。(2)、用半凹型的塑料管代替书本上的斜面进行实验,其好处是(3)、小明用不同质量的小球在斜面上不同高度下滑,并记录木块移动距离,数据如下表:组别
1
2
3
4
5
小球质量/克
2
5
5
5
20
小球下滑高度/厘米
10
10
20
30
5
木块移动距离/厘米
4
10
20
30
?
根据表中数据,推测第5组时,纸盒移动的距离应为厘米。
26. 氢氧化钠溶液和二氧化碳反应没有明显现象,为验证CO2与NaOH能够发生反应,某同学按下图组装实验装置,并进行实验。 (1)、药品滴加顺序往往会影响实验现象,该实验加入试剂的顺序应该是 (填序号)A、先加入盐酸,再加入氢氧化钠溶液 B、先加入氢氧化钠溶液,再加入盐酸(2)、气球发生的变化是。(3)、若该实验不用盐酸而只用氢氧化钠溶液,是否能证明二氧化碳和氢氧化钠溶液发生了反应,并说明理由:27. 小科需要设计了一个验证某NaCl溶液中是否混有Na2CO3、NaOH、Na2SO4的实验流程。
(1)、药品滴加顺序往往会影响实验现象,该实验加入试剂的顺序应该是 (填序号)A、先加入盐酸,再加入氢氧化钠溶液 B、先加入氢氧化钠溶液,再加入盐酸(2)、气球发生的变化是。(3)、若该实验不用盐酸而只用氢氧化钠溶液,是否能证明二氧化碳和氢氧化钠溶液发生了反应,并说明理由:27. 小科需要设计了一个验证某NaCl溶液中是否混有Na2CO3、NaOH、Na2SO4的实验流程。
 (1)、小科先在试管A中滴加适量的酚酞,发现溶液呈红色,他认为该溶液A中含有NaOH,这种说法是否正确,说明理由(2)、然后B溶液中滴加过量的氯化钡溶液,发现溶液仍显红色,据此现象,小科即可判断原溶液中一定含有。其中BaCl2溶液滴加过量的原因是.(3)、再向反应后的C溶液中加入适量x溶液,即可完成对Na2SO4和Na2CO3的验证,则x溶液可能是 (填字母序号)。A、稀HCl B、稀H2SO4 C、稀HNO3 D、CaCl228. 小黄对Ti、Mg、Cu的金属活动性顺序进行了如下探究。
(1)、小科先在试管A中滴加适量的酚酞,发现溶液呈红色,他认为该溶液A中含有NaOH,这种说法是否正确,说明理由(2)、然后B溶液中滴加过量的氯化钡溶液,发现溶液仍显红色,据此现象,小科即可判断原溶液中一定含有。其中BaCl2溶液滴加过量的原因是.(3)、再向反应后的C溶液中加入适量x溶液,即可完成对Na2SO4和Na2CO3的验证,则x溶液可能是 (填字母序号)。A、稀HCl B、稀H2SO4 C、稀HNO3 D、CaCl228. 小黄对Ti、Mg、Cu的金属活动性顺序进行了如下探究。
金属
Ti
Mg
Cu
实验现象
产生气泡速度慢
产生气泡速度快
无明显现象
(1)、取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察到现象如表。结论:Ti、Mg、Cu三种金属的活动性由强到弱的顺序为。(2)、在实验过程中,小黄又发现镁条与稀盐酸反应过程中产生气体体积与反应时间有如上图所示关系,请分析:t2~t3时间内反应速度逐渐减慢的原因是(3)、请你设计其他方案来比较这三种金属的活动性:(可供选择的药品:Ti、Mg、Cu、TiCl2溶液、MgCl2溶液、溶液)(请画出实验装置图,并注明反应物)

四、解答题(本题有6小题,第29题6分,第31、33题每小题8分,第30、34题每小题9分,第32题10分,共50分)
-
29. 有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4 , 中的一种或几种组成。为确定其成分,实验小组进行试验。实验过程中所加试剂均足量,实验过程及现象如图所示。
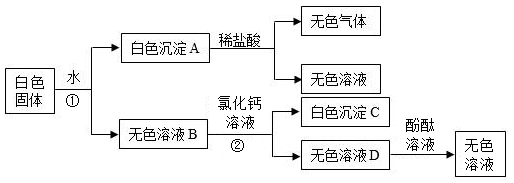 (1)、①和②的实验操作名称;(2)、无色气体产生的化学方程式是;(3)、这包白色固体中不含有的物质是。30. 为测定某赤铁矿石中氧化铁的质量分数,小乐用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的6.6g的气体用碱溶液完全吸收。回答下列问题:(1)、10g赤铁矿石样品与一氧化碳反应生成的气体是。(2)、上述气体用碱溶液吸收,选取的碱溶液可以是溶液。(3)、该赤铁矿石样品中氧化铁的质量分数?31. xx儿童咀嚼钙片的标签内容如图所示,小乐为了测定该钙片含量是否符合标注,做了如下实验(钙片中除了碳酸钙外,其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部逸出,且不考虑水蒸气的影响):
(1)、①和②的实验操作名称;(2)、无色气体产生的化学方程式是;(3)、这包白色固体中不含有的物质是。30. 为测定某赤铁矿石中氧化铁的质量分数,小乐用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的6.6g的气体用碱溶液完全吸收。回答下列问题:(1)、10g赤铁矿石样品与一氧化碳反应生成的气体是。(2)、上述气体用碱溶液吸收,选取的碱溶液可以是溶液。(3)、该赤铁矿石样品中氧化铁的质量分数?31. xx儿童咀嚼钙片的标签内容如图所示,小乐为了测定该钙片含量是否符合标注,做了如下实验(钙片中除了碳酸钙外,其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部逸出,且不考虑水蒸气的影响):
 (1)、标签中所指“补钙”,其“钙”的含义是指补钙(填“元素”或“单质”)(2)、反应中生成的二氧化碳的质量是g。(3)、请你求出20g的此钙片中所含碳酸钙的质量。32. 合金通常比纯金属具有更优良的性能,如硬度大、强度高等,为测定由锌、铜熔合而成的合金黄铜样品中铜的质量分数,先将样品粉碎,再加入足量稀硫酸充分反应。所加稀硫酸与剩余固体质量关系如图所示。
(1)、标签中所指“补钙”,其“钙”的含义是指补钙(填“元素”或“单质”)(2)、反应中生成的二氧化碳的质量是g。(3)、请你求出20g的此钙片中所含碳酸钙的质量。32. 合金通常比纯金属具有更优良的性能,如硬度大、强度高等,为测定由锌、铜熔合而成的合金黄铜样品中铜的质量分数,先将样品粉碎,再加入足量稀硫酸充分反应。所加稀硫酸与剩余固体质量关系如图所示。 (1)、黄铜属于(填“纯净物”或“混合物”);(2)、先将样品粉碎的目的(3)、样品中铜的质量分数为(4)、恰好完全反应时,所得溶液中溶质的质量分数是多少?33. 在一定量的氢氧化钠稀溶液中逐渐滴加稀盐酸,反应过程中不断搅拌并及时测量不同时刻溶液的温度与pH,记录数据如下表:
(1)、黄铜属于(填“纯净物”或“混合物”);(2)、先将样品粉碎的目的(3)、样品中铜的质量分数为(4)、恰好完全反应时,所得溶液中溶质的质量分数是多少?33. 在一定量的氢氧化钠稀溶液中逐渐滴加稀盐酸,反应过程中不断搅拌并及时测量不同时刻溶液的温度与pH,记录数据如下表:反应时间(秒)
0
25
50
75
100
125
150
175
200
滴入稀盐酸体积(毫升)
0
4
8
12
16
20
24
28
32
pH
13.2
13.0
12.7
12.4
12.1
7.0
2.0
1.6
1.3
温度(℃)
36.9
37.5
38.0
38.5
38.8
39.2
39.0
38.8
38.6
(1)、观察上表发现,当反应时间在秒时开始,溶液中氯化钠的质量不再增加。(2)、完成上述实验,能否用氢氧化钠固体代替,并请说明原因。(3)、结合上表中滴入稀盐酸体积与pH的变化数据,试计算氢氧化钠稀溶液中溶质的质量(稀HCl的密度取1.0g/mL,稀盐酸溶质质量分数为7.3%)34. 含CuCl2和HCl的150g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图。据图回答: (1)、整个反应过程中,离子个数不变。(2)、P点溶液中的溶质是。(3)、m1为多少?(要求写出具体的解题过程)
(1)、整个反应过程中,离子个数不变。(2)、P点溶液中的溶质是。(3)、m1为多少?(要求写出具体的解题过程)