浙江省嘉兴市八校联盟2021-2022学年高一上学期期中联考化学试题
试卷更新日期:2022-11-28 类型:期中考试
一、单选题
-
1. 下列物质对于的名称错误的是( )A、Na2CO3-碳酸钠 B、CuSO4-硫酸铜 C、Na2SO3-硫酸钠 D、FeCl2-氯化亚铁2. 下列物质中,属于纯净物的是( )A、氧气 B、糖水 C、食醋 D、大理石3. 配置一定物质的量浓度的溶液操作中一般不需要用到的是( )A、
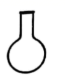 B、
B、 C、
C、 D、
D、 4. 氯气有毒,如果发生了氯气泄漏,以下自救方法得当的是( )A、向地势低的地方撤离 B、只要在室内放一盆水 C、用蘸有纯碱溶液的毛巾捂住口鼻撤离 D、用浸有NaOH溶液的毛巾捂住口鼻撤离5. 下列物质属于电解质的是( )A、Cu B、氯水 C、酒精 D、KNO3固体6. 亚硝酸(HNO2)参加反应时,既可作氧化剂,也可作还原剂.当它作还原剂时,可能生成的产物是( )A、NH3 B、N2 C、N2O3 D、HNO37. 溶液、胶体和浊液这三种分散系的最本质的区别是( )A、是否能透过滤纸 B、分散质粒子直径的大小 C、是否会产生丁达尔效应 D、是否有均一、稳定、透明的外观8. 有一个反应在密闭容器中发生,三种物质CaCO3、CaO和CO2的质量比例变化如图所示。下列有关该反应的说法正确的是( )
4. 氯气有毒,如果发生了氯气泄漏,以下自救方法得当的是( )A、向地势低的地方撤离 B、只要在室内放一盆水 C、用蘸有纯碱溶液的毛巾捂住口鼻撤离 D、用浸有NaOH溶液的毛巾捂住口鼻撤离5. 下列物质属于电解质的是( )A、Cu B、氯水 C、酒精 D、KNO3固体6. 亚硝酸(HNO2)参加反应时,既可作氧化剂,也可作还原剂.当它作还原剂时,可能生成的产物是( )A、NH3 B、N2 C、N2O3 D、HNO37. 溶液、胶体和浊液这三种分散系的最本质的区别是( )A、是否能透过滤纸 B、分散质粒子直径的大小 C、是否会产生丁达尔效应 D、是否有均一、稳定、透明的外观8. 有一个反应在密闭容器中发生,三种物质CaCO3、CaO和CO2的质量比例变化如图所示。下列有关该反应的说法正确的是( ) A、CO2是反应物 B、CaO在反应中起催化作用 C、该反应是分解反应 D、反应中CaO和CaCO3的质量比为1∶19. 常温下,下列离子在指定的溶液中能大量共存的是( )A、无色透明溶液中:Fe3+、Mg2+、、NO3- B、含有大量Ba2+的溶液中:Na+、、、 C、使酚酞试液变红的溶液中:K+、Ba2+、、Cl- D、加入镁条生成H2的溶液中:Na+、K+、CH3COO-、Cl-10. 实验室用如图装置制取、提纯、收集Cl2、尾气处理,不能达到实验目的的是( )
A、CO2是反应物 B、CaO在反应中起催化作用 C、该反应是分解反应 D、反应中CaO和CaCO3的质量比为1∶19. 常温下,下列离子在指定的溶液中能大量共存的是( )A、无色透明溶液中:Fe3+、Mg2+、、NO3- B、含有大量Ba2+的溶液中:Na+、、、 C、使酚酞试液变红的溶液中:K+、Ba2+、、Cl- D、加入镁条生成H2的溶液中:Na+、K+、CH3COO-、Cl-10. 实验室用如图装置制取、提纯、收集Cl2、尾气处理,不能达到实验目的的是( ) A、用装置甲制取Cl2 B、用装置丙收集Cl2 C、用装置丁吸收尾气中的Cl2 D、用装置乙除去Cl2中的少量HCl11. 下列说法正确的是( )A、1 mol氮含有6.02×1023个微粒 B、22 g二氧化碳含有的氧原子数约等于6.02×1023 C、钠的摩尔质量等于它的相对原子质量 D、CO2的摩尔质量是18 g12. 下列化学反应的离子方程式正确的是( )A、碳酸钙与盐酸溶液反应: B、铁钉放入稀硫酸中: C、碳酸氢钠与稀盐酸反应: D、氢氧化钡溶液与稀硫酸反应:13. 下列说法正确的是( )A、金属钠着火,可以使用水进行灭火 B、新制氯水应避光保存在广口瓶中 C、使用剩余的液体药品可以直接倒入下水道中 D、漂白粉是混合物,可用于棉、麻、纸张的漂白14. 下列选项中,陈述I、II均正确且两者之间具有因果关系的是( )
A、用装置甲制取Cl2 B、用装置丙收集Cl2 C、用装置丁吸收尾气中的Cl2 D、用装置乙除去Cl2中的少量HCl11. 下列说法正确的是( )A、1 mol氮含有6.02×1023个微粒 B、22 g二氧化碳含有的氧原子数约等于6.02×1023 C、钠的摩尔质量等于它的相对原子质量 D、CO2的摩尔质量是18 g12. 下列化学反应的离子方程式正确的是( )A、碳酸钙与盐酸溶液反应: B、铁钉放入稀硫酸中: C、碳酸氢钠与稀盐酸反应: D、氢氧化钡溶液与稀硫酸反应:13. 下列说法正确的是( )A、金属钠着火,可以使用水进行灭火 B、新制氯水应避光保存在广口瓶中 C、使用剩余的液体药品可以直接倒入下水道中 D、漂白粉是混合物,可用于棉、麻、纸张的漂白14. 下列选项中,陈述I、II均正确且两者之间具有因果关系的是( )选项
陈述I
陈述II
A.
小苏打可用于治疗胃酸过多
NaHCO3受热易分解
B.
Na2O2可作潜水艇的供氧剂
Na2O2能和CO2、H2O反应生成O2
C.
碳单质在氧气中燃烧可以生成CO和CO2
CO和CO2都是酸性氧化物
D.
氨气是电解质
NH3的水溶液显碱性
A、A B、B C、C D、D15. 如图所示,从A处通入新制备的Cl2 , 关闭B阀时,C处的干燥红色布条看不到明显现象,当打开B阀后,C处红色布条逐渐褪色,D瓶中装的溶液不可能是 ( ) A、浓硫酸 B、NaOH溶液 C、KI溶液 D、饱和NaCl溶液16. 下列用双线桥表示电子转移的方向和数目错误的是( )A、
A、浓硫酸 B、NaOH溶液 C、KI溶液 D、饱和NaCl溶液16. 下列用双线桥表示电子转移的方向和数目错误的是( )A、 B、
B、 C、
C、 D、
D、 17. 把0.5molNaOH固体分别加入以下1L液体中,溶液的导电能力变化最小的是( )A、蒸馏水 B、0.5mol/LKCl溶液 C、0.5mol/LNaOH溶液 D、0.5mol/LHCl溶液18. 下列说法错误的是( )A、小苏打可用于制药和烘焙糕点 B、二氧化氯、臭氧用于自来水消毒 C、钠、镁、锌、氧气常用作还原剂 D、为了提高漂白粉的漂白效果,使用时可以滴加几滴的稀醋酸19. 下列说法正确的是( )A、NaCl固体中存在阴阳离子,但NaCl固体不导电 B、金属餐具(如铁锅)可以用来蒸煮或长时间存放酸性食物 C、金刚石和石墨是同素异形体,化学性质不同,物理性质完全相同 D、海水有咸味,海水中氯化物含量相当高,海水中含量最高的元素是氯元素20. 化学与生活、社会发展息息相关,下列有关说法错误的是( )A、《天工开物》中“凡石灰,经火焚炼为用”涉及的反应类型是分解反应 B、“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 C、“青蒿一握,以水二升渍,绞取汁”,诗句中体现的屠呦呦对青蒿素的提取属化学变化 D、“春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应21. 已知NA为阿伏加德罗常数,下列说法正确的是( )A、1molH2O中含有8NA个质子 B、标准状况下,体积为22.4L的N2和O2混合气体,含有分子数为2NA C、5.6gFe与足量Cl2完全反应,转移的电子数为0.2NA D、1L0.01mol/LCaCl2溶液中,含有Cl-数量为0.02NA22. 0.5L硫酸钠溶液中含有23g钠离子,则溶液中硫酸根的物质的量浓度为( )A、0.25mol/L B、0.5mol/L C、1.0mol/L D、2.0mol/L23. 以CO2和Na2O2为原料,制取纯净干燥的O2 , 实验装置如下:
17. 把0.5molNaOH固体分别加入以下1L液体中,溶液的导电能力变化最小的是( )A、蒸馏水 B、0.5mol/LKCl溶液 C、0.5mol/LNaOH溶液 D、0.5mol/LHCl溶液18. 下列说法错误的是( )A、小苏打可用于制药和烘焙糕点 B、二氧化氯、臭氧用于自来水消毒 C、钠、镁、锌、氧气常用作还原剂 D、为了提高漂白粉的漂白效果,使用时可以滴加几滴的稀醋酸19. 下列说法正确的是( )A、NaCl固体中存在阴阳离子,但NaCl固体不导电 B、金属餐具(如铁锅)可以用来蒸煮或长时间存放酸性食物 C、金刚石和石墨是同素异形体,化学性质不同,物理性质完全相同 D、海水有咸味,海水中氯化物含量相当高,海水中含量最高的元素是氯元素20. 化学与生活、社会发展息息相关,下列有关说法错误的是( )A、《天工开物》中“凡石灰,经火焚炼为用”涉及的反应类型是分解反应 B、“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 C、“青蒿一握,以水二升渍,绞取汁”,诗句中体现的屠呦呦对青蒿素的提取属化学变化 D、“春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应21. 已知NA为阿伏加德罗常数,下列说法正确的是( )A、1molH2O中含有8NA个质子 B、标准状况下,体积为22.4L的N2和O2混合气体,含有分子数为2NA C、5.6gFe与足量Cl2完全反应,转移的电子数为0.2NA D、1L0.01mol/LCaCl2溶液中,含有Cl-数量为0.02NA22. 0.5L硫酸钠溶液中含有23g钠离子,则溶液中硫酸根的物质的量浓度为( )A、0.25mol/L B、0.5mol/L C、1.0mol/L D、2.0mol/L23. 以CO2和Na2O2为原料,制取纯净干燥的O2 , 实验装置如下:
下列说法错误的是( )
A、④中收集氧气应选择装置a B、装置③中试剂是浓硫酸,作用是干燥O2 C、装置②中试剂可用NaOH溶液,作用是除去CO2 D、装置②、③之间应增加盛澄清石灰水的洗气瓶24. 现有碳酸钠和碳酸氢钠的混合固体10 g,经过充分加热至恒重后,混合物质量减少了0.62 g,则原混合物中碳酸钠的质量为( )A、1.68 g B、8.32 g C、7.64 g D、9.16 g25. 下列操作及现象、结论都正确的是( )选项
操作及现象
结论
A.
向某无色溶液中滴加盐酸,产生的气体能使澄清石灰水变浑浊
原无色溶液中一定含有
B.
向某溶液中滴氯化钡溶液和稀硝酸,有白色沉淀
原溶液中一定含有
C.
硫酸氢钾溶液中加入紫色石蕊溶液,溶液变红色
属于酸
D.
硫酸铜溶液和氢氧化钠溶液混合,产生蓝色沉淀
生成了难溶于水的
A、A B、B C、C D、D二、填空题
-
26. 回答下列问题:(1)、①CuO的摩尔质量为;
②漂白粉有效成分的化学式是。
(2)、KClO3的电离方程式是。(3)、向Na与H2O反应后的溶液中滴入酚酞,观察到的现象是。27. 在加热条件下,用MnO2与足量浓盐酸反应,制得氯气1.12L(标况下),已知反应后溶液体积为50mL。试计算:(1)、写出该反应的化学方程式;(2)、理论上需要消耗MnO2的质量为;(3)、若将上述反应后的溶液稀释至250mL,则稀释后的溶液中MnCl2的物质的量浓度为。三、综合题
-
28. 有A、B、C、D四种物质的溶液,在进行焰色试验时,火焰都呈黄色,它们之间可发生如图所示的转化。
 (1)、B物质的化学式为。(2)、C物质为钠盐,所属类别为____。A、酸式盐 B、碱式盐 C、正盐(3)、D转化为A的离子方程式。(4)、下列说法错误的是____。A、A与C能进行化学反应 B、上述反应均不属于氧化还原反应 C、往固体B中加少量水,会发生放热现象 D、等质量的B和C与足量盐酸反应,产生的二氧化碳一样多29. 工业上将纯净干燥的氯气通入到0.5 mol·L-1NaOH溶液中得到漂白液。某同学想在实验室探究Cl2性质并模拟制备漂白液,下图是部分实验装置。已知KMnO4与浓盐酸反应可以制取Cl2:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。(装置D中纸条为红色)
(1)、B物质的化学式为。(2)、C物质为钠盐,所属类别为____。A、酸式盐 B、碱式盐 C、正盐(3)、D转化为A的离子方程式。(4)、下列说法错误的是____。A、A与C能进行化学反应 B、上述反应均不属于氧化还原反应 C、往固体B中加少量水,会发生放热现象 D、等质量的B和C与足量盐酸反应,产生的二氧化碳一样多29. 工业上将纯净干燥的氯气通入到0.5 mol·L-1NaOH溶液中得到漂白液。某同学想在实验室探究Cl2性质并模拟制备漂白液,下图是部分实验装置。已知KMnO4与浓盐酸反应可以制取Cl2:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。(装置D中纸条为红色) (1)、A装置中装盐酸的仪器名称为。(2)、A中的反应体现了浓盐酸____性。(填字母)A、氧化性 B、还原性 C、酸性 D、挥发性(3)、饱和NaCl溶液的作用是。(4)、装置E中发生反应的离子方程式是。30. 甲同学欲配制500 mL0.5 mol·L-1的稀硫酸。(1)、若采用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来稀释配制,则所需的体积为mL(保留一位小数)。(2)、甲同学的配制步骤:量取浓硫酸,小心地注入盛有少量蒸馏水的烧杯中,搅拌均匀,待冷却至室温后转移到500 mL容量瓶中,用少量的蒸馏水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加入蒸馏水至刻度线,定容,塞好瓶塞,反复上下颠倒摇匀。
(1)、A装置中装盐酸的仪器名称为。(2)、A中的反应体现了浓盐酸____性。(填字母)A、氧化性 B、还原性 C、酸性 D、挥发性(3)、饱和NaCl溶液的作用是。(4)、装置E中发生反应的离子方程式是。30. 甲同学欲配制500 mL0.5 mol·L-1的稀硫酸。(1)、若采用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来稀释配制,则所需的体积为mL(保留一位小数)。(2)、甲同学的配制步骤:量取浓硫酸,小心地注入盛有少量蒸馏水的烧杯中,搅拌均匀,待冷却至室温后转移到500 mL容量瓶中,用少量的蒸馏水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加入蒸馏水至刻度线,定容,塞好瓶塞,反复上下颠倒摇匀。①洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是。
②定容的正确操作是:继续加蒸馏水至离刻度线下1~2 cm时,改用加水至凹液面最低处与刻度线相切。
③定容时,往容量瓶中加水,不小心液面超过了刻度,处理的方法是(填序号)。
A.吸出多余液体,使凹液面与刻度线相切
B.经计算加入一定量的浓硫酸
C.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
D.重新配制
(3)、配制时下列操作会导致所配溶液浓度偏高的是____。A、转移时有少量溶液溅出 B、定容时俯视刻度线 C、容量瓶用蒸馏水洗净后未干燥 D、定容时液面超过了刻度线