陕西省安康市2022-2023学年高一上学期11月期中化学试题
试卷更新日期:2022-11-28 类型:期中考试
一、单选题
-
1. 垃圾分类可以有效地回收资源,把垃圾从“敌人”变成“朋友”。同样通过研究物质分类,可以发现物质的变化规律,下列有关物质的分类正确的是( )A、酸性氧化物:CO2、Mn2O7、SO3 B、碱:烧碱、纯碱、熟石灰 C、混合物:盐酸、液氮、大理石 D、化合物:胆矾、纯净矿泉水、干冰2. 化学概念在逻辑上存在如图关系,下列说法正确的是( )
 A、胶体与化合物属于包含关系 B、化合物与碱性氧化物属于包含关系 C、单质与电解质属于交叉关系 D、氧化还原反应与离子反应属于并列关系3. 有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3固体,有4位同学为鉴别它们采用了以下不同的方法,其中可行的是( )A、分别配成溶液,再加入澄清石灰水 B、分别配成溶液,再加入NaOH溶液 C、分别加热,再检验是否有使澄清石灰水变浑浊的气体产生 D、分别配成溶液,再进行焰色试验4. 下列叙述中正确的是 ( )A、硫酸钡在水中溶解度很小,所以硫酸钡不是电解质 B、NH3的水溶液能导电,但NH3是非电解质 C、电解质在通电时才能发生电离 D、硫酸不能导电,但硫酸溶液能导电,所以硫酸溶液是电解质5. 下列物质属于胶体的是( )A、鸡蛋清溶液 B、豆腐 C、酒精 D、6. 如图是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。下列有关说法错误的是( )
A、胶体与化合物属于包含关系 B、化合物与碱性氧化物属于包含关系 C、单质与电解质属于交叉关系 D、氧化还原反应与离子反应属于并列关系3. 有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3固体,有4位同学为鉴别它们采用了以下不同的方法,其中可行的是( )A、分别配成溶液,再加入澄清石灰水 B、分别配成溶液,再加入NaOH溶液 C、分别加热,再检验是否有使澄清石灰水变浑浊的气体产生 D、分别配成溶液,再进行焰色试验4. 下列叙述中正确的是 ( )A、硫酸钡在水中溶解度很小,所以硫酸钡不是电解质 B、NH3的水溶液能导电,但NH3是非电解质 C、电解质在通电时才能发生电离 D、硫酸不能导电,但硫酸溶液能导电,所以硫酸溶液是电解质5. 下列物质属于胶体的是( )A、鸡蛋清溶液 B、豆腐 C、酒精 D、6. 如图是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。下列有关说法错误的是( ) A、葡萄糖等这类含碳化合物属于有机物 B、该“纳米药物分子车”属于混合物 C、该“纳米药物分子车”分散于水中所得的分散系具有丁达尔效应 D、该“纳米药物分子车”中的二氧化硅属于酸性氧化物7. 下列叙述中正确的是( )A、纯碱、烧碱都属于碱 B、Na2O2与水的反应中,氧化剂是Na2O2 , 还原剂是水 C、Na2CO3不能转化成NaHCO3 , 而NaHCO3能转化为Na2CO3 D、Na2O2和Na2O中阳离子和阴离子的个数比均为2∶18. 下列有关各种物质的物理性质的叙述中错误的是( )A、金属钠的氧化物都是淡黄色的固体 B、金属钠的密度比水小 C、纯碱和小苏打都能溶于水 D、鉴别碳酸钠和碳酸钾可以使用焰色反应9. 大气中的氮循环(如图所示)可以减少环境的污染。下列说法正确的是( )
A、葡萄糖等这类含碳化合物属于有机物 B、该“纳米药物分子车”属于混合物 C、该“纳米药物分子车”分散于水中所得的分散系具有丁达尔效应 D、该“纳米药物分子车”中的二氧化硅属于酸性氧化物7. 下列叙述中正确的是( )A、纯碱、烧碱都属于碱 B、Na2O2与水的反应中,氧化剂是Na2O2 , 还原剂是水 C、Na2CO3不能转化成NaHCO3 , 而NaHCO3能转化为Na2CO3 D、Na2O2和Na2O中阳离子和阴离子的个数比均为2∶18. 下列有关各种物质的物理性质的叙述中错误的是( )A、金属钠的氧化物都是淡黄色的固体 B、金属钠的密度比水小 C、纯碱和小苏打都能溶于水 D、鉴别碳酸钠和碳酸钾可以使用焰色反应9. 大气中的氮循环(如图所示)可以减少环境的污染。下列说法正确的是( ) A、转化过程中被氧化为 B、转化成发生了还原反应 C、温度越高,转变成的速率越快 D、图中含氮物质中氮元素的化合价共有三种10. 下列物质中,按照只有氧化性、只有还原性,既有氧化性又有还原性的顺序排列的一组是( )A、F2、K、HCl B、Cl2、Si、H2 C、NO2、Na、HNO3 D、O2、SO2、H2O11. 在实验室进行铁粉和硫粉混合加热的实验,产物又进行了系列实验,流程如下。下列说法正确的是( )
A、转化过程中被氧化为 B、转化成发生了还原反应 C、温度越高,转变成的速率越快 D、图中含氮物质中氮元素的化合价共有三种10. 下列物质中,按照只有氧化性、只有还原性,既有氧化性又有还原性的顺序排列的一组是( )A、F2、K、HCl B、Cl2、Si、H2 C、NO2、Na、HNO3 D、O2、SO2、H2O11. 在实验室进行铁粉和硫粉混合加热的实验,产物又进行了系列实验,流程如下。下列说法正确的是( ) A、气体A和D含有同一物质,且均为氧化产物 B、硫元素一共参加了2个氧化还原反应 C、沉淀F为黄色单质 D、若固体B中加浓硫酸,发生反应时被氧化的和被还原的均为同一种元素
A、气体A和D含有同一物质,且均为氧化产物 B、硫元素一共参加了2个氧化还原反应 C、沉淀F为黄色单质 D、若固体B中加浓硫酸,发生反应时被氧化的和被还原的均为同一种元素二、多选题
-
12. 下列离子方程式正确的是( )A、大理石与醋酸反应: B、澄清石灰水中通入过量的二氧化碳: C、向氢氧化钡溶液中加入稀硫酸: D、氢氧化钠溶液与过量的碳酸氢钙溶液反应:13. 下列关于胶体的说法正确的是( )A、向煮沸的水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 B、胶体和溶液的本质区别是能否产生丁达尔效应 C、胶体和溶液可以利用滤纸分离,这种提纯方式是渗析 D、丁达尔效应是胶体粒子对光线散射形成的,是一种物理现象14. 钛合金广泛应用于航空航海领域。钛铁矿(其中Ti为+4价)在高温下经氯化得到四氯化钛,再制取金属钛的流程如图所示。下列说法正确的是( )
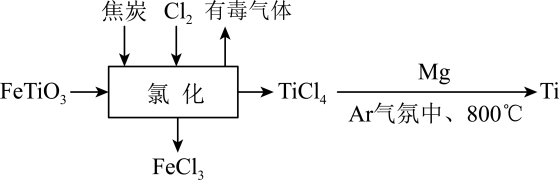 A、钛合金比纯钛硬度大是因为钛合金中金属原子的层状排列更规则 B、氯化过程中FeCl3 , 既是氧化产物又是还原产物 C、制取金属钛时,可用CO2替代Ar气以隔绝空气 D、若制取1mol金属钛,则氯化过程中转移电子的物质的量至少为7mol15. 向某溶液中通入气体后得到溶液 , 因通入的量不同,溶液的组成也不同,若向中逐滴加入盐酸,产生的气体体积与加入盐酸的体积的关系如图所示,则下列分析与判断错误的是(不计溶解)( )
A、钛合金比纯钛硬度大是因为钛合金中金属原子的层状排列更规则 B、氯化过程中FeCl3 , 既是氧化产物又是还原产物 C、制取金属钛时,可用CO2替代Ar气以隔绝空气 D、若制取1mol金属钛,则氯化过程中转移电子的物质的量至少为7mol15. 向某溶液中通入气体后得到溶液 , 因通入的量不同,溶液的组成也不同,若向中逐滴加入盐酸,产生的气体体积与加入盐酸的体积的关系如图所示,则下列分析与判断错误的是(不计溶解)( ) A、若 , 则形成溶液所发生反应的离子方程式为 B、若 , 则溶液为溶液 C、若 , 则溶液中大量存在的阴离子为和 D、若 , 则溶液中
A、若 , 则形成溶液所发生反应的离子方程式为 B、若 , 则溶液为溶液 C、若 , 则溶液中大量存在的阴离子为和 D、若 , 则溶液中三、综合题
-
16. 氮化锂是一种重要的化工试剂,在空气中易潮解。实验室制备的原理是。某实验小组拟设计实验制备并探究其性质。(装置可重复使用)

回答下列问题:
(1)、装饱和溶液的仪器是(填名称)。(2)、B装置的作用是。(3)、气流从左至右,装置的连接顺序为。(4)、实验时,先点燃(填“A处”或“C处”)酒精灯。(5)、A装置中制备的反应的化学方程式为。(6)、如果氮化锂产品中混有 , 可能的原因是。(7)、取粗产品于试管中,向试管中滴加蒸馏水,有气体产生,同时溶液呈碱性。与水反应的化学方程式为。17. 回答下列问题:(1)、区别溶液和胶体的最简单方法是。(2)、用一种试剂除去下列各物质的杂质(括号内为杂质):CO2(HCl),试剂:;SO(CO),试剂:。
(3)、已知:6Fe2++R2O+14H+=6Fe3++2R3++7H2O,则R2O中R的化合价为。(4)、熔融的NaHSO4电离方程式。18. 纯碱是一种重要的化工原料,广泛应用于玻璃造纸、纺织和洗涤剂的生产。(1)、起初,人们从盐碱地和盐湖中获得纯碱,但远远不能满足工业发展的需要,纯碱的化学式为。(2)、1861年,“索尔维制碱法”问世,该方法是在用氯化钠溶液吸收两种工业废气时意外发现的,反应后生成碳酸氢钠和氯化铵 , 再加热碳酸氢钠即可制得纯碱,氯化钠溶液吸收的两种气体为____(填标号)。A、 B、 C、 D、(3)、“侯氏制碱法”由我国化学工程专家侯德榜先生于1943年创立,是“索尔维制碱法”的改进,大大提高了原料的利用率,至今仍为全世界广泛采用。
①沉淀池中发生的化学反应方程式是。
②上述流程中X物质是(填化学式)。
③使原料氯化钠的利用率从70%提高到90%以上,主要是设计了(填“Ⅰ”或“Ⅱ”)的循环。从沉淀池中取出沉淀的操作是。
19. 用海水“晒盐”的方法得到的粗盐中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质。将此粗盐提纯的部分实验方案如图: (1)、加入BaCl2溶液的目的是(用离子方程式表示)。(2)、判断BaCl2已过量的方法是(3)、生成沉淀C的离子方程式是。(4)、D中所含离子有。(5)、E的主要成分的化学式是。(6)、用文字描述加入适量盐酸的目的是。20. A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质,其化合物的焰色都为黄色。
(1)、加入BaCl2溶液的目的是(用离子方程式表示)。(2)、判断BaCl2已过量的方法是(3)、生成沉淀C的离子方程式是。(4)、D中所含离子有。(5)、E的主要成分的化学式是。(6)、用文字描述加入适量盐酸的目的是。20. A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质,其化合物的焰色都为黄色。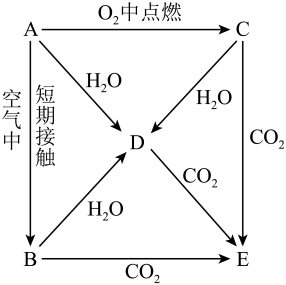 (1)、写出的化学式:A;B;C;E。(2)、写出反应的化学方程式:
(1)、写出的化学式:A;B;C;E。(2)、写出反应的化学方程式::;
:;
:。