湖北省宜昌市协作体2022-2023学年高一上学期期中考试化学试题
试卷更新日期:2022-11-28 类型:期中考试
一、单选题
-
1. 古诗词是古人为我们留下的宝贵精神财富,下列诗句中涉及氧化还原反应的是( )A、零落成泥碾作尘,只有香如故 B、落红不是无情物,化作春泥更护花 C、日照香炉生紫烟,遥看瀑布挂前川 D、欲渡黄河冰塞川,将登太行雪满山2. 下列物质能产生丁达尔效应的是( )A、氢氧化铁胶体 B、稀盐酸 C、自来水 D、硫酸铜溶液3. 在下列变化中,需要加入合适的氧化剂才能实现的是( )A、HCl→H2 B、CO2→CO C、Fe2O3→Fe D、Br-→Br24. 下列化学用语表达正确的是( )A、构成化合物氯化镁的基本粒子: B、在水溶液中的电离方程式: C、苏打的化学式: D、的结构示意图:
 5. 下表所列各组物质中,物质之间按如图所示箭头方向无法一步反应实现转化的是( )
5. 下表所列各组物质中,物质之间按如图所示箭头方向无法一步反应实现转化的是( )
物质
选项
甲
乙
丙
A
B
CaO
C
CuO
D
C
CO
A、A B、B C、C D、D6. 下列关于钠及其化合物的说法正确的是( )A、将Na久置于空气中,最终得到的产物为NaOH B、将投入适量紫色石蕊溶液中,溶液褪色 C、和组成元素相同,化学性质相似 D、质量分数相同的溶液和 , 溶液的碱性:7. 在酸性条件下,可发生如下反应: +2M3++4H2O= +Cl-+8H+ , 中M的化合价是 ( )A、+4 B、+5 C、+6 D、+78. 下列实验过程中,不会产生气体的是( )A、 B、
B、 C、
C、 D、
D、 9. 下列有关物质的性质与用途,具有对应关系的是( )A、溶液显碱性,可用于实验室制取 B、NaClO具有强氧化性,常作为杀菌、消毒剂 C、Na能与反应,可用于工业制食盐 D、的溶液显酸性,可用于图书馆灭火10. 下列关于离子检验的说法正确的是( )A、若某溶液的焰色为黄色,则证明该溶液中一定含有 , 不含 B、向某溶液中滴入几滴酚酞溶液,溶液呈红色,该溶液的溶质一定是碱 C、取少量溶液加入足量稀盐酸,无明显现象,再加入溶液,产生白色沉淀,证明该溶液中含有 D、取少量溶液加入足量稀盐酸,产生能使澄清石灰水变浑浊的气体,则证明该溶液中一定含有11. 下列关于氯及其化合物的叙述中正确的是( )A、氯气发生泄漏,向低处疏散 B、部分自来水厂已用代替氯气进行消毒 C、漂白液的有效成分为NaCl D、漂白粉比HClO稳定,可露置于空气中长期保存12. 一瓶不纯的粉末,所含杂质可能是中的一种或几种,为确定其成分,进行如下流程:
9. 下列有关物质的性质与用途,具有对应关系的是( )A、溶液显碱性,可用于实验室制取 B、NaClO具有强氧化性,常作为杀菌、消毒剂 C、Na能与反应,可用于工业制食盐 D、的溶液显酸性,可用于图书馆灭火10. 下列关于离子检验的说法正确的是( )A、若某溶液的焰色为黄色,则证明该溶液中一定含有 , 不含 B、向某溶液中滴入几滴酚酞溶液,溶液呈红色,该溶液的溶质一定是碱 C、取少量溶液加入足量稀盐酸,无明显现象,再加入溶液,产生白色沉淀,证明该溶液中含有 D、取少量溶液加入足量稀盐酸,产生能使澄清石灰水变浑浊的气体,则证明该溶液中一定含有11. 下列关于氯及其化合物的叙述中正确的是( )A、氯气发生泄漏,向低处疏散 B、部分自来水厂已用代替氯气进行消毒 C、漂白液的有效成分为NaCl D、漂白粉比HClO稳定,可露置于空气中长期保存12. 一瓶不纯的粉末,所含杂质可能是中的一种或几种,为确定其成分,进行如下流程:
下列推断正确的是( )
A、白色沉淀1为 B、无色溶液1中的溶质为 C、无色溶液2中一定含有的阳离子为 D、该样品杂质中一定含13. 工业上制取的化学反应为 , 下列说法正确的是( )A、在反应中被氧化 B、在反应中失去电子 C、在反应中作氧化剂 D、生成1个分子时,转移的电子数为214. 下列离子方程式的书写正确的是( )A、盐酸滴入氨水中: B、氧化铁与稀盐酸混合: C、实验室用大理石和稀盐酸制取: D、碳酸氢钙溶液与稀盐酸反应:15. 下列图像正确的是( )



A.向溶液中滴加等浓度的溶液至过量
B.向的NaOH溶液中通入气体
C.向一定浓度的NaCl溶液中加水
D.向蒸馏水中不断通入HCl气体
A、A B、B C、C D、D二、填空题
-
16. 运用分类的方法研究物质及其变化的规律是化学学习的有效途径。回答下列问题:(1)、将①Fe ②CO ③硫酸铜溶液 ④液态氯化氢 ⑤熔融氯化钠 ⑥固态烧碱 ⑦固体 ⑧CuO固体 ⑨氨气 ⑩晶体
按不同的分类标准填空:
a.碱性氧化物:(填序号,下同);
b.电解质:;
c.上述状态下能导电的是。
(2)、用上述物质,按要求填空。a.⑩在熔融状态下的电离方程式为;
b.④和⑥在溶液中反应的离子方程式为;
c.将少量⑦投入③中的现象为;
d.用②还原⑧的化学方程式为。
17. 已知反应:①
②
③
④
⑤
(1)、上述反应中,属于置换反应的是(填序号,下同);同一元素之间发生氧化还原的是。(2)、反应②中氧化剂是(填化学式,下同);反应③中氧化产物是。(3)、在反应④中,每生成1个分子时,转移的电子数为。(4)、配平反应⑤并用双线桥法标出反应⑤中电子转移的方向和数目。(5)、反应⑤中氧化剂与还原剂的质量之比为(填最简整数比)。(6)、已知有下列两个反应:①;② , 、、的氧化性由强到弱的顺序为。(7)、下列物质中能使酸性溶液褪色(转化为而褪色)的是(填字母)。a.臭碱(Na2S) b.小苏打(NaHCO3) c.水玻璃(溶液)
18. 钠的化合物在日常生活中的应用非常广泛,回答下列问题:(1)、Ⅰ.为了测定和NaHCO3的混合物中的质量分数,某同学用如下装置完成实验。实验前首先要进行的操作是。
(2)、某同学称取65.4g混合物于锥形瓶中,打开止水夹,通入 , 一段时间后,关闭止水夹,称量装置C,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间。停止通 , 装置C的质量增加30.8g。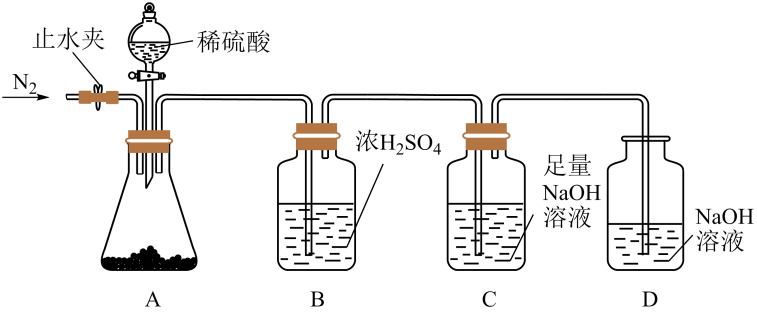
①两次通入的目的分别是、。
②混合物中的质量为g。
(3)、Ⅱ.侯德榜“联合制碱法”将制碱技术发展到个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
资料:沉淀池中的反应为。
操作1的名称为;煅烧炉中反应的化学方程式为。
(4)、物质X可循环利用,其化学式为。(5)、工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与反应可制得一种在生产、生活中常用于漂白、消毒的物质,同时有生成,该反应的化学方程式是。19. 氯气(Cl2)是一种黄绿色的有毒气体,在古代炼金术士加热王水的时候,就已经产生,只是当时的人们并不知道产生的那种刺激性很强的气体就是Cl2。直到1774年,瑞典化学家舍勒加热二氧化锰与浓盐酸的混合物时,发现了这种气体,并深入研究其性质。回答下列问题:(1)、写出瑞典化学家舍勒首次制备氯气的化学反应方程式: , 该反应中,浓盐酸体现的性质是(填字母)。a.还原性 b.氧化性 c.酸性
(2)、随着研究的深入,人们逐渐发现浓盐酸与高锰酸钾固体混合也能生成氯气,该反应除了生成Cl2外,还有生成。根据该实验原理,在实验室可设计如下装置制备干燥的氯气并检验其性质:
①写出装置A中反应的离子方程式:。
②装置B、C中盛放的试剂分别是、;装置F的作用是。
③装置E的实验目的是验证氯气是否具有漂白性,为此E中Ⅰ、Ⅱ、Ⅲ应依次放入(填字母)。
选项
a
b
c
d
Ⅰ
干燥的有色布条
干燥的有色布条
湿润的有色布条
湿润的有色布条
Ⅱ
碱石灰(氧化钙和氢氧化钠的混合物)
硅胶(具有吸水性)
浓硫酸
无水氯化钙(具有吸水性)
Ⅲ
湿润的有色布条
湿润的有色布条
干燥的有色布条
湿润的有色布条
④若进行实验时E中发生堵塞,此时B中的现象为。