新疆喀什地区英吉沙县2022-2023学年高三上学期11月期中考试化学试题
试卷更新日期:2022-11-28 类型:期中考试
一、单选题
-
1. 下列化学用语正确的是( )A、乙烯分子的结构简式:CH2CH2 B、氯化镁的电子式:
 C、质量数为137的钡原子:
D、K+离子的结构示意图:
C、质量数为137的钡原子:
D、K+离子的结构示意图: 2. 下列关于胶体的叙述错误的是( )A、胶体区别于其他分散系的本质特征是能否发生丁达尔效应 B、鸡蛋清溶液、淀粉溶液都能发生丁达尔效应 C、在1L2mol·L-1的Fe(OH)3胶体中,含有的Fe(OH)3胶粒小于2NA D、Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的3. 下列关于胶体和溶液的说法中,正确的是( )A、许多胶体能进行电泳是因为这些胶体带电 B、将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 C、布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分 D、光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应4. 高效“绿色”消毒剂二氧化氯通常为气体。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO42ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )A、KClO3 在反应中失去电子 B、H2C2O4 是还原剂,在反应中被还原 C、ClO2 具有还原性,可用于自来水的杀菌消毒 D、1 mol KClO3 参加反应,有 1 mol 电子转移5. 设 NA 为阿伏加德罗常数值。下图表示 N2O 在Pt2O+表面与 CO 反应转化成无害气体的过程。下列说法正确的是( )
2. 下列关于胶体的叙述错误的是( )A、胶体区别于其他分散系的本质特征是能否发生丁达尔效应 B、鸡蛋清溶液、淀粉溶液都能发生丁达尔效应 C、在1L2mol·L-1的Fe(OH)3胶体中,含有的Fe(OH)3胶粒小于2NA D、Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的3. 下列关于胶体和溶液的说法中,正确的是( )A、许多胶体能进行电泳是因为这些胶体带电 B、将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 C、布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分 D、光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应4. 高效“绿色”消毒剂二氧化氯通常为气体。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO42ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )A、KClO3 在反应中失去电子 B、H2C2O4 是还原剂,在反应中被还原 C、ClO2 具有还原性,可用于自来水的杀菌消毒 D、1 mol KClO3 参加反应,有 1 mol 电子转移5. 设 NA 为阿伏加德罗常数值。下图表示 N2O 在Pt2O+表面与 CO 反应转化成无害气体的过程。下列说法正确的是( ) A、N2O 转化成无害气体时的催化剂是 B、1g N2O 气体中含有电子数为 0.5NA C、1mol CO2 中含有 2NA 个共用电子对 D、1mol Pt2O+转化为 得电子数为 3NA6. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、 3-苯基丙烯(
A、N2O 转化成无害气体时的催化剂是 B、1g N2O 气体中含有电子数为 0.5NA C、1mol CO2 中含有 2NA 个共用电子对 D、1mol Pt2O+转化为 得电子数为 3NA6. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、 3-苯基丙烯(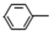 )中含有的碳碳双键数为NA
B、10克环己烷与2-丙醇的混合液中,碳元素的质量分数为72%,则其中所含的氧原子数目为
C、碳化硅 (SiC)晶体结构中,若含有1mol碳原子,则所含共价键的数目为2NA
D、硝酸与铜反应得到、共46g,则铜失去的电子数为NA
7. 下列各组物质中,所含分子数相同的是( )A、10gH2和10gO2 B、5.6LN2 (标准状况)和 11 g CO2 C、18 g H2O 和 0.5 mol Br2 D、224mLH2和 0.01 molN28. 设表示阿伏加德罗常数的值,下列说法中错误的是( )A、个分子的物质的量是 B、分子含有的原子数目为 C、在和的条件下,水所含的水分子数为 D、与足量完全反应,反应中转移的电子数为9. 下列离子方程式书写正确的是( )A、向Na2SiO3溶液中滴加稀盐酸: B、碳酸氢钠溶液与硫酸氢钠溶液反应: C、AlCl3溶液中加入过量的氨水: D、用澄清石灰水检验二氧化碳:10. 下列离子方程式书写错误的是( )A、澄清石灰水中加入过量的NaHCO3:Ca2++2OH-+2HCO=CaCO3↓+CO+2H2O B、铜和浓硫酸反应制备SO2:Cu+4H++SOCu2++SO2↑+2H2O C、酸化的FeSO4溶液长时间存放,溶液变黄:4H++4Fe2++O2=4Fe3++2H2O D、铜和浓硝酸反应:Cu+4H++2NO=Cu2++2NO2↑+2H2O11. 下列方程式的错误的是( )A、实验室制取Cl2:MnO2+4HCl(浓)MnCl2+Cl2 ↑+2H2O B、二氧化硫通入氯化钡溶液的离子方程式: Ba2++ SO2+ 2H2O =BaSO4↓+ 4H+ C、硫酸氢钠在水中的电离方程式:NaHSO4=Na++H++ D、乙醇与钠反应的化学方程式: 2C2H5OH+2Na→2C2H5ONa + H2 ↑12. 下列离子方程式与所述事实相符且正确的是( )A、磁性氧化铁溶于稀硝酸:Fe3O4+8H++=3Fe3++NO↑+4H2O B、Ca(HCO3)2溶液中加入少量NaOH溶液: Ca2++2+2OH-=CaCO3↓++H2O C、明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2+2Ba2++4OH-=+2BaSO4↓+2H2O D、向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br213. 能用离子方程H++OH-=H2O表示的化学反应是( )A、氢氧化钠与盐酸反应 B、氢氧化钾与醋酸反应 C、氢氧化钡与硫酸反应 D、氢氧化铜与硫酸反应14. 某混合溶液中含种离子,物质的量浓度如下表,则的物质的量浓度以及离子符号可能为(已知具有强氧化性)( )
)中含有的碳碳双键数为NA
B、10克环己烷与2-丙醇的混合液中,碳元素的质量分数为72%,则其中所含的氧原子数目为
C、碳化硅 (SiC)晶体结构中,若含有1mol碳原子,则所含共价键的数目为2NA
D、硝酸与铜反应得到、共46g,则铜失去的电子数为NA
7. 下列各组物质中,所含分子数相同的是( )A、10gH2和10gO2 B、5.6LN2 (标准状况)和 11 g CO2 C、18 g H2O 和 0.5 mol Br2 D、224mLH2和 0.01 molN28. 设表示阿伏加德罗常数的值,下列说法中错误的是( )A、个分子的物质的量是 B、分子含有的原子数目为 C、在和的条件下,水所含的水分子数为 D、与足量完全反应,反应中转移的电子数为9. 下列离子方程式书写正确的是( )A、向Na2SiO3溶液中滴加稀盐酸: B、碳酸氢钠溶液与硫酸氢钠溶液反应: C、AlCl3溶液中加入过量的氨水: D、用澄清石灰水检验二氧化碳:10. 下列离子方程式书写错误的是( )A、澄清石灰水中加入过量的NaHCO3:Ca2++2OH-+2HCO=CaCO3↓+CO+2H2O B、铜和浓硫酸反应制备SO2:Cu+4H++SOCu2++SO2↑+2H2O C、酸化的FeSO4溶液长时间存放,溶液变黄:4H++4Fe2++O2=4Fe3++2H2O D、铜和浓硝酸反应:Cu+4H++2NO=Cu2++2NO2↑+2H2O11. 下列方程式的错误的是( )A、实验室制取Cl2:MnO2+4HCl(浓)MnCl2+Cl2 ↑+2H2O B、二氧化硫通入氯化钡溶液的离子方程式: Ba2++ SO2+ 2H2O =BaSO4↓+ 4H+ C、硫酸氢钠在水中的电离方程式:NaHSO4=Na++H++ D、乙醇与钠反应的化学方程式: 2C2H5OH+2Na→2C2H5ONa + H2 ↑12. 下列离子方程式与所述事实相符且正确的是( )A、磁性氧化铁溶于稀硝酸:Fe3O4+8H++=3Fe3++NO↑+4H2O B、Ca(HCO3)2溶液中加入少量NaOH溶液: Ca2++2+2OH-=CaCO3↓++H2O C、明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2+2Ba2++4OH-=+2BaSO4↓+2H2O D、向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br213. 能用离子方程H++OH-=H2O表示的化学反应是( )A、氢氧化钠与盐酸反应 B、氢氧化钾与醋酸反应 C、氢氧化钡与硫酸反应 D、氢氧化铜与硫酸反应14. 某混合溶液中含种离子,物质的量浓度如下表,则的物质的量浓度以及离子符号可能为(已知具有强氧化性)( )所含离子
物质的量浓度
?
A、 B、 C、 D、15. 某固体样品由NH4Cl、FeCl2、Na2CO3、NaNO3中的两种按物质的量1:1组成,现对固体样品进行实验:将混合物溶于水,滴加足量的稀盐酸,产生气体,且反应后阴离子的种数与反应前相比无变化。根据实验现象判断固体样品的组成为( )A、NH4Cl、Na2CO3 B、FeCl2、Na2CO3 C、FeCl2、NaNO3 D、NH4Cl、NaNO316. 某地区的雾霾经收集处理后得试样溶液,可能含有如下离子:Na+、NH、Mg2+、Al3+、SO、NO、Cl—。某同学设计并完成了如图实验: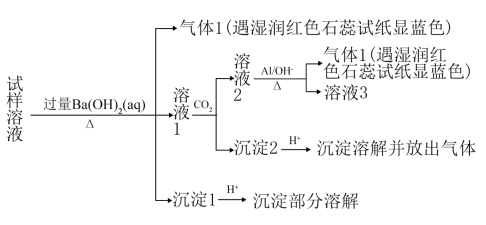
已知:3NO+8Al+5OH-+2H2O+3NH3↑+8AlO
根据以上的实验操作与现象,该同学得出的结论错误的是( )
A、试样中肯定存在NH、Mg2+、SO和NO B、试样中一定不含Al3+ C、试样中可能存在Na+、Cl- D、该雾霾中可能存在NaNO3、NH4Cl和MgSO417. 下列化学方程式中电子转移错误的是( )A、 B、
B、
C、
C、 D、
D、 18. 反应3Br2+6NaOH 5NaBr+NaBrO3+3H2O中,氧化产物是( )A、Br2 B、NaBr C、NaBrO3 D、H2O19. 剪纸是我国传统文化的重要组成部分。佛山剪纸分为纯色剪纸、衬料剪纸、写料剪纸、铜凿剪纸四类。下列有关说法错误的是( )A、造纸术是我国古代四大发明之一,造纸的过程中发生了化学变化 B、二氧化硫脲(
18. 反应3Br2+6NaOH 5NaBr+NaBrO3+3H2O中,氧化产物是( )A、Br2 B、NaBr C、NaBrO3 D、H2O19. 剪纸是我国传统文化的重要组成部分。佛山剪纸分为纯色剪纸、衬料剪纸、写料剪纸、铜凿剪纸四类。下列有关说法错误的是( )A、造纸术是我国古代四大发明之一,造纸的过程中发生了化学变化 B、二氧化硫脲( )常用作漂白剂,其分子中只含极性键
C、铜凿剪纸是在铜箔上用小钢凿敲凿出图案,铜、铁都属于金属材料
D、植物纤维是造纸的原材料之一,也是人体需要的六大营养物质之一
)常用作漂白剂,其分子中只含极性键
C、铜凿剪纸是在铜箔上用小钢凿敲凿出图案,铜、铁都属于金属材料
D、植物纤维是造纸的原材料之一,也是人体需要的六大营养物质之一
二、多选题
-
20. 氧化铍(BeO)在航天航空等领域有着广泛的应用。一种以预处理后的硅铍矿(主要含BeO、Fe2O3、SiO2和FeO等)为原料提取BeO的流程如下图所示:
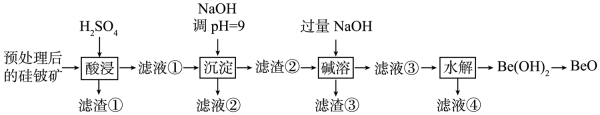
已知:Be(OH)2具有两性,在强碱性溶液中可转化为BeO。下列说法错误的是( )
A、“酸浸”步骤所得“滤渣①”的主要成分为Si B、“滤液②”经处理后可获得副产品Na2SO4·10H2O C、“碱溶”时,主要反应为Be(OH)2+2OH-=BeO+2H2O D、“水解”时,适当增大溶液pH有利于提高BeO的提取率三、综合题
-
21. 下图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
盐酸
分子式:
相对分子质量:36.5
密度:
的质量分数:36.5%
(1)、该浓盐酸中的物质的量浓度为。(2)、取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是____(填字母)。A、溶液中的物质的量 B、溶液的浓度 C、溶液中的数目 D、溶液的密度(3)、某学生欲用上述浓盐酸和蒸馏水配制物质的量浓度为的稀盐酸。①该学生需要量取 上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填A表示“偏高”、填B表示“偏低”、填C表示“无影响”)。
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面。
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。
Ⅲ.定容摇匀后,发现液面低于刻度线。
Ⅳ.定容时,俯视读数,所得溶液的浓度。
22. 黄铁矿是生产硫酸的原料,其主要成分为FeS2。850〜950℃时,在空气中煅烧,发生反应4FeS2 + 11O22Fe2O3+8SO2
试回答下列问题:
(1)、含硫35%的黄铁矿样品(杂质不含硫),其FeS2的含量为(2)、可用来表示该反应的化学反应速率的物质为(填化学式)。(3)、某时刻测得生成SO2的速率为0.64 mol·L-1·s-1 , 则氧气减少的速率为(4)、为了提高SO2的生成速率,下列措施可行的是____(填选项字母)。A、增加硫铁矿石的投入量 B、增加炉的高度 C、将硫铁矿石粉碎 D、升高温度23. 无机净水剂主要有铁系和铝系两类,但铝对人体有慢性毒害作用,所以研制各种铁系净水剂成为热门。聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m是一种常用的净水剂,其生产工艺如下: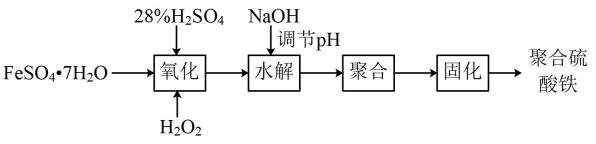
回答下列问题:
(1)、用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒、玻璃棒外,还有。(2)、FeSO4·7H2O在空气中会被氧化变质,检验其已变质的操作:。(3)、“氧化”时发生反应的离子方程式为。(4)、Fe3+水解会使溶液的pH减小,加入NaOH调节pH的目的是。(5)、聚合硫酸铁中n(Fe3+):n(OH-):n(SO)比值的确定方法:取一定量的聚合硫酸铁,先加入足量的稀盐酸酸化后,然后加入BaCl2溶液,经操作Ⅰ后得到沉淀A和滤液B,洗涤、干燥沉淀A后称得质量为3.495g,向滤液B中加入足量的NaOH充分反应,将经操作Ⅰ后得到的滤渣洗涤、灼烧至恒重,得2.40g固体C。①生成沉淀A的离子方程式为。
②操作Ⅰ的名称为 , 固体C的化学式为。
③聚合硫酸铁中n(Fe3+):n(OH-):n(SO)。
24. 锌钡白(又称立德粉)广泛用作白色颜料。以含锌废料(主要成分是ZnO,含少量Fe3O4、CuO、SiO2等)为原料生产锌钡白(ZnS∙BaSO4)的工艺如下:
已知:①常温下,Ksp[Fe(OH)3]=1.0×10-38 , Ksp(ZnS)=3.0×10-25 , Ksp(CuS)=6.0×10-36;
②BaS微溶于水,溶于水缓慢反应生成Ba(OH)2和H2S。
回答下列问题:
(1)、“固体2”的主要成分是(填化学式);提高“酸浸"速率的措施主要有(答一条)。(2)、“氧化”的离子方程式为。(3)、“除铁”后c(Fe3+)=1×10-5mol·L-1时,滤液的pH=(4)、“除铜”中ZnS(s)+Cu2+(aq) CuS(s)+Zn2+(aq)的平衡常数K=(5)、制备锌钡白的化学方程式为 , 通过检验SO判断立德粉是否洗净,其操作方法是。(6)、已知该废料中含ZnO的质量分数为8.1%,100t这种废料最终可制备23.4t立德粉,其中0.3t为除杂试剂转化所得,则由该废料制得的立德粉的产率为。
-