江西省赣州市五校联考2022-2023学年高三上学期期中考试化学试题
试卷更新日期:2022-11-28 类型:期中考试
一、单选题
-
1. 化学在生产生活中具有重要应用,下列有关说法正确的是( )
A.
B.
C.
D.




溶洞形成时,涉及的溶解
不锈钢镀铜水龙头:镀铜时,纯铜作阴极
植物光合作用中,碳元素被氧化
植物奶油的制作过程:为取代反应
A、A B、B C、C D、D2. 北京故宫的屋顶有各种颜色的琉璃瓦,其坚实耐用,经历几百年的风雨洗礼仍能保存完整,下列说法错误的是( )A、琉璃瓦的主要成分是硅酸盐 B、制作琉璃瓦的主要原料是黏土 C、琉璃瓦坚实耐用取决于硅酸盐的结构 D、黄色和绿色琉璃瓦中分别含有、3. 下列各组粒子在对应的环境中能大量共存的是( )A、氯水中:、、、 B、的溶液中:、、、 C、加入产生气泡的溶液中:、、、 D、使酚酞变红的溶液中:、、、4. 劳动成就梦想。下列劳动项目与化学知识不相符的是( )选项
劳动项目
化学知识
A
饮食卫生:高温蒸煮,给碗筷消毒
高温能使蛋白质变性
B
自主探究:植物油可使酸性高锰酸钾溶液褪色
植物油中含有碳碳双键,能被酸性高锰酸钾氧化
C
家务劳动:用食醋清洗水壶内的水垢
醋酸的酸性比碳酸强
D
工厂参观:燃煤时,加入生石灰
增大煤与空气的接触面积,从而提高煤的燃烧效率
A、A B、B C、C D、D5. 下列颜色变化与氧化还原反应无关的是( )A、新切开的苹果在空气中变黄,最终变为褐色 B、白色的硫酸铜固体放置在空气中变为蓝色 C、淡黄绿色的新制氯水久置后变为无色 D、淡黄色的固体放置在空气中,一段时间后变成白色6. 在指定条件下,下列含氮化合物间的转化能一步实现的是( )A、 B、 C、稀 D、7. 实验室需要制备少量并验证其性质,下列实验装置不能达到相应实验目的的是( )



A.制取
B.验证的还原性
C.收集
D.吸收
A、A B、B C、C D、D8. 一种实现二氧化碳固定及再利用的反应如图所示。下列叙述正确的是( )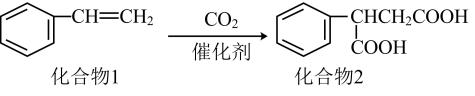 A、化合物1中有两种官能团 B、化合物1与乙烯互为同系物 C、化合物2可以与乙二醇发生缩聚反应 D、化合物2中所有碳原子一定共平面9. 下列有关非金属化合物的性质说法正确的是( )A、向CaCl2溶液中通入少量的CO2生成CaCO3沉淀 B、NO2通入水中能得到一种无色气体,该气体遇空气变为红棕色 C、将分别蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生 D、将等物质的量的SO2和Cl2通入水中,溶液的漂白性增强10. 下列鉴别各组物质所选试剂错误的是( )
A、化合物1中有两种官能团 B、化合物1与乙烯互为同系物 C、化合物2可以与乙二醇发生缩聚反应 D、化合物2中所有碳原子一定共平面9. 下列有关非金属化合物的性质说法正确的是( )A、向CaCl2溶液中通入少量的CO2生成CaCO3沉淀 B、NO2通入水中能得到一种无色气体,该气体遇空气变为红棕色 C、将分别蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生 D、将等物质的量的SO2和Cl2通入水中,溶液的漂白性增强10. 下列鉴别各组物质所选试剂错误的是( )选项
待鉴别物质
鉴别试剂
A
和
品红溶液
B
溶液和碘水
四氯化碳
C
乙酸乙酯和乙酸
水
D
和
湿润的KI—淀粉试纸
A、A B、B C、C D、D11. 高纯度晶体硅是典型的无机非金属材料,又称半导体材料,它的发现和使用曾引起计算机的一场“革命”。它的制备方法如图所示,下列说法错误的是( )A、硅和二氧化硅均能与氢氟酸反应 B、步骤①中易产生SiC杂质,SiC属于共价化合物 C、步骤③的反应属于置换反应 D、熔融NaOH固体,可在石英坩埚中进行12. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,2.2g由CO2和N2O组成的混合气体中含有的原子总数为0.15 NA B、0.1molFeBr2与0.1molCl2反应,生成的Br2分子数为0.1 NA C、常温下,将2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3 NA D、25℃时,pH=13的氨水中由水电离出的氢离子数目为10-13 NA13. 对比类推法是一种常用的化学学习方法。下列离子方程式书写符合题意且类推合理的是( )选项
已知
类推
A
将锌片投入硫酸铜溶液中:
将钠投入硫酸铜溶液中:
B
氧化铝溶解在稀硝酸中:
氧化亚铁溶解在稀硝酸中:
C
用惰性电极电解硫酸钠溶液:
用惰性电极电解硝酸钾溶液:
D
向溶液中加入过量的:
向溶液中通入过量的:
A、A B、B C、C D、D14. 下列由实验操作和现象得出的结论正确的是( )选项
实验操作
现象
结论
A
将过量通入Ba(OH)2溶液中
先生成白色沉淀,后沉淀
碳酸钡不溶于水,碳酸氢钡易溶于水
B
向麦芽糖溶液中加入足量NaOH溶液,再加入新制的悬浊液,加热
产生砖红色沉淀
麦芽糖已发生水解
C
加热乙醇与浓硫酸的混合液,将产生的气体通入酸性溶液中
溶液由紫色变成无色
气体中一定含有乙烯
D
将通入碘水中
碘水褪色
具有漂白性
A、A B、B C、C D、D15. 纳米硅基锂电池是一种新型二次电池,电池装置如图所示,电池充电时,三元锂电极上发生的电极反应为。下列说法错误的是( ) A、电池工作时,硅基电极上发生的电极反应: B、电池工作时,三元锂电极为正极,发生还原反应 C、充电时,Li+由三元锂电极经电解质溶液移向硅基电极 D、为提高电池工作效率并延长电池使用寿命,可将有机聚合物电解质换为锂盐水溶液16. X、Y、Z、W是原子序数依次增大的前20号元素,由它们组成的化合物的结构简式如图,其中Y与Z位于相邻主族,下列说法正确的是( )
A、电池工作时,硅基电极上发生的电极反应: B、电池工作时,三元锂电极为正极,发生还原反应 C、充电时,Li+由三元锂电极经电解质溶液移向硅基电极 D、为提高电池工作效率并延长电池使用寿命,可将有机聚合物电解质换为锂盐水溶液16. X、Y、Z、W是原子序数依次增大的前20号元素,由它们组成的化合物的结构简式如图,其中Y与Z位于相邻主族,下列说法正确的是( ) A、原子半径: B、Z的最高价氧化物对应的水化物为强酸 C、化合物WYX中只含有离子键 D、W与Y形成的化合物不可能具有强氧化性
A、原子半径: B、Z的最高价氧化物对应的水化物为强酸 C、化合物WYX中只含有离子键 D、W与Y形成的化合物不可能具有强氧化性二、综合题
-
17. 三氯化铬()是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取的装置如图所示:

已知:碱性条件下,可将氧化(黄色);酸性条件下,可将(橙色)还原为(绿色)。
回答下列问题:
(1)、基态Cr原子的核外电子排布式为。(2)、装置B中热水的作用是;实验进行一段时间后,发现导管a中的液面在不断上升,出现该现象的可能原因是 , 改进的措施是。(3)、对于装置C中发生的反应,甲、乙分别提出了两种不同的观点,甲认为发生的反应是;乙认为发生的反应是。Ⅰ.查阅资料知:(俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为。
Ⅱ.设计实验验证装置C中发生的反应;反应结束后,静置,待装置F中溶液分层后,取适量上层溶液于试管中, , 证明甲的观点正确,
(4)、测定某样品中的质量分数的实验步骤如下:Ⅰ.取5.0g该样品,在强碱性条件下·加入过量30%溶液,小火加热使完全转化为 , 再继续加热一段时间。
Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使转化为 , 再加适量的蒸馏水将溶液稀释至100mL
Ⅲ.取25.00mL溶液,加入适量浓混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的的标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗标准溶液21.00mL(滴定中被还原为)。
①步骤Ⅰ中完全转化时发生反应的离子方程式为。
②该样品中的质量分数为。
18. 科学家开发出的新型太阳能铜铟镓二硒()电池,光电转化率达到25%。某小组以硒化银半导体废料(含、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题: (1)、NaOH的电子式为。(2)、下列事实能说明硫的非金属性比硒的强的是____(填标号)。A、溶解度: B、沸点: C、酸性:(3)、“酸溶”时,能提高反应速率的措施有(答1条即可)。、和反应的化学方程式为。(4)、“电解”时,阳极生成的气体为(填化学式),电解结束后,电解液的pH(填“增大”、“减小”或“不变”)。(5)、在上述流程中,H2SeO3转化为Se的过程中,当生成23.7gSe时,理论上有标准状况下LSO2参与反应。(6)、“沉银”时转化成AgCl,该反应的平衡常数。[已知:常温下, , ]19. 氮的化合物在生产、生活中有广泛应用。(1)、已知几种共价键的键能数据如下表所示:
(1)、NaOH的电子式为。(2)、下列事实能说明硫的非金属性比硒的强的是____(填标号)。A、溶解度: B、沸点: C、酸性:(3)、“酸溶”时,能提高反应速率的措施有(答1条即可)。、和反应的化学方程式为。(4)、“电解”时,阳极生成的气体为(填化学式),电解结束后,电解液的pH(填“增大”、“减小”或“不变”)。(5)、在上述流程中,H2SeO3转化为Se的过程中,当生成23.7gSe时,理论上有标准状况下LSO2参与反应。(6)、“沉银”时转化成AgCl,该反应的平衡常数。[已知:常温下, , ]19. 氮的化合物在生产、生活中有广泛应用。(1)、已知几种共价键的键能数据如下表所示:共价键
键能/ kJ∙mol-1
391
160
945
498
467
根据表格数据,N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= kJ∙mol-1。
(2)、向一恒温恒容密闭容器中充入一定量N2O4和N2H4 , 发生反应: 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H<0。下列说法正确的是____(填标号)。A、当气体平均摩尔质量不随时间变化时,达到平衡状态 B、平衡后,充入惰性气体,平衡向右移动 C、上述反应的正反应活化能大于逆反应活化能(3)、工业上,采用NH3还原NO法消除NO污染。一定条件下,向一恒容密闭容器中充入NH3和NO,在不同催化剂Catl、Cat2、Cat3作用下发生反应: 4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H<0。测得相同时间内NO的转化率随温度的变化如图1所示。①a点时:v正(NO) (填“>”、“<”或“=”) v逆(NO)。
②bc段NO的转化率随温度升高而降低,可能的原因是。(任答一点)

 (4)、工业上用天然气处理NO2 , 消除NO2的污染。发生的反应为CH4(g)+2NO2(g)CO2(g)+2H2O(g)+N2(g)。在一定温度下,向一恒容密闭容器中充入1molCH4和2mol NO2 , 发生上述反应,起始时测得总压强为90kPa。N2的分压与时间的关系如图2所示。
(4)、工业上用天然气处理NO2 , 消除NO2的污染。发生的反应为CH4(g)+2NO2(g)CO2(g)+2H2O(g)+N2(g)。在一定温度下,向一恒容密闭容器中充入1molCH4和2mol NO2 , 发生上述反应,起始时测得总压强为90kPa。N2的分压与时间的关系如图2所示。①0~10min内NO2的分压变化速率为kPa∙min-1。
②该温度下,平衡常数Kp=kPa。(提示:用气体分压计算的平衡常数为Kp , 气体分压=总压×物质的量分数)
(5)、工业上制备HCN的反应为CH4(g)+NH3(g)HCN(g)+3H2(g) △H>0。速率方程为 , ( k正、k逆分别为正、逆反应速率常数,只与温度、催化剂有关)。①其他条件不变,反应达到平衡后,NH3的转化率随着条件X的增大而增大,则X可能是。(答一种即可)
②升高温度,k逆增大的倍数 k正增大的倍数(填“>”、“<”或“=”)
20. III是 是合成药物Tazverik的中间体,其合成路线如图所示:
是合成药物Tazverik的中间体,其合成路线如图所示:
回答下列问题:
(1)、I为苯的同系物,其化学名称为 , II中官能团包括硝基和。(2)、反应①的反应类型为。(3)、反应②的化学方程式为。(4)、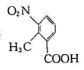 的同分异构体有很多,同时满足下列条件的同分异构体共有种(不考虑立体异构),其中苯环上仅有两种不同化学环境的氢原子的结构简式为。
的同分异构体有很多,同时满足下列条件的同分异构体共有种(不考虑立体异构),其中苯环上仅有两种不同化学环境的氢原子的结构简式为。i.属于芳香族化合物;苯环上连有两个取代基且其中一个为-NO2。
ii.能水解,且能发生银镜反应。
(5)、参照III的合成路线,设计以甲苯为原料(其他试剂任选),制备有机物 的合成路线(已知:苯环上带有甲基,再引人其他基团,主要进入它的邻位或对位;苯环上带有羧基,再引人其他基团,主要进入它的间位)。
的合成路线(已知:苯环上带有甲基,再引人其他基团,主要进入它的邻位或对位;苯环上带有羧基,再引人其他基团,主要进入它的间位)。