江苏省常熟市2022-2023学年高三上学期阶段性抽测一化学试题
试卷更新日期:2022-11-28 类型:期中考试
一、单选题
-
1. 油纸伞是国家级非物质文化遗产之一,《天工开物》中写道“凡糊雨伞与油扇,皆用小皮纸”,这里的皮纸主要是指桑皮和山桠皮。通常油纸伞的制作工艺主要经历备料、制伞骨架、制伞面、伞面绘图、装饰等几个步骤。下列有关说法中正确的是( )A、桑皮和山桠皮主要成分为蛋白质 B、桐油由桐树种子压榨而得,属于油脂 C、绘图颜料石绿——孔雀石主要成分碱式碳酸铜为复盐 D、桐油在空气中发生物理变化变稠变干
-
2. 和的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是( )A、与都能在水中与氨形成配合物 B、和的熔点都比的低 C、和均可表现出弱酸性 D、和的氢化物都不能在酸中稳定存在
-
3. 下列物质的性质与应用对应关系正确的是( )A、聚合硫酸铁能水解并形成胶体,可用于自来水的杀菌消毒 B、具有强氧化性,可用作呼吸面具供氧剂 C、氧化铝熔点很高,可用于制造耐火坩埚 D、硬度大,可用于制光导纤维
-
4. 短周期元素X、Y、Z、M的原子序数依次增大,他们组成一种团簇分子,结构如图所示。X、M的族序数等于周期数,Y是地壳中最丰富、分布最广的元素,Z原子最外层电子数为2。下列说法错误的是 ( )
 A、该团簇分子的分子式为 X2Z2M2Y6 B、简单离子半径:Y>M C、工业上常电解熔融的ZY制取Z单质 D、第一电离能: M<Z
A、该团簇分子的分子式为 X2Z2M2Y6 B、简单离子半径:Y>M C、工业上常电解熔融的ZY制取Z单质 D、第一电离能: M<Z -
5. 在指定条件下,下列选项所示的物质间的转化能够实现的是( )A、 B、 C、 D、
-
6. 下列实验装置(部分夹持装置略)或现象错误的是( )



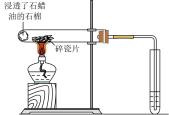
A.滴入酚酞溶液
B.吸氧腐蚀
C.钠的燃烧
D.石蜡油的热分解
A、A B、B C、C D、D -
7. 科学家发现某些生物酶体系可以促进和的转移(如a、b和c),能将海洋中的转化为进入大气层,反应过程如图所示。

下列说法正确的是( )
A、过程Ⅰ中发生氧化反应 B、a和b中转移的数目相等 C、过程Ⅱ中参与反应的 D、过程Ⅰ→Ⅲ的总反应为 -
8. 由含硒废料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)制取硒的流程如下:

下列有关说法正确的是( )
 A、“分离”的方法是蒸馏 B、“滤液”中主要存在的阴离子有:SO、SiO C、“酸化”时发生的离子反应方程式为SeSO+H2O=Se↓+SO2↑+2OH- D、SiO2晶胞如图所示,1个SiO2晶胞中有16个O原子
A、“分离”的方法是蒸馏 B、“滤液”中主要存在的阴离子有:SO、SiO C、“酸化”时发生的离子反应方程式为SeSO+H2O=Se↓+SO2↑+2OH- D、SiO2晶胞如图所示,1个SiO2晶胞中有16个O原子 -
9. 抗阿尔茨海默病药物多奈哌齐的部分合成路线如下:

下列说法正确的是( )
A、1mol化合物X中含有3mol碳氧π键 B、Y存在顺反异构体且所有碳原子一定共平面 C、Z既能与氢氧化钠溶液反应又能与盐酸反应 D、X、Y分别与足量酸性溶液反应所得芳香族化合物相同 -
10. 化合物可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在以下热分解时无刺激性气体逸出。下列叙述正确的是( )
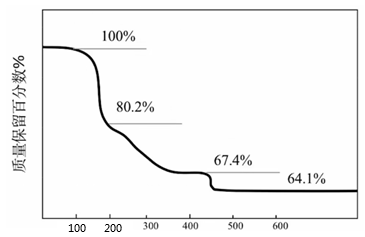 A、W、X、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物的酸性: C、阶段热分解失去4个 D、热分解后生成固体化合物
A、W、X、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物的酸性: C、阶段热分解失去4个 D、热分解后生成固体化合物 -
11. 电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电电池(如图所示)。光照时,光催化电极产生电子和空穴 , 驱动阴极反应和阳极反应(Li2O2+2h+=2Li++O2)对电池进行充电。下列叙述错误的是( )
 A、充电时,电池的总反应 B、充电效率与光照产生的电子和空穴量有关 C、放电时,Li+从正极穿过离子交换膜向负极迁移 D、放电时,正极发生反应
A、充电时,电池的总反应 B、充电效率与光照产生的电子和空穴量有关 C、放电时,Li+从正极穿过离子交换膜向负极迁移 D、放电时,正极发生反应 -
12. 由下列实验及现象推出的相应结论正确的是( )
选项
实验
现象
结论
A
向某食盐溶液中滴加淀粉溶液
溶液颜色不变
该食盐属于无碘盐
B
将某硝酸亚铁溶液用盐酸酸化,并滴加少量KSCN溶液
溶液变红
该硝酸亚铁溶液已变质
C
用热碳酸钠溶液清洗铁钉表面上油垢
油垢无明显变化
该油垢的主要成分不是动、植物油脂
D
将新制的氢氧化铜悬浊液与某饮品混合,加热
未出现砖红色沉淀
该饮品不含糖
A、A B、B C、C D、D -
13. NaClO溶液具有漂白能力,已知25℃时,。下列关于NaClO溶液说法正确的是( )A、溶液中, B、长期露置在空气中,释放 , 漂白能力减弱 C、通入过量 , 反应的离子方程式为 D、25℃,的NaClO和HClO的混合溶液中,
-
14. 以为原料炼铁,在生产过程中主要发生如下反应:
反应I:
反应II:
为研究温度对还原产物的影响,将一定体积CO气体通入装有粉末的反应器,保持其它条件不变,反应达平衡时,测得CO的体积分数随温度的变化关系如图所示。下列说法正确的是( )
 A、反应II的 B、其他条件不变,增大压强,的产量增大 C、反应温度越高,主要还原产物中铁元素的价态越低 D、温度高于1040℃时,反应管中发生的主要反应的化学平衡常数
A、反应II的 B、其他条件不变,增大压强,的产量增大 C、反应温度越高,主要还原产物中铁元素的价态越低 D、温度高于1040℃时,反应管中发生的主要反应的化学平衡常数
二、综合题
-
15. 一种主要成分为、、 , 还含有少量CaO、、等的SCR催化剂广泛应用于燃煤烟气的处理。从废SCR催化剂中回收钨的工艺如下:
 (1)、“酸浸还原”中转化成可溶于水的 , 该反应的化学方程式为。(2)、“碱浸”时转化为的离子方程式为。(3)、“滤渣”的主要成分是。(4)、常温下 , 。“沉钨”过程中不断加入石灰乳,当“滤液”的时,为。(5)、“熔融电解”过程中阴极反应为。电解过程中作阳极的石墨易消耗,原因是。
(1)、“酸浸还原”中转化成可溶于水的 , 该反应的化学方程式为。(2)、“碱浸”时转化为的离子方程式为。(3)、“滤渣”的主要成分是。(4)、常温下 , 。“沉钨”过程中不断加入石灰乳,当“滤液”的时,为。(5)、“熔融电解”过程中阴极反应为。电解过程中作阳极的石墨易消耗,原因是。 -
16. 化合物G为一种促进睡眠的药物,其部分合成路线如下:
 (1)、A能与以任意比水混溶,原因是。(2)、化合物G中碳原子的杂化方式有几种。(3)、由C和D转化为E的过程中,还生成2分子的甲醇,则化合物的结构简式为。(4)、F经水解并还原得到的一种产物为 , 写出满足下列条件的H的同分异构体的结构简式。
(1)、A能与以任意比水混溶,原因是。(2)、化合物G中碳原子的杂化方式有几种。(3)、由C和D转化为E的过程中,还生成2分子的甲醇,则化合物的结构简式为。(4)、F经水解并还原得到的一种产物为 , 写出满足下列条件的H的同分异构体的结构简式。①苯环上有4个取代基;②能发生银镜反应,存在4种不同化学环境的氢原子。
(5)、已知: 。写出以苯酚和碘甲烷为原料制备
。写出以苯酚和碘甲烷为原料制备 的合成路线流程图。(无机试剂任用,合成路线流程图见本题题干)
的合成路线流程图。(无机试剂任用,合成路线流程图见本题题干) -
17. 硫氰化钾(KSCN)是一种用途广泛的化学药品KSCN熔点为172℃,加热至430℃会发生变化,500℃时发生分解。实验室制备硫氰化钾的装置如图所示:

已知:I.不溶于 , 密度比水大且不溶于水;
II.三颈瓶内盛放:、水和催化剂;
III. , 该反应比较缓慢且在高于170℃时易分解。
(1)、制备KSCN溶液①A装置的作用是。
②实验过程中待观察到三颈烧瓶中出现现象时,关闭 , 保持三颈烧瓶内液温105℃一段时间,然后打开 , 继续保持液温105℃一段时间,缓缓滴入适量的KOH溶液,充分反应。打开 , 继续保持液温105℃一段时间的原因是。写出三颈烧瓶中生成KSCN的化学方程式。
③得到硫氰化钾晶体:、、、过滤,洗涤,减压干燥,得硫氰化钾晶体
(2)、性质探究在试管中依次加入1滴溶液、5mL饱和碘水、1滴溶液,tmin后加入1滴KSCN溶液,溶液变红。甲同学认为是氧化了 , 乙同学提出了质疑,认为实验现象不能证明氧化了 , 可能是氧化了。请设计实验方案验证乙同学的质疑。
(3)、上题中涉及的溶液是由溶于水得到,实验室常用标准溶液测定过二硫酸铵的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:)。取wg过二硫酸铵样品溶于蒸馏水配制成250mL溶液。准确量取20.00mL配制的溶液于锥形瓶中,用标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:实验序号
起始读数/mL
终点读数/mL
I
2.50
22.58
II
1.00
23.12
III
0.00
19.92
根据上述数据计算,样品的纯度为(用含w、c的代数式表示,可不化简)。
-
18. 钴()的常见化合价有+2、+3等,均容易形成相应配离子,如、。脱除烟气中NO的机理如下:
 (1)、I.活化氧气:在氨水中与氧气作用生成具有强氧化性的微粒X(其中Co的化合价为+3),X的结构如上图所示。
(1)、I.活化氧气:在氨水中与氧气作用生成具有强氧化性的微粒X(其中Co的化合价为+3),X的结构如上图所示。用“□”标识出X中体现强氧化性的基团:。
(2)、II.配位较钴的其它配位离子易吸收NO生成 , 将NO由气相转入液相。溶液的pH对NO的配位脱除率的影响如图所示。
图中时,NO脱除率较低,其原因可能是。
(3)、III.氧化吸收:被X氧化为 , 在氨水中生成硝酸铵和亚硝酸铵,达到脱除NO的效果。用活性炭作催化剂、水作还原剂可实现的再生,维持溶液脱除NO的能力,可能机理如图所示。

已知:活性炭表面既有大量的酸性基团,又有大量的碱性基团。溶液的pH对活性炭表面所带电荷有影响。时带负电荷,pH越高,表面所带负电荷越多;时带正电荷,pH越低,表面所带正电荷越多。
①由步骤(ii)可知活性炭表面有大量的(填“酸性”或“碱性”)基团。
②写出步骤(iii)的离子反应方程式:。
(4)、一定温度下,pH对再生反应的影响如图所示。
①当时,的转化率随pH的减小而降低的原因是。当时,的转化率随pH的增大而降低的原因是。
(5)、一定pH下,反应相同时间,的转化率随温度的升高而增大,可能的原因是。(至少答出2点)
