高中化学人教版(2019)必修第二册 第六章第二节 【化学反应的速率与限度】
试卷更新日期:2022-11-24 类型:同步测试
一、单选题
-
1. 在溶液中滴加5~6滴溶液充分反应后,再进行下列实验,其中可以证明溶液和溶液的反应有一定限度的是( )A、取反应后的溶液少许,再滴加溶液,观察是否有沉淀产生 B、加入振荡后静置,取出下层液体,观察下层液体颜色 C、加入振荡后静置,取出上层液体,滴加溶液观察是否变红 D、加入振荡后静置,取出上层液体,滴加溶液观察是否有白色沉淀2. 反应3H2(g)+N2(g)2NH3(g) ΔH<0,达到平衡后,将体系的温度降低,下列叙述中正确的是( )A、正反应速率增大,逆反应速率减小,平衡向正反应方向移动 B、正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 C、正反应速率和逆反应速率都减小,平衡向逆反应方向移动 D、正反应速率和逆反应速率都减小,平衡向正反应方向移动3. 下列说法不正确的是( )A、需要加热才能发生的反应可能是放热反应 B、任何吸热反应在常温条件下都不能发生 C、反应物和生成物所具有的总能量的相对大小决定了反应是放热还是吸热 D、可以利用物质的颜色变化和浓度变化间的比例关系来测量反应速率4. 已知反应2CO(g)+4H2(g)CH2=CH2(g)+2H2O(g)在不同条件下的反应速率如下,其中反应速率最快的是( )A、v(CO)=0.02 mol·L-1·s-1 B、v(H2)=0.03 mol·L-1·s-1 C、v(CH2=CH2)=0.4 mol·L-1·min-1 D、v(H2O)=0.5 mol·L-1·min-15. 在恒温恒容的密闭容器中充入和 , 发生反应 , 当反应进行到时,测得。则反应进行到时,容器中Y的物质的量是( )A、小于 B、大于 C、等于 D、无法确定6. 一定条件下,溶液的酸碱性对光催化染料R降解反应的影响如图所示。下列判断正确的是( )
 A、时,和条件下,R的降解百分率不相等 B、其他条件相同时,溶液酸性越强,R的降解速率越大 C、其他条件相同时,R的起始浓度越小,R的降解速率越大 D、在内,条件下,R的平均降解速率为7. 压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有H2S,直接使用会造成大气污染,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是( )
A、时,和条件下,R的降解百分率不相等 B、其他条件相同时,溶液酸性越强,R的降解速率越大 C、其他条件相同时,R的起始浓度越小,R的降解速率越大 D、在内,条件下,R的平均降解速率为7. 压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有H2S,直接使用会造成大气污染,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是( )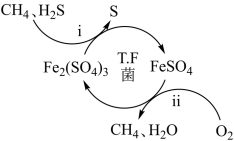 A、Fe2(SO4)3可以视为该脱硫过程中的催化剂 B、该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O C、该脱硫过程不能在高温下进行 D、该脱硫过程是将H2S转化为FeSO48. 利用太阳光在一种新型复合光催化剂表面实现高效分解水的主要过程如图所示。
A、Fe2(SO4)3可以视为该脱硫过程中的催化剂 B、该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O C、该脱硫过程不能在高温下进行 D、该脱硫过程是将H2S转化为FeSO48. 利用太阳光在一种新型复合光催化剂表面实现高效分解水的主要过程如图所示。
几种化学键的键能:
化学键
H-O
O=O
H-H
O-O
键能/()
463
496
436
138
下列说法错误的是( )
A、过程Ⅰ生成了·OH和·H B、过程Ⅱ中只有新化学键的生成 C、总反应的化学方程式为 D、若反应过程中有2 mol水分解,则过程Ⅲ放出132 kJ能量9. 已知反应X(g)+3Y(g)2Z(g) ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,10min后达到化学平衡,测得Y的物质的量为2.4 mol。下列说法正确的是( )A、10min内,Y的平均反应速率为0.03 mol·Lˉ1·sˉ1 B、第10min时,X的反应速率为0.01 mol·Lˉ1·minˉ1 C、10min内,消耗0.2 mol X,生成0.4 mol Z D、平衡后增大X的浓度,正反应速率增大,逆反应速率减小10. 已知反应式:mX(g)+nY(?) pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的1/2,c(X)=0.5mol/L,下列说法正确的是( )A、反应向逆方向移动 B、Y可能是固体或液体 C、系数n>m D、Z的体积分数减小11. 工业合成乙醇的反应:C2H4(g)+H2O(g) C2H5OH(g) ΔH<0,在催化剂、260-290℃。和约7MPa的条件下进行。下列说法错误的是( )A、循环使用乙烯是为了提高乙烯的利用率 B、原理分析表明合成时压强越大越好,但实际生产中还要考虑安全、成本等因素 C、其他条件不变时,投料比n(H2O)∶n(C2H4)越小,乙烯的平衡转化率越大 D、寻找高活性的催化剂是研究该反应的重要方向12. 800℃时,A、B、C三种气体在密闭容器中反应时浓度的变化如图所示。则以下说法错误的是( )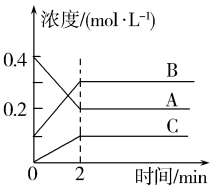 A、发生的反应可表示为 B、前 , A的分解速率为 C、时,A,B,C的浓度之比为2∶3∶1 D、通过调控反应条件,可以提高该反应进行的程度13. 合成氨原料气中的可通过水煤气变换反应除去。某合成氨原料气中、、、的体积分数分别为20%、50%、25%、5%。一定温度下按不同投料比通入水蒸气,平衡后混合气体中的体积分数如下表。
A、发生的反应可表示为 B、前 , A的分解速率为 C、时,A,B,C的浓度之比为2∶3∶1 D、通过调控反应条件,可以提高该反应进行的程度13. 合成氨原料气中的可通过水煤气变换反应除去。某合成氨原料气中、、、的体积分数分别为20%、50%、25%、5%。一定温度下按不同投料比通入水蒸气,平衡后混合气体中的体积分数如下表。投料比
的体积分数/%
温度/℃
200
1.70
0.21
0.02
250
2.73
0.30
0.06
300
6.00
0.84
0.43
350
7.85
1.52
0.80
下列说法不正确的是( )
A、从表中数据可知,水煤气变换反应的 B、温度相同时,投料比大,的转化率高 C、按=1通入水蒸气后,反应前在混合气体中的体积分数为20% D、根据=1时数据推算,300℃时水煤气变换反应的平衡常数K为4614. 对于可逆反应4NH3 + 5O2⇌4NO + 6H2O,下列叙述正确的是( )A、达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 B、保持容器内气体压强不变,向其中加入 , 化学反应速率不变 C、保持容器容积不变,向其中加入 , 化学反应速率增大 D、达到化学平衡时,4v正(O2)=5v逆(NO)15. 在两个恒温恒容密闭容器中平衡体系和的反应物平衡转化率分别为和 , 反应物的平衡浓度分别为和 , 在温度不变的情况下,均增加反应物的物质的量,下列叙述正确的是( )A、、均增大,、均增大 B、不变、增大,、均增大 C、不变、增大,不变、增大 D、减小,增大,增大,增大16. 工业上,可采用还原法处理尾气中NO,其原理:2NO(g)+2H2(g)N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2 , 在T℃下进行实验,测得有关数据如下:实验
c(NO)/mol·L-1
c(H2)/mol·L-1
v(正)/mol·L-1·min-1
①
0.10
0.10
0.414k
②
0.10
0.40
1.656k
③
0.20
0.10
1.656k
下列有关推断正确的是( )
A、上述反应中,正反应活化能大于逆反应活化能 B、若升高温度,则k(正)增大,k(逆)减小 C、在上述反应中,反应级数:m=2,n=1 D、在一定温度下,NO、H2的浓度对正反应速率影响程度相同17. 在一定温度下,改变起始时n(SO2)对反应2SO2(g)+O2(g) 2SO3(g) △H<0的影响如下左图所示,下列说法正确的是( )
2SO3(g) △H<0的影响如下左图所示,下列说法正确的是( ) 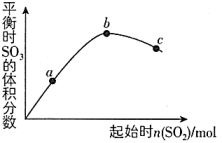 A、b、c点均为平衡点,a点未达平衡且向正反应方向进行 B、a、b、c三点中,a点时SO2的转化率最大 C、a、b、c点均为平衡点,b点时SO2的转化率最大 D、a、b、c三点的平衡常数:Kb>Kc>Ka18. 已知反应。一定条件下,在一密闭容器中加入和10倍量的充分反应,达到平衡后,下列化合物中含量最低的是( )A、 B、 C、 D、19. 下图为接触法制硫酸的示意图,已知 △H<0,下列说法正确的是( )
A、b、c点均为平衡点,a点未达平衡且向正反应方向进行 B、a、b、c三点中,a点时SO2的转化率最大 C、a、b、c点均为平衡点,b点时SO2的转化率最大 D、a、b、c三点的平衡常数:Kb>Kc>Ka18. 已知反应。一定条件下,在一密闭容器中加入和10倍量的充分反应,达到平衡后,下列化合物中含量最低的是( )A、 B、 C、 D、19. 下图为接触法制硫酸的示意图,已知 △H<0,下列说法正确的是( )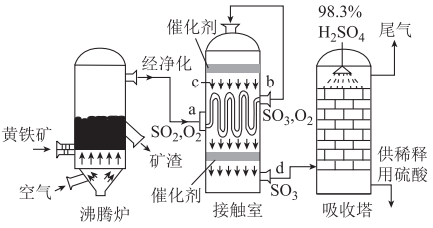 A、黄铁矿的主要成分是 , 沸腾炉中发生反应的化学方程式为 B、接触室的热交换器的作用是加热a处气体,冷却c处气体,控制气体接触催化剂时的温度 C、催化剂的目的是提高反应的平衡转化率 D、应将98.3%的浓硫酸换成蒸馏水,以便吸收更多的
A、黄铁矿的主要成分是 , 沸腾炉中发生反应的化学方程式为 B、接触室的热交换器的作用是加热a处气体,冷却c处气体,控制气体接触催化剂时的温度 C、催化剂的目的是提高反应的平衡转化率 D、应将98.3%的浓硫酸换成蒸馏水,以便吸收更多的二、综合题
-
20. 氢气是一种理想的新能源,发展氢能汽车的关键是氢气的制备及储存技术。制备氢气通常有下列方法:①电解水制氢:2H2O2H2↑+O2↑;②高温使水分解制氢:2H2O2H2↑+O2↑;③太阳能催化分解水制氢:2H2O2H2↑+O2↑;④天然气氧:CH4+H2OCO+3H2。(1)、你认为最节能的方法是(填序号)。(2)、反应①和氢气在氧气中燃烧生成水的反应是否互为可逆反应?(选填“是”或“否”)。(3)、请依据表中常见物质的键能(在25℃,101kPa下)回答问题:
化学键
H—H
H—O
I—I
H—I
O=O
键能kJ·mol-1
435
460
150
300
500
①由氢气与氧气生成18g水放出的热量为kJ。
②若将1molI2和1molH2置于密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25℃,101kPa)远小于15kJ,你认为最可能的原因是。
三、实验探究题
-
21. 某化学小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率,所用试剂为10mL0.1mol•L-1KClO3溶液和10mL0.3mol•L-1NaHSO3溶液,所得溶液中c(Cl-)随时间变化的曲线如图所示。
 (1)、该反应的离子方程式是。(2)、根据实验数据可知,该反应在0~4min内的平均反应速率v(Cl-)=。(3)、某同学仔细分析实验数据后发现,在反应过程中,该反应的反应速率先增大后减小。该同学设计如表实验方案,进一步探究反应速率先增大的原因。
(1)、该反应的离子方程式是。(2)、根据实验数据可知,该反应在0~4min内的平均反应速率v(Cl-)=。(3)、某同学仔细分析实验数据后发现,在反应过程中,该反应的反应速率先增大后减小。该同学设计如表实验方案,进一步探究反应速率先增大的原因。方案
假设
实验操作
I
, 反应速率加快
向烧杯中加入10mL0.1mol•L-1KClO3溶液和10mL0.3mol•L-1NaHSO3溶液,插入温度计
II
生成的Cl-对反应有催化作用,加快了反应速率
取10mL0.1mol•L-1KClO3溶液于烧杯中,先加入少量 固体,再加入10mL0.3mol•L-1NaHSO3溶液
III
反应中溶液酸性增强,加快了反应速率
分别向a、b两个烧杯中加入10mL0.1mol•L-1KClO3溶液;向烧杯a中加入1mL蒸馏水,向烧杯b中加入1mL0.2mol•L-1盐酸;再分别向两个烧杯中加入10mL0.3mol•L-1NaHSO3溶液
①补全方案I中的假设:。
②方案II中加入的固体为(填化学式)。
③除I、II、III中的假设外,还可以提出的假设是。
④某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:。
(4)、试分析反应后期化学反应速率减小的原因:。22. 研究性学习小组对某工厂排出的烟道气(主要成分为NO、NO2、N2、粉尘和少量水蒸气)进行处理,实验装置如图: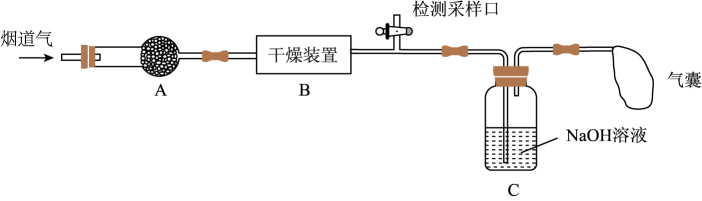
已知:NO、NO2能与NaOH溶液发生如下反应:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+ NaNO3+H2O;但NO不能单独与NaOH溶液反应。
(1)、实验时在装置A的干燥管中放置一团棉花,吸收粉尘。装置B的干燥装置中应盛放的试剂为(填字母)。a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4•5H2O)
(2)、气体在被装置C中的NaOH溶液吸收前,需在检测采样口测定气体中NO和NO2的含量。为确保NO和NO2气体能够被NaOH溶液完全吸收,则需控制参加反应的NO和NO2物质的量比值为(填字母)。a.≥1 b.=1 c.≤1
(3)、若进入装置C的气体中NO和NO2物质的量比值不符合(2)中要求,则气囊中除含有N2外,可能含有少量NO气体。甲同学设计了喷淋吸收塔装置(如图所示),用NaClO溶液来进一步处理NO气体。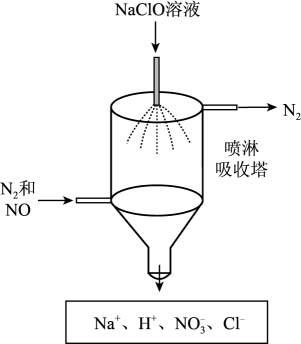
①NaClO溶液吸收NO时发生反应的离子方程式为。
②该装置的优点是。
(4)、装置C的吸收液中NO、NO直接排放也会造成水体污染。乙同学设计了以下实验将溶液中、NO转化为N2 , 实现氮的脱除,具体步骤如下:①向装置C的吸收液中加入适量H2O2溶液,充分反应后,蒸发浓缩,得到c(NO)为0.1000mol·L-1的溶液甲。写出H2O2溶液将吸收液中的NO氧化为NO的离子方程式:。
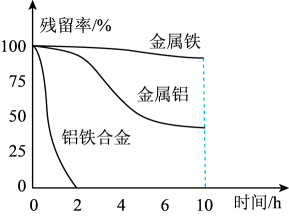
②量取三份50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中将溶液甲中的NO还原为N2 , 从而实现脱氮,溶液中NO的残留率(残留率=×100%)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是。
-