高中化学人教版(2019)必修第二册 第五章第三节 【无机非金属材料】
试卷更新日期:2022-11-24 类型:同步测试
一、单选题
-
1. 、在元素周期表中处于相邻位置,其单质及化合物在生产生活中应用广泛。下列有关说法正确的是( )A、铝单质性质活泼,所以铝制品在空气中极易被腐蚀 B、可发生碱式电离得到少量而呈弱碱性,可用作胃酸中和剂 C、为酸性氧化物,可用溶液除去中的 D、硅、铝都处于元素周期表中金属-非金属分界线附近,所以它们单质的导电性都介于导体和绝缘体之间,常用于制造半导体芯片2. 下面几种物品的主要成分不属于有机物的是( )
A
B
C
D




粮食酿酒使用的缸
新疆棉制品衬衫
冰糖
“飞扬”火炬中的聚硅氮烷树脂
A、A B、B C、C D、D3. 材料与化学密切相关。下列物质与材料对应关系错误的是( )A、晶体硅——集成电路 B、氧化铝——耐火材料 C、铁碳合金——碳素钢 D、石灰石——普通玻璃4. 陶瓷版“冰墩墩”和“雪容融”均产自中国陶瓷之乡,下列说法错误的是( ) A、陶瓷、玻璃和水泥均属于无机非金属材料 B、陶瓷版“冰墩墩”上黑色涂料的主要成分为Fe2O3 C、高温结构陶瓷具有耐高温、耐氧化、耐磨蚀等优良性能 D、陶瓷是以黏土及天然矿物岩为原料,经加工烧制而成5. 下列有关物质的性质与应用相对应的是( )A、BaCO3能与盐酸反应,可用于治疗胃酸过多 B、SiC硬度很大,可用作砂轮、砂纸的磨料 C、铵盐都能与碱发生反应,可用作化肥 D、次氯酸见光易分解,可用作棉、麻和纸张的漂白剂6. 2022北京冬奥会圆满落幕,下列相关报道缺乏科学性的是( )A、火炬“飞扬”采用氢气作为燃料,并利用焰色反应原理给火焰“着色” B、吉祥物“冰墩墩”外壳是透明硅胶材质,其化学式为mSiO2·nH2O C、速滑馆采取了CO2跨临界直冷制冰,主要利用了CO2的化学性质 D、冬奥场馆大面积使用碲化镉发电玻璃,该玻璃应用了光电池原理7. 甲、乙、丙、丁四种物质发生如图所示的转化:
A、陶瓷、玻璃和水泥均属于无机非金属材料 B、陶瓷版“冰墩墩”上黑色涂料的主要成分为Fe2O3 C、高温结构陶瓷具有耐高温、耐氧化、耐磨蚀等优良性能 D、陶瓷是以黏土及天然矿物岩为原料,经加工烧制而成5. 下列有关物质的性质与应用相对应的是( )A、BaCO3能与盐酸反应,可用于治疗胃酸过多 B、SiC硬度很大,可用作砂轮、砂纸的磨料 C、铵盐都能与碱发生反应,可用作化肥 D、次氯酸见光易分解,可用作棉、麻和纸张的漂白剂6. 2022北京冬奥会圆满落幕,下列相关报道缺乏科学性的是( )A、火炬“飞扬”采用氢气作为燃料,并利用焰色反应原理给火焰“着色” B、吉祥物“冰墩墩”外壳是透明硅胶材质,其化学式为mSiO2·nH2O C、速滑馆采取了CO2跨临界直冷制冰,主要利用了CO2的化学性质 D、冬奥场馆大面积使用碲化镉发电玻璃,该玻璃应用了光电池原理7. 甲、乙、丙、丁四种物质发生如图所示的转化: (反应条件略去,箭头表示一步转化)。下列不满足转化关系的是( )
(反应条件略去,箭头表示一步转化)。下列不满足转化关系的是( )选项
甲
乙
丙
丁
A
Al
B
HCl
C
Si
D
A、A B、B C、C D、D8. 下列说法正确的是( )A、普通硅酸盐水泥以黏土和石灰石为主要原料,还需加入适量石膏以调节水泥凝结时间 B、纯铝导电性好,强度高,硬度大,广泛用于生产门窗、飞机、电子元件等 C、硫黄、胆矾都可用于生产硫酸,石膏、重晶石则不用于生产硫酸 D、工业制备硝酸时在吸收塔中使用浓硝酸吸收二氧化氮9. 下列关于物质用途的叙述中,不正确的是( )A、钾钠合金呈液态,可做快中子反应堆的导热剂 B、硅酸钠俗称“水玻璃”,是制造水泥的原料 C、硅是太阳能电池的常用材料 D、氧化镁的熔点高达2800℃,是优质的耐高温材料10. 下列说法正确的是( )A、硅酸不溶于水,因此不与NaOH溶液反应 B、据SiO2+CaCO3CaSiO3+CO2↑的反应,可推知硅酸酸性比碳酸酸性强 C、硅太阳能电池、石英光导纤维和计算机芯片所用的材料都是Si D、普通玻璃是以纯碱、石灰石和石英为原料经高温烧结而制成的11. 下列说法错误的是( )A、制备氢氧化铁胶体的方法是将饱和氯化铁溶液与氢氧化钠溶液混合 B、普通玻璃与钢化玻璃主要成分相同,都为Na2SiO3、CaSiO3和SiO2 C、正常雨水由于溶解了二氧化碳,其pH约为5.6,而酸雨的pH小于5.6 D、不锈钢是最常见的一种合金钢,它的合金元素主要是铬和镍12. 二氧化硅是一种化工原料,可以制备一系列物质。下列说法正确的是( ) A、图中所有反应都不属于氧化还原反应 B、硅酸盐的化学性质稳定,常用于制造光导纤维 C、可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙 D、普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高13. 高纯硅广泛应用于信息技术和新能源技术等领域。一种高纯硅的制备工艺流程如下,下列说法正确的是( )
A、图中所有反应都不属于氧化还原反应 B、硅酸盐的化学性质稳定,常用于制造光导纤维 C、可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙 D、普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高13. 高纯硅广泛应用于信息技术和新能源技术等领域。一种高纯硅的制备工艺流程如下,下列说法正确的是( ) A、石英砂的主要成分是硅酸盐 B、加入焦炭发生的化学方程式为: C、高纯硅的制备发生的反应是 D、二氧化硅是酸性氧化物,能与水反应生成硅酸14. 纯二氧化硅可用下列流程制得。下列说法错误的是( )
A、石英砂的主要成分是硅酸盐 B、加入焦炭发生的化学方程式为: C、高纯硅的制备发生的反应是 D、二氧化硅是酸性氧化物,能与水反应生成硅酸14. 纯二氧化硅可用下列流程制得。下列说法错误的是( ) A、X可用作木材防火剂 B、步骤Ⅱ的反应是Na2SiO3+H2SO4=H2SiO3↓+Na2SO4 C、步骤Ⅱ中的Y生成可用SiO2与水反应代替 D、步骤 Ⅲ若在实验室完成,一般在坩埚中进行15. 下列元素化合物的转化关系中,可以实现的是( )A、KCl(溶液) B、 C、 D、16. 纳米材料是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。将纳米材料分散到液体分散剂中,所得混合物可能具有的性质是( )A、能全部透过半透膜 B、有丁达尔效应 C、所得液体不可以全部透过滤纸 D、所得物质一定是溶液17. 下列关于纳米材料的叙述中正确的是( )A、包括纳米颗粒和颗粒间界面两部分 B、纳米材料属于晶体 C、纳米材料属于非晶体 D、同一种金属元素组成的纳米材料与宏观金属晶体具有完全等同的性质
A、X可用作木材防火剂 B、步骤Ⅱ的反应是Na2SiO3+H2SO4=H2SiO3↓+Na2SO4 C、步骤Ⅱ中的Y生成可用SiO2与水反应代替 D、步骤 Ⅲ若在实验室完成,一般在坩埚中进行15. 下列元素化合物的转化关系中,可以实现的是( )A、KCl(溶液) B、 C、 D、16. 纳米材料是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。将纳米材料分散到液体分散剂中,所得混合物可能具有的性质是( )A、能全部透过半透膜 B、有丁达尔效应 C、所得液体不可以全部透过滤纸 D、所得物质一定是溶液17. 下列关于纳米材料的叙述中正确的是( )A、包括纳米颗粒和颗粒间界面两部分 B、纳米材料属于晶体 C、纳米材料属于非晶体 D、同一种金属元素组成的纳米材料与宏观金属晶体具有完全等同的性质二、综合题
-
18. 实验室加热液体时,常加入沸石、其主要成分为 , 根据其组成元素完成下列填空:(1)、指出元素在周期表中的位置。(2)、沸石中的元素可形成多种化合物;元素与原子半径最小的元素组成化合物甲,常作强还原剂,化合物甲的电子式为;化合物乙可作为呼吸面具或潜艇氧气的来源,乙是(填化学式),化合物乙中存在的化学键类型为。(3)、O元素和其同周期相邻的两种元素分别形成的简单氢化物中最稳定的是(填化学式)。(4)、已知硅酸(H2SiO3)为白色胶状沉淀。
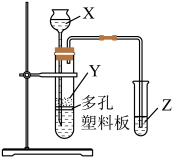
实验室中现有药品:①稀盐酸、②稀硫酸、③NaHCO3固体、④CaCO3固体、⑤Na2SiO3溶液,请选择合适药品利用上述装置设计实验验证C、Si的非金属性的变化规律;装置X、Y、Z处所盛装或放置的药品分别为、、(填序号)。但有同学认为该实验所得现象无法充分证明C、Si的非金属性强弱,如何改进?。
(5)、Uue是暂时未合成的化学元素,与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则中A=、Z=。三、实验探究题
-
19.
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HClSiHCl3+H2
③SiHCl3与过量H2在1100℃反应制得纯硅,已知SiHCl3能与H2O强烈反应,在空气中易自燃.
请回答下列问题:
(1)、第①步制备粗硅的化学反应方程式为(2)、粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点﹣84.7℃),提纯SiHCl3采用的方法为(3)、用SiHCl3与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):
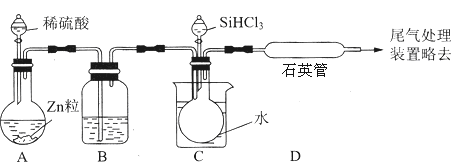
①装置B中的试剂是 .装置C中的烧瓶需要加热,其目的是 .
②反应一段时间后,装置D中观察到的现象是 ,装置D中发生反应的化学方程式为 .
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是 .
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液.
20. 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。(1)、Ⅰ.将大小、形状相同的钠、钾、镁、铝各0.01mol分别投入足量的0.1mol·L-1的盐酸中,写出与盐酸反应最快的金属发生反应的离子方程式:。(2)、将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理? (填“合理”或“不合理”),说明理由:。(3)、Ⅱ.利用如图所示装置可以验证非金属性的变化规律。
实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2 , 选择合适药品设计实验验证氯的非金属性大于硫:装置B中所装药品为 ,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为。
(4)、若要证明非金属性:C>Si,则A中加.B中加Na2CO3 , C中加Na2SiO3溶液,观察到C中的实验现象为有白色沉淀物生成,C中发生反应的离子方程式为(假设所通气体是过量的)。21. 工业上可用焦炭与石英砂(主要成分是)的混合物在高温条件下与氯气反应生成 , 如图装置可用于实验室制备。已知的沸点为55℃,且极易与水发生反应。
请回答:
(1)、请补充完整装置A中发生反应的化学方程式:①、②。(2)、装置C的仪器名称是 , 装置C的作用是。(3)、装置D中吸收气体一段时间后,吸收液中肯定含有 , , , 还可能含有其他阴离子。某化学兴趣小组设计实验以检验该吸收液中可能还存在的某些其他阴离子(忽略空气中的影响)。【提出假设】假设1:有;假设2:有;假设3:……
【设计方案】取少量吸收液于试管中,滴加稀硫酸至溶液略呈酸性,然后进行如下实验:
Ⅰ、向吸收液中滴加淀粉KI溶液,若溶液变为 , 可验证假设1成立。
Ⅱ、向吸收液中(简述实验操作和实验现象),可验证假设2成立。
-