高中化学人教版(2019)必修第二册 第五章第二节 【氮及其化合物】
试卷更新日期:2022-11-24 类型:同步测试
一、单选题
-
1. 2019年,我国青年化学家雷晓光被遴选为“青年化学家元素周期表”氮元素的代言人。下列与氮元素有关的说法正确的是( )A、14N与14C互为同位素 B、NH3的热稳定性比HF的强 C、NH3的电子数为10 D、Si3N4中N为+3价2. 下列几种装置中,能用于制取氨气的是( )A、
 B、
B、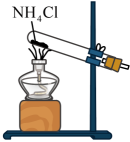 C、
C、 D、
D、 3. 反应中,氧化产物与还原产物的物质的量之比为( )A、2:3 B、3:2 C、3:4 D、8:34. 下列有关一些物质的性质说法正确的是( )A、能使鲜艳的红花褪色,说明具有漂白性 B、加热条件下浓能溶解金属铜,说明其具有强酸性 C、常温下浓能使金属铝钝化,可以用铝槽车运输浓 D、金属钠保存在煤油中,实验剩余的金属钠不能放回原瓶5. 从高温热浪到暴雨洪水,近年来全球多地频频遭遇罕见极端天气,造成重大损失。加强气候适应、应对气象灾害成为人类社会需要共同研究的重要课题。下列有关说法正确的是( )A、氮氧化物、硫氧化物的排放会导致酸雨(即pH<7的雨水)的形成 B、燃煤中加入石灰石,可以减少SO2、CO2等污染环境的气体排放 C、汽车使用的燃油质量越高,排放的汽车尾气中NO、NO2的含量越少 D、大力发展太阳能、风能、核能等,有助于改善空气质量6. 氮气及其重要化合物的转化关系如如图,则下列说法正确的是( )
3. 反应中,氧化产物与还原产物的物质的量之比为( )A、2:3 B、3:2 C、3:4 D、8:34. 下列有关一些物质的性质说法正确的是( )A、能使鲜艳的红花褪色,说明具有漂白性 B、加热条件下浓能溶解金属铜,说明其具有强酸性 C、常温下浓能使金属铝钝化,可以用铝槽车运输浓 D、金属钠保存在煤油中,实验剩余的金属钠不能放回原瓶5. 从高温热浪到暴雨洪水,近年来全球多地频频遭遇罕见极端天气,造成重大损失。加强气候适应、应对气象灾害成为人类社会需要共同研究的重要课题。下列有关说法正确的是( )A、氮氧化物、硫氧化物的排放会导致酸雨(即pH<7的雨水)的形成 B、燃煤中加入石灰石,可以减少SO2、CO2等污染环境的气体排放 C、汽车使用的燃油质量越高,排放的汽车尾气中NO、NO2的含量越少 D、大力发展太阳能、风能、核能等,有助于改善空气质量6. 氮气及其重要化合物的转化关系如如图,则下列说法正确的是( ) A、路线Ⅰ、Ⅱ、Ⅲ是工业生产硝酸的主要途径 B、反应①②③均需要使用催化剂 C、路线Ⅲ的另一种反应物为水时,每1mol反应,转移电子数目为NA D、已知某条件下 , 该条件下每合成1molNH3放出的热量为46.2kJ7. 如图A~D四种物质均含有同一种元素,A可以是单质也可以是气态氢化物,D是该元素最高价氧化物对应的水化物,则A,B,C,D中共同含有的元素可能是( )
A、路线Ⅰ、Ⅱ、Ⅲ是工业生产硝酸的主要途径 B、反应①②③均需要使用催化剂 C、路线Ⅲ的另一种反应物为水时,每1mol反应,转移电子数目为NA D、已知某条件下 , 该条件下每合成1molNH3放出的热量为46.2kJ7. 如图A~D四种物质均含有同一种元素,A可以是单质也可以是气态氢化物,D是该元素最高价氧化物对应的水化物,则A,B,C,D中共同含有的元素可能是( ) A、氯 B、铁 C、碳 D、氮8. 利用氮元素价类二维图可以从不同角度研究含氨物质的性质及其转化关系。下列说法错误的是( )
A、氯 B、铁 C、碳 D、氮8. 利用氮元素价类二维图可以从不同角度研究含氨物质的性质及其转化关系。下列说法错误的是( ) A、通过转化①②③可实现工业制硝酸 B、自然界可实现上述转化④ C、实验室可用与共热制取 D、预测与可以反应生成9. 室温下,1体积水能溶解约700体积的NH3。将向下排空气法收集NH3后的试管倒扣在水槽里的水中,观察。对该实验现象的分析正确的是( )
A、通过转化①②③可实现工业制硝酸 B、自然界可实现上述转化④ C、实验室可用与共热制取 D、预测与可以反应生成9. 室温下,1体积水能溶解约700体积的NH3。将向下排空气法收集NH3后的试管倒扣在水槽里的水中,观察。对该实验现象的分析正确的是( ) A、试管内液面上升,证明NH3与H2O发生了反应 B、试管中剩余少量气体,是因为NH3在水中的溶解达到了饱和 C、取试管中少量无色液体于另一试管中,向其中加入酚酞溶液,溶液显红色,原因是:NH3 + H2ONH3·H2ONH+ OH- D、将实验后试管中溶液敞口放置在空气中一段时间,pH会降低,主要是由于NH3被空气中的O2氧化10. 实验室制取氨气并验证其化学性质和用途,图中装置对应的说法正确的是( )
A、试管内液面上升,证明NH3与H2O发生了反应 B、试管中剩余少量气体,是因为NH3在水中的溶解达到了饱和 C、取试管中少量无色液体于另一试管中,向其中加入酚酞溶液,溶液显红色,原因是:NH3 + H2ONH3·H2ONH+ OH- D、将实验后试管中溶液敞口放置在空气中一段时间,pH会降低,主要是由于NH3被空气中的O2氧化10. 实验室制取氨气并验证其化学性质和用途,图中装置对应的说法正确的是( )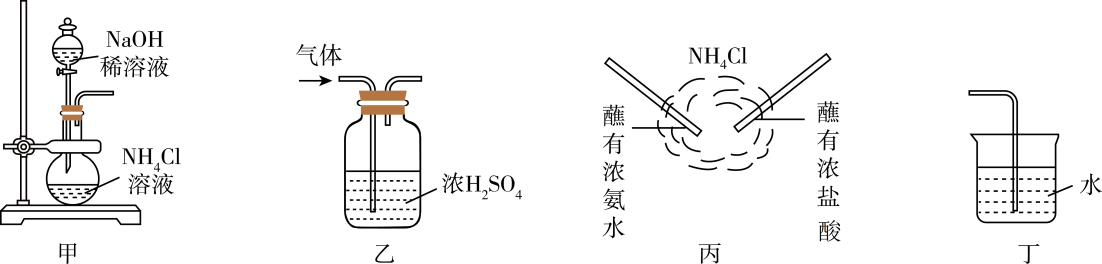 A、可利用装置甲制取大量氨气 B、可利用装置乙干燥氨气 C、根据装置丙的原理和现象,可用浓氨水检验氯气管道是否漏气 D、利用装置丁可吸收氨气并防倒吸11. 对溶液中的离子进行鉴定,下列实验所得结论不合理的是( )A、向溶液中加入盐酸,产生使澄清石灰水变浑浊的无色气体,则溶液中可能含有 B、向溶液中加入稀硝酸后,再加入溶液有白色沉淀生成,则溶液中一定含有 C、加入溶液有白色沉淀产生,再加盐酸,沉淀不溶解,原溶液中一定含有 D、向溶液中加入溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推该溶液中一定含有12. 下列有关物质的性质与用途具有对应关系的是( )A、铵盐都能与碱发生反应,可用作化肥 B、Al2O3具有两性,可用于电解冶炼铝 C、稀硫酸具有酸性,可用于除去铁锈 D、次氯酸见光易分解,可用作棉、麻和纸张的漂白剂13. 下列关于物质保存的解释,反应方程式不正确的是( )A、溶液中放入铁粉: B、浓硝酸保存于棕色试剂瓶: C、氮肥保存于阴凉处: D、金属钠保存于煤油中:14. 亚硝酸钠又称为“工业盐”,在新闻报道中常出现因误食工业盐而导致中毒的事件,下列关于亚硝酸钠的叙述不正确的是( )A、亚硝酸钠外观与食盐相似 B、亚硝酸钠和食盐一样也具有咸味 C、食盐可用作食品的添加剂而亚硝酸钠绝对不可用作食品添加剂 D、亚硝酸钠溶液和食盐溶液中滴加硝酸银溶液均可产生白色沉淀15. 对人体健康不会造成危害的是( )A、用工业盐(NaNO2)作咸味调味品 B、用富尔马林(35%~40%甲醛水溶液)浸泡海产品,防腐保鲜 C、食盐中加入一定量的碘酸钾(KIO3)制食用含碘盐 D、将含有甲醇(CH3OH)的工业酒精兑制成饮用白酒16. 氮及其化合物的“价—类”二维图如图所示,下列有关说法错误的是( )
A、可利用装置甲制取大量氨气 B、可利用装置乙干燥氨气 C、根据装置丙的原理和现象,可用浓氨水检验氯气管道是否漏气 D、利用装置丁可吸收氨气并防倒吸11. 对溶液中的离子进行鉴定,下列实验所得结论不合理的是( )A、向溶液中加入盐酸,产生使澄清石灰水变浑浊的无色气体,则溶液中可能含有 B、向溶液中加入稀硝酸后,再加入溶液有白色沉淀生成,则溶液中一定含有 C、加入溶液有白色沉淀产生,再加盐酸,沉淀不溶解,原溶液中一定含有 D、向溶液中加入溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推该溶液中一定含有12. 下列有关物质的性质与用途具有对应关系的是( )A、铵盐都能与碱发生反应,可用作化肥 B、Al2O3具有两性,可用于电解冶炼铝 C、稀硫酸具有酸性,可用于除去铁锈 D、次氯酸见光易分解,可用作棉、麻和纸张的漂白剂13. 下列关于物质保存的解释,反应方程式不正确的是( )A、溶液中放入铁粉: B、浓硝酸保存于棕色试剂瓶: C、氮肥保存于阴凉处: D、金属钠保存于煤油中:14. 亚硝酸钠又称为“工业盐”,在新闻报道中常出现因误食工业盐而导致中毒的事件,下列关于亚硝酸钠的叙述不正确的是( )A、亚硝酸钠外观与食盐相似 B、亚硝酸钠和食盐一样也具有咸味 C、食盐可用作食品的添加剂而亚硝酸钠绝对不可用作食品添加剂 D、亚硝酸钠溶液和食盐溶液中滴加硝酸银溶液均可产生白色沉淀15. 对人体健康不会造成危害的是( )A、用工业盐(NaNO2)作咸味调味品 B、用富尔马林(35%~40%甲醛水溶液)浸泡海产品,防腐保鲜 C、食盐中加入一定量的碘酸钾(KIO3)制食用含碘盐 D、将含有甲醇(CH3OH)的工业酒精兑制成饮用白酒16. 氮及其化合物的“价—类”二维图如图所示,下列有关说法错误的是( )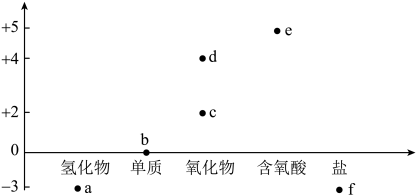 A、常温下,a、c、d均为刺激性气味的气体 B、由b生成a或c的过程均属于氮的固定 C、实验室e的浓溶液需保存在棕色试剂瓶中 D、f的氯化物与的反应为吸热反应
A、常温下,a、c、d均为刺激性气味的气体 B、由b生成a或c的过程均属于氮的固定 C、实验室e的浓溶液需保存在棕色试剂瓶中 D、f的氯化物与的反应为吸热反应二、实验探究题
-
17. 同学们欲验证与的转化,在实验室中进行了如下图所示的实验。(夹持仪器已省略)
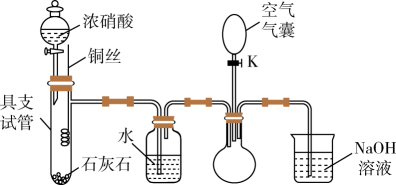 (1)、关闭开关K,打开分液漏斗活塞,向石灰石中滴加浓硝酸,此操作的目的是。(2)、待石灰石反应停止后,将铜丝插入过量浓硝酸中,铜丝与浓硝酸反应的离子方程式是 , 插入铜丝后在具支试管中溶液上方观察到的现象是。(3)、广口瓶中水的作用是 , 有关反应的化学方程式是。(4)、欲证明圆底烧瓶中收集到的无色气体是 , 应进行的操作是 , 观察到的现象是。18. 如图为铜与稀硝酸反应的有关性质实验(洗耳球:一种橡胶为材质的工具仪器,可挤压)。
(1)、关闭开关K,打开分液漏斗活塞,向石灰石中滴加浓硝酸,此操作的目的是。(2)、待石灰石反应停止后,将铜丝插入过量浓硝酸中,铜丝与浓硝酸反应的离子方程式是 , 插入铜丝后在具支试管中溶液上方观察到的现象是。(3)、广口瓶中水的作用是 , 有关反应的化学方程式是。(4)、欲证明圆底烧瓶中收集到的无色气体是 , 应进行的操作是 , 观察到的现象是。18. 如图为铜与稀硝酸反应的有关性质实验(洗耳球:一种橡胶为材质的工具仪器,可挤压)。
实验步骤如下:
①按照如图装置连接好仪器,关闭所有止水夹。检查装置的气密性。
②在装置A中的烧杯中加入30%的氢氧化钠溶液。在装置C的U型管中加入4.0mol·L-1的硝酸,排除U型管左端管内空气。
③塞紧连接铜丝的胶塞,打开止水夹K1 , 反应进行一段时间。
④进行适当的操作,使装置C中产生的气体进入装置B的广口瓶中,气体变为红棕色。气体进入烧杯中与氢氧化钠溶液反应。
回答下列问题:
(1)、装置C中发生反应的离子方程式为。反应后的溶液呈蓝色,其原因是铜离子和水分子形成了水合铜离子,1mol水合铜离子中含有σ键数目为12NA , 该水合铜离子的化学式为。(2)、装置A上面的导管口末端也可以连接来代替干燥管,实现同样作用。(3)、加入稀硝酸,排除U型管左端管内空气的操作是。(4)、步骤④中“使装置C中产生的气体进入装置B的广口瓶中”的操作是打开止水夹(填写序号),并用洗耳球在U型管右端导管口挤压空气进入。(5)、步骤④中使“气体进入烧杯中与氢氧化钠溶液反应”的操作是 , 尾气中主要含有NO2和空气,与NaOH溶液反应只生成一种盐,则离子方程式为有。(6)、某同学发现,本实验结束后硝酸还有很多剩余,请你改进实验,使能达到预期实验目的,反应结束后硝酸的剩余量尽可能较少,你的改进是。19. 为探究溶液对氮氧化物的处理效果,进行如下实验:
已知:具有强氧化性,且氧化性随着溶液的酸性增强而增强。和反应的化学方程式为:。对氮氧化物具有强吸收效果。
(1)、“制气”阶段生成和。“制气”反应的化学方程式为。(2)、可以将氧化为 , 并进一步氧化为 , 则被还原为。吸收时,溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图所示)。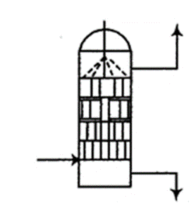
①和反应的离子方程式为。
②吸收器内装填碎瓷片填料的目的是(填字母)。
A.增大氮氧化物的吸收速率 B.防止氮氧化物气体外逸
(3)、通过加入盐酸或调节溶液的 , 测得不同的溶液对吸收率的影响如图所示。
①当小于7时,吸收率随增大而减小的原因是。
②当大于7时,吸收率随增大而增大的原因是。
20. 氮氧化物(NOx)是大气污染物之一,处理工业废气中的NOx对于环境保护具有重要的意义。(1)、在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
①用装置A制备NH3 , 其中发生反应的化学方程式为;装置B内的试剂是。
②装置D中发生反应的离子方程式是 , 铜丝可抽动的优点是。
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为。
(2)、用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知过程中发生的反应有:2NaOH+NO+NO2=2NaNO2+H2O;2NaOH+2NO2=NaNO3+NaNO2+H2O①用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图:

(α表示NOx中NO2的含量):
用NaOH溶液吸收氮氧化物的最佳条件为:α= , c(NaOH)=。
②若一定体积的NOx被250mL2mol·L-1的NaOH溶液恰好完全吸收,溶液质量增加19.8g,则x的值为。