江西省宜春市丰城市2022-2023学年高二上学期期中考试化学试题
试卷更新日期:2022-11-22 类型:期中考试
一、单选题
-
1. 已知下列反应的平衡常数:① , ;② , ;则反应的平衡常数是( )A、 B、 C、 D、2. 半导体工业用石英砂作原料通过三个重要反应生产单质硅:
(s,石英砂)(s,粗硅)
Si(s,粗硅)
(s,纯硅)
用石英砂生产1.00kg纯硅放出的热量为( )
A、21.44kJ B、21435.71kJ C、600.20kJ D、1965.10kJ3. 室温下,H2B的电离平衡常数Ka1=5.9×10-2 , Ka2=6.4×10-5 , 用0.1000 mol/LNaOH溶液滴定20.00 mL0.1000 mol/LH2B溶液的曲线如图所示 (体积变化忽略不计)。下列说法正确的是( ) A、滴定过程中,当pH=4时,存在c(H+)+c(Na+)=c(OH-)+c(B2-)+c(HB-) B、点①、③、④所示溶液中,点④所示溶液水的电离程度最大 C、在整个滴定过程中,c(Na+)+c(B2-)+c(HB-)+c(H2B)保持不变 D、滴定过程中可能出现:c(Na+)>c(B2-)=c(HB-)>c(OH-)>c(H+)4. 常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
A、滴定过程中,当pH=4时,存在c(H+)+c(Na+)=c(OH-)+c(B2-)+c(HB-) B、点①、③、④所示溶液中,点④所示溶液水的电离程度最大 C、在整个滴定过程中,c(Na+)+c(B2-)+c(HB-)+c(H2B)保持不变 D、滴定过程中可能出现:c(Na+)>c(B2-)=c(HB-)>c(OH-)>c(H+)4. 常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( ) A、H2A为二元弱酸,稀释前c(H2A)=0.005 mol·L-1 B、NaHA水溶液中:c(Na+)+ c(H+)=2c(A2-)+c(OH-) C、含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)= c(A2-)+c(B2-)+c(HB-) D、pH=10的NaHB溶液中,离子浓度大小:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H2B)5. 25℃时,下列有关叙述正确的是( )A、饱和氯水中滴加NaOH至溶液呈中性:c(Na+)=2c(ClO-)+c(HClO) B、若HA的Ka=1.7×10-5 , BOH的Kb=1.7×10-5 , 则HA溶液中的c(H+)与BOH中的c(OH-)相等 C、向10mLpH=12的NaOH溶液中滴加pH=2的HA溶液至中性:则混合液体积V(总)≥20mL D、在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-8mol/L6. 下列叙述错误的是( )A、若反应CN-+HF=HCN+F-可以发生,则可判断Ka(HF)>Ka(HCN) B、加水稀释0.1 mol/LCH3COOH溶液,溶液的值增大 C、相同物质的量浓度的①CH3COONH4②NH4Fe(SO4)2③(NH4)2SO4④(NH4)2CO3四种溶液中c():③>④>①>② D、常温下,pH=3的HNO3和pH=12的Ba(OH)2溶液按体积比为9:1混合,所得混合液pH=107. 下列说法错误的是( )A、25℃时,AgCl(s)在等浓度的CaCl2和FeCl3溶液中的溶解度不同 B、升高温度,可提高活化分子百分数,使有效碰撞几率提高,化学反应速率加快 C、活化分子之间发生的碰撞一定为有效碰撞 D、洗发时使用护发素,其主要功能是调节头发的pH使之达到适宜的酸碱度8. 在一定温度下、容积不变的密闭容器中,可逆反应达到平衡状态的标志是( )
A、H2A为二元弱酸,稀释前c(H2A)=0.005 mol·L-1 B、NaHA水溶液中:c(Na+)+ c(H+)=2c(A2-)+c(OH-) C、含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)= c(A2-)+c(B2-)+c(HB-) D、pH=10的NaHB溶液中,离子浓度大小:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H2B)5. 25℃时,下列有关叙述正确的是( )A、饱和氯水中滴加NaOH至溶液呈中性:c(Na+)=2c(ClO-)+c(HClO) B、若HA的Ka=1.7×10-5 , BOH的Kb=1.7×10-5 , 则HA溶液中的c(H+)与BOH中的c(OH-)相等 C、向10mLpH=12的NaOH溶液中滴加pH=2的HA溶液至中性:则混合液体积V(总)≥20mL D、在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-8mol/L6. 下列叙述错误的是( )A、若反应CN-+HF=HCN+F-可以发生,则可判断Ka(HF)>Ka(HCN) B、加水稀释0.1 mol/LCH3COOH溶液,溶液的值增大 C、相同物质的量浓度的①CH3COONH4②NH4Fe(SO4)2③(NH4)2SO4④(NH4)2CO3四种溶液中c():③>④>①>② D、常温下,pH=3的HNO3和pH=12的Ba(OH)2溶液按体积比为9:1混合,所得混合液pH=107. 下列说法错误的是( )A、25℃时,AgCl(s)在等浓度的CaCl2和FeCl3溶液中的溶解度不同 B、升高温度,可提高活化分子百分数,使有效碰撞几率提高,化学反应速率加快 C、活化分子之间发生的碰撞一定为有效碰撞 D、洗发时使用护发素,其主要功能是调节头发的pH使之达到适宜的酸碱度8. 在一定温度下、容积不变的密闭容器中,可逆反应达到平衡状态的标志是( )①C的生成速率与C的消耗速率相等
②单位时间内生成 , 同时生成
③A、B、C的浓度不再改变
④混合气体的密度不再改变
⑤混合气体的总压强不再改变
⑥混合气体的总物质的量不再改变
⑦A,B、C的浓度之比为1:3:2
A、③④⑤⑥⑦ B、①③④⑤⑥ C、①②③④⑦ D、②③④⑤⑥9. 常温下,向20mL0.2mol·L-1的H2B溶液中滴加0.2mol·L-1的NaOH溶液过程中,有关微粒的物质的量变化如图所示,下列说法错误的是( ) A、I表示H2B,Ⅱ代表HB-、Ⅲ代表B2- B、当c(Na+)=2c(B2-)+c(HB-)时,溶液呈中性 C、初始时H2B第一级电离的电离度为90% D、V(NaOH)=20mL时:c(Na+)>c(HB-)>c(B2-)>c(H2B)10. 常温下,分别向10 mL 0.1 mol∙L−1的NaOH 溶液中逐滴加入0.1 mol∙L−1的一元酸HA和HB溶液,用pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )
A、I表示H2B,Ⅱ代表HB-、Ⅲ代表B2- B、当c(Na+)=2c(B2-)+c(HB-)时,溶液呈中性 C、初始时H2B第一级电离的电离度为90% D、V(NaOH)=20mL时:c(Na+)>c(HB-)>c(B2-)>c(H2B)10. 常温下,分别向10 mL 0.1 mol∙L−1的NaOH 溶液中逐滴加入0.1 mol∙L−1的一元酸HA和HB溶液,用pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( ) A、HA的酸性强于HB的酸性 B、V(酸)=10mL时,两份溶液中c(B−)=c(A−) C、a 点时,c(A−)>c(Na+)>c(OH−)>c(H+) D、b、c点时,c(A−)+c(HA)=2c(Na+)=c(HB)+c(B−)
A、HA的酸性强于HB的酸性 B、V(酸)=10mL时,两份溶液中c(B−)=c(A−) C、a 点时,c(A−)>c(Na+)>c(OH−)>c(H+) D、b、c点时,c(A−)+c(HA)=2c(Na+)=c(HB)+c(B−)二、多选题
-
11. 下列描述错误的是( )A、往溶液中加水,增大 B、在滴有酚酞的溶液中慢慢滴入溶液至过量,溶液的红色褪去 C、相同的①、②、③三种溶液中:①>②>③ D、在水电离出的的溶液中,一定不可能大量存在12. 马来酸(用H2B表示)是一种二元弱酸,25℃时,某混合溶液中c(H2B) +c(HB-) +c(B2-) = 0.1mol·L-1 , 测得H2B、HB-、B2-及OH-等离子的pC(pC=-lgc)随溶液pH的变化关系如图所示。下列说法正确的是( )
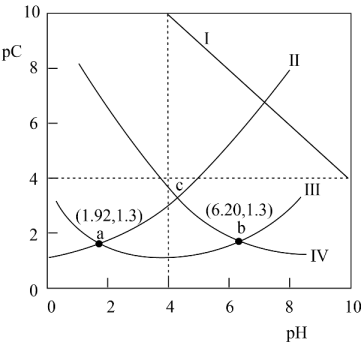 A、该温度下,马来酸的电离平衡常数Ka1 =10-1.92 B、当溶液中=2时,pH=3.15 C、pH=7时,溶液中c(B2-)>c(H2B) >c(HB- ) >c(OH - ) D、混合溶液中c(HB-) =13. 将电催化转化成燃料和化学品具有重要意义。甲酸可以作为氢载体直接用于甲酸燃料电池。某科学家在常温下用催化剂电催化还原制甲酸的机理如图1所示,反应历程如图2所示,其中吸附在催化剂表面的物种用标注。下列说法错误的是( )
A、该温度下,马来酸的电离平衡常数Ka1 =10-1.92 B、当溶液中=2时,pH=3.15 C、pH=7时,溶液中c(B2-)>c(H2B) >c(HB- ) >c(OH - ) D、混合溶液中c(HB-) =13. 将电催化转化成燃料和化学品具有重要意义。甲酸可以作为氢载体直接用于甲酸燃料电池。某科学家在常温下用催化剂电催化还原制甲酸的机理如图1所示,反应历程如图2所示,其中吸附在催化剂表面的物种用标注。下列说法错误的是( )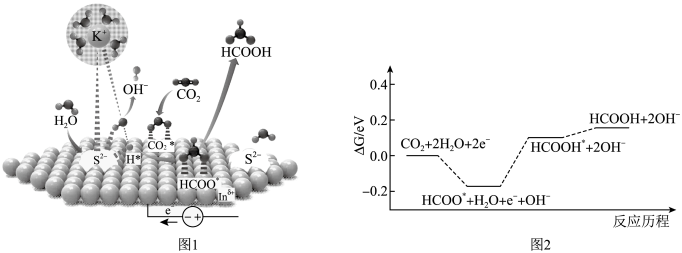 A、使用催化剂能够降低反应的活化能 B、催化剂活性位点在催化过程中的作用是活化水分子 C、制甲酸过程的决速步骤为 D、电催化还原 , 制甲酸总反应的14. 下列实验操作、现象和结论均正确的是( )
A、使用催化剂能够降低反应的活化能 B、催化剂活性位点在催化过程中的作用是活化水分子 C、制甲酸过程的决速步骤为 D、电催化还原 , 制甲酸总反应的14. 下列实验操作、现象和结论均正确的是( )选项
操作
现象
结论
A
两块相同的未经打磨的铝片,相同温度下分别投入5.0mL等浓度的溶液和溶液中
前者无明显现象,后者剧烈反应
能加速破坏铝片表面的氧化膜
B
向溶液中加入足量NaCl后再加入少量NaI溶液
白色沉淀转化为淡黄色沉淀
C
取少量溶液于试管中,先加入KSCN溶液,再滴加过量酸性高锰酸钾溶液
溶液变红色
溶液中含Fe2+
D
向铜与浓硫酸反应后的溶液中加入适量水稀释
溶液呈蓝色
溶液中存在
A、A B、B C、C D、D三、填空题
-
15. 乙酸、碳酸、次氯酸、亚磷酸(H3PO3)在生产、生活及医药方面有广泛用途。(1)、Ⅰ.已知25℃时,部分物质的电离常数如下表所示。
弱酸
CH3COOH
H2CO3
HClO
电离常数
根据表中数据,将pH=3的下列三种酸溶液分别稀释100倍,pH变化最小的是(填标号)。
a.CH3COOH b.H2CO3 c.HClO
(2)、常温下相同浓度的下列溶液:①CH3COONH4②CH3COONa ③CH3COOH,其中c(CH3COO-)由大到小的顺序是(填标号)。(3)、常温下,pH=10的CH3COONa溶液中,由水电离出来的c(OH-)=mol/L;请设计实验,比较常温下0.1 mol/L CH3COONa溶液的水解程度和0.1 mol/L CH3COOH溶液的电离程度大小:(简述实验步骤和结论)。(4)、Ⅱ.常温下,已知溶液中含磷微粒的浓度之和为0.1 mol/L,溶液中各含磷微粒的关系如图所示。
已知: , ;x、z两点的坐标为x(7.3,1.3)、z(12.6,1.3)。
H3PO3与足量的NaOH溶液反应的离子方程式为。
(5)、表示随pOH变化的曲线是。(填“①”、“②”或“③”)。(6)、常温下,NaH2PO3溶液中的(填“<”“≥”或“=”)。16. 按要求填空:(1)、25℃时,pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则H2SO4溶液与NaOH溶液的体积比为。(2)、已知:常温下各物质的电离平衡常数见下表化学式
电离平衡常数
①25℃时,等浓度的a.NaCN溶液b.NaHCO3溶液c.CH3COONa溶液,三种溶液的pH由大到小的顺序为(填溶液前序号)
②pH相同的NaCN溶液与CH3COOK溶液相比,c(Na+)-c(CN-)c(K+)-c(CH3COO-)(填“>”、“<”或“=”)
(3)、室温下,若将0.1mol/L盐酸滴入20mL0.1mol/L氨水中,溶液pH随加入盐酸体积的变化曲线如图所示。
①b点所示溶液中的溶质是。
②若用0.1mol/L盐酸滴定未知浓度的氨水,下列操作会导致测定结果偏高的是。
A.酸式滴定管在装液前未用标准盐酸溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现有气泡
D.达到滴定终点时,仰视读数
(4)、写出将少量CO2通入NaCN溶液中的离子方程式。请用具体数据解释NaHCO3溶液显碱性的原因。17. 超纯氢氟酸主要用作芯片材料清洗和蚀刻。回答下列问题:(1)、氢氟酸可保存在聚四氟乙烯容器中,聚四氟乙烯的结构简式为。(2)、工业氢氟酸生产超纯氢氟酸时,需经除杂质(AsF3)、气化、洗涤等步骤。①除去AsF3的反应为4AsF3+4KMnO4=4MnO4+2As2O5+4KF+3O2↑,该反应的氧化产物为。
②CoF3可与H2O反应生成HF,该反应的化学方程式为(CoF3还原为CoF2)
③在无水氟化氢汽化时,可向发生装置中掺入含有F2 , NF3和OF2中的一种或多种的含氟气体,以氧化杂质。NF3的电子式为;OF2中氧元素的化合价为 , OF2可由F2与稀NaOH溶液反应制取,该反应的离子方程式为。
18. 熔融的金属锡(熔点231℃)在300℃左右能直接与氯气作用生成无水四氯化锡:Sn+2Cl2SnCl4。纯SnCl4是无色液体(沸点114℃),在空气中极易水解生成SnO2•xH2O。某化学小组利用如图装置制备SnCl4 , 并对其性质进行探究。
回答下列问题:
(1)、装置A中烧瓶内反应的离子方程式为;仪器①中导管的作用是。(2)、B、C、F、G盛装的试剂应依次选用下列中的(填标号)。a.浓H2SO4 b.饱和NaHCO3溶液 c.饱和NaCl溶液 d.NaOH浓溶液
(3)、取少量Sn片切成丝状,放入D装置反应器②中。冷阱③和小烧杯⑤内都装入冷水,按图将仪器连接好后,再一次检验整个装置,确证系统不漏气。先打开恒压滴液漏斗活塞使反应发生,排尽装置中的空气后,再加热D装置中试管②使Sn丝熔化,并与Cl2发生反应。能说明装置中的空气被排尽的现象是;生成的SnCl4经冷凝后,收集于E装置的试管④中,该液体常常呈黄绿色,原因是。(4)、用玻璃棒蘸取少量产物SnCl4 , 放置在空气中,片刻即产生白色烟雾,产物为SnO2•xH2O和(填化学式)。(5)、0.500gSn完全反应,制得SnCl41.03g,产率为。19. 亚硝酰氯(NOCl)是有机物合成中的重要试剂,其熔点为 , 沸点为 , 具有刺鼻恶臭味,遇水水解生成。现利用和NO制备NOCl并测定其纯度,制备装置如图:
已知:①NO不能溶于NaOH溶液,微溶于水,能溶于硝酸。
②为砖红色固体; ,
(1)、为了使气体充分反应,从X处进入的气体是。装置A、B除可干燥气体外,另一个作用是。(2)、装置连接的顺序为:a→→→→→(按气流方向,用小写字母表示)。(3)、装置E中高锰酸钾的作用是。装置F的烧杯中盛放的试剂是。(填编号)a.水 b.冰盐水 c.冰水
(4)、取F中所得液体mg溶于水配成250mL溶液,取出25.00mL,以溶液为指示剂,用足量硝酸酸化的标准溶液滴定至终点,平均消耗标准溶液的体积为20.00mL。①滴定终点的现象为。
②亚硝酰氯(NOCl)的质量分数为(用含m、c的代数式表示)。
20. 对学科核心概念的理解是学科素养要求之一,按照要求回答问题:(1)、下列变化属于吸热反应的是。①液态水汽化②将胆矾加热变为白色粉末③浓硫酸稀释④煅烧石灰石⑤HCl在水中的电离
(2)、在25℃、101kPa下,1g中醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为。(3)、铁、铜、铝是生活中使用广泛的金属,FcCl3溶液常用于腐蚀印刷电路铜板,若将此反应设计成原电池,则负极所用电极材料为 , 正极反应式为。(4)、室温下,有物质的量浓度相等的四种溶液:①NH4NO3②CH3COONH4③NH4HSO4④(NH4)2SO4 , 其中所含的c()由大到小的顺序是。(5)、科学家设计了用图装置电解氯化氢回收氯气新的工艺方案,主要包括电化学过程和化学过程。则M为电源的极(填“正”或“负”);阳极区的电极反应式为。