河南省许平汝联盟2022-2023学年高二上学期期中联考化学试题
试卷更新日期:2022-11-22 类型:期中考试
一、单选题
-
1. 化学与生活息息相关,下列说法正确的是( )A、废弃铅蓄电池须作深埋处理 B、黄铜(铜锌合金)制作的铜锣不易产生铜绿 C、太阳能电池板可将电能转化为化学能 D、用天然气(CH4)代替煤气(H2、CO等)作为燃料,若保持进气口不变,则应调小进风口2. 下列物质溶于水中,溶质不存在电离平衡的是( )A、HF B、CO2 C、Na2SO4 D、NaHCO33. 常温下,某溶液中由水电离出的c(OH-)=1×10-10mol/L,该溶液不可能是( )A、醋酸 B、氨水 C、盐酸 D、NaCl溶液4. 一定温度下,向容积恒定的密闭容器中加入一定量的A,发生反应A(s)2B(g)+C(g),下列叙述能表明该反应已达到平衡状态的是( )A、v正(C)=2v逆(B) B、B的物质的量分数不变 C、容器内气体的压强不变 D、混合气体的平均相对分子质量不变5. 在菠菜等植物中含有丰富的草酸,草酸对生命活动有重要影响。下列有关说法正确的是( )A、草酸的电离方程式为H2C2O42H++C2O B、0.1mol/L草酸溶液中:c(H2C2O4)>c(HC2O)>c(C2O) C、常温下,将草酸溶液加水稀释,溶液中所有离子的浓度均减小 D、要使H2C2O4的电离程度增大,可采取的措施是加入少量草酸晶体6. 如图表示25℃时,0.1mol/L稀氨水加水稀释过程中某物理量随加水量的变化情况,则图中纵坐标y可以是( )
 A、NH3•H2O的电离平衡常数 B、NH3•H2O的电离程度 C、溶液的pH D、7. 全固态锂电池能量密度大,安全性高,拓宽了电池工作温度范围和应用领域。一种全固态锂—空气电池设计如图,电池总反应为:O2+2Li=Li2O2。下列说法正确的是( )
A、NH3•H2O的电离平衡常数 B、NH3•H2O的电离程度 C、溶液的pH D、7. 全固态锂电池能量密度大,安全性高,拓宽了电池工作温度范围和应用领域。一种全固态锂—空气电池设计如图,电池总反应为:O2+2Li=Li2O2。下列说法正确的是( )
(注:复合电极包含石墨、催化剂及放电时生成的Li2O2)
A、放电时,外电路电流的方向是由Li电极流向复合电极 B、充电时,Li电极应与电源的正极相连 C、充电时,阳极的电极反应为:Li2O2-2e-=O2+2Li+ D、放电时,如果电路中转移1mol电子,理论上复合电极净增重7g8. 某研究小组向锥形瓶内加入混合均匀的新制铁粉和碳粉,塞紧瓶塞,从胶头滴管中滴入醋酸溶液,同时测量锥形瓶内压强的变化,如图所示。下列说法正确的是( ) A、0—t1内,压强增大的原因是铁发生了吸氧腐蚀 B、碳粉表面的电极反应式只有:2H++2e-=H2↑ C、整个过程中铁粉发生了氧化反应 D、若将铁粉换为铜粉,锥形瓶内的压强变化仍为如图9. 下列叙述中错误的是( )A、常温下,2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应△H一定大于0 B、常温下,Fe3+(aq)+3SCN-(aq)Fe(SCN)3(aq)达到平衡后,加水稀释至原溶液体积的2倍,平衡逆向移动 C、CO、O2与人体血液中的血红蛋白(Hb)建立如下平衡:CO+HbO2HbCO+O2 , 当CO中毒时,应将中毒患者转移至高压氧仓吸氧 D、硫酸工业生产中,2SO2(g)+O2(g)2SO3(g)在高温、高压条件下进行10. 在一定温度下,向一体积固定为2L的密闭容器中通入1molA和3molB发生反应:A(g)+3B(g)C(g)+D(g),5min后反应达到平衡,A的转化率为20%。下列说法正确的是( )A、0~5min内,B的平均反应速率为0.02mol•L-1•min-1 B、该温度下反应平衡常数的值为 C、达到平衡后,向该容器内再通入1molA和3molB,A的转化率大于20% D、若平衡后升温,K减小,则该反应△H>011. 已知碳的燃烧热为393.5kJ•mol-1 , 氢气的燃烧热为285.8kJ•mol-1 , 一氧化碳的燃烧热为283.0kJ•mol-1。某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧更旺。下列有关说法正确的是( )A、氢气燃烧热的热化学方程式为H2(g)+O2(g)=H2O(g) △H=285.8kJ•mol-1 B、反应C(s)+O2(g)=CO(g)的△H<-393.5kJ•mol-1 C、“煤炭燃烧得更旺”是因为少量固体碳与水反应生成了可燃性气体 D、C(s)+H2O(g)=CO(g)+H2(g) △H=175.3kJ•mol-1
A、0—t1内,压强增大的原因是铁发生了吸氧腐蚀 B、碳粉表面的电极反应式只有:2H++2e-=H2↑ C、整个过程中铁粉发生了氧化反应 D、若将铁粉换为铜粉,锥形瓶内的压强变化仍为如图9. 下列叙述中错误的是( )A、常温下,2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应△H一定大于0 B、常温下,Fe3+(aq)+3SCN-(aq)Fe(SCN)3(aq)达到平衡后,加水稀释至原溶液体积的2倍,平衡逆向移动 C、CO、O2与人体血液中的血红蛋白(Hb)建立如下平衡:CO+HbO2HbCO+O2 , 当CO中毒时,应将中毒患者转移至高压氧仓吸氧 D、硫酸工业生产中,2SO2(g)+O2(g)2SO3(g)在高温、高压条件下进行10. 在一定温度下,向一体积固定为2L的密闭容器中通入1molA和3molB发生反应:A(g)+3B(g)C(g)+D(g),5min后反应达到平衡,A的转化率为20%。下列说法正确的是( )A、0~5min内,B的平均反应速率为0.02mol•L-1•min-1 B、该温度下反应平衡常数的值为 C、达到平衡后,向该容器内再通入1molA和3molB,A的转化率大于20% D、若平衡后升温,K减小,则该反应△H>011. 已知碳的燃烧热为393.5kJ•mol-1 , 氢气的燃烧热为285.8kJ•mol-1 , 一氧化碳的燃烧热为283.0kJ•mol-1。某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧更旺。下列有关说法正确的是( )A、氢气燃烧热的热化学方程式为H2(g)+O2(g)=H2O(g) △H=285.8kJ•mol-1 B、反应C(s)+O2(g)=CO(g)的△H<-393.5kJ•mol-1 C、“煤炭燃烧得更旺”是因为少量固体碳与水反应生成了可燃性气体 D、C(s)+H2O(g)=CO(g)+H2(g) △H=175.3kJ•mol-1二、多选题
-
12. 用如图所示装置(X、Y是直流电源的两极)分别进行下列各组实验,则表中各项所列对应关系均正确的是( )

选项
X极
实验前U形管中液体
通电后现象及结论
A
正极
CuCl2溶液
b管中有气体逸出
B
负极
H2SO4溶液
溶液pH降低
C
正极
NaCl溶液
U形管两端滴入酚酞后,b管中溶液呈红色
D
负极
AgNO3溶液
a管中电极反应式是2H2O-4e-=O2↑+4H+
A、A B、B C、C D、D13. 向一容积不变的密闭容器中充人一定量A和B,发生如下反应:xA(g)+2B(s)yC(g) △H<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。下列有关说法错误的是( )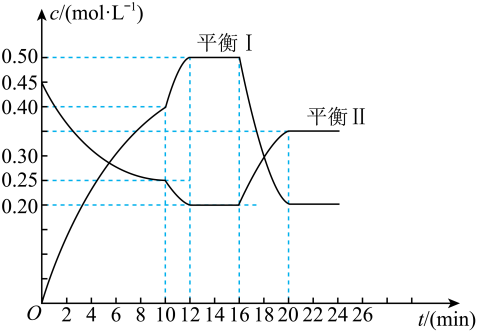 A、用A的浓度变化表示该反应在0~10min内的平均反应速率为0.02mol•L-1•min-1 B、x:y=1:2 C、第10min引起曲线变化的反应条件可能是降温 D、若平衡I的平衡常数为K1 , 平衡II的平衡常数为K2 , 则K1<K2
A、用A的浓度变化表示该反应在0~10min内的平均反应速率为0.02mol•L-1•min-1 B、x:y=1:2 C、第10min引起曲线变化的反应条件可能是降温 D、若平衡I的平衡常数为K1 , 平衡II的平衡常数为K2 , 则K1<K2三、填空题
-
14. 工业上利用CO2和H2合成甲醇,既能减少温室气体排放,又能合成重要工业燃料。发生的反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H。其它条件不变时,反应相同时间CO2的转化率随温度T的变化情况如图所示。

回答下面问题:
(1)、x点的v(正)v(逆)(填“大于”“小于”或“等于”,下同),x点的v(正)y点的v(逆),△H0。(2)、在某体积不变的绝热刚性容器中发生上述反应,下列说法正确的是____。A、混合气体的密度不再发生变化时反应达到化学平衡状态 B、混合气体的浓度商Qc逐渐增大,最后不再变化时,Qc=Kc C、该反应的化学反应速率随着反应的进行不断加快 D、达到平衡后升高温度,气体压强增大,化学平衡可能正向移动(3)、在一定温度和压强下,若原料气中的CO2和H2的物质的量之比=M,如图是M与CH3OH平衡百分含量(a%)的关系。
①M1=。
②在平衡状态x点时,CO2的平衡转化率为%。
③在平衡状态y点时,用百分含量表示的平衡常数K=。
(4)、在合成甲醇的反应中同时存在:CO2(g)+H2(g)CO(g)+H2O(g) △H>0,为了提高CH3OH的选择性,可以采取的措施是、(写出两点)。在某密闭容器中通入1molCO2和3molH2 , 在催化剂作用下,同时发生:①CO2(g)+3H2(g)CH3OH(g)+H2O(g)和②CO2(g)+H2(g)CO(g)+H2O(g),达到平衡后,测得n(CH3OH)=0.3mol,n(CO)=0.1mol,则反应②的化学平衡常数是(保留三位小数)。15. 酸、碱、盐的水溶液在生产生活及化学实验中有广泛的应用,请同学们运用所学知识解决下列问题。(1)、某温度T下,0.1mol/L的NaOH溶液中,c(H+)=1.0×10-11mol/L,此时水的离子积常数Kw=。温度T25℃(填“大于”“小于”或“等于”),原因是。由水电离的c(OH-)=mol/L。(2)、已知水溶液中c(H+)和c(OH-)的关系如图所示:
①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是。
②若A点到E点,可采用的措施是(填序号,下同);从A点到C点,可采用的措施是;促进水的电离平衡的措施是。
a.升温 b.加入少量的盐酸 c.加入少量的NaOH
(3)、常温下0.1mol/L的HA溶液中,c(H+)=0.001mol/L,写出HA的电离方程式 , 水电离的c(H+)=mol/L。为使HA溶液中HA和H2O的电离平衡正向移动,而水的Kw保持不变可以采取的措施是。四、计算题
-
16. 下列物质中:①CH3COOH②NH3③NH4Cl④盐酸⑤NaOH⑥NaHCO3溶液。(1)、属于弱电解质的是(填序号,下同),属于强电解质且其水溶液呈碱性的是。(2)、在氨水中存在电离平衡:NH3•H2ONH+OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH)增大的是(填序号),此时c(OH-)(填“增大”“减小”或“不变”,下同),=。(3)、等体积c(H+)相同的盐酸和醋酸分别与0.1mol•L-1的NaOH溶液恰好完全反应,消耗NaOH体积较大的是(填化学式),反应过程中醋酸的电离程度(填“增大”“减小”或“不变”,下同),n(CH3COO-) , 水的电离程度逐渐 , 水电离的c(H+)=。(4)、已知次氯酸(HClO)的电离平衡常数为Ka=4.0×10-8 , 向20mL0.1mol•L-1的HClO溶液中滴加少量硫酸,再加水稀释至40mL,此时测得c(H+)=0.05mol•L-1 , 则溶液中c(ClO-)=mol•L-1。(5)、已知亚硫酸(H2SO3)的电离平衡常数为Ka1=1.6×10-2 , Ka2=1.0×10-7;碳酸(H2CO3)的电离平衡常数为Ka1=4.0×10-7 , Ka2=4.0×10-11。足量的H2SO3溶液和NaHCO3溶液发生反应的主要离子方程式为。
五、综合题
-
17. 高锰酸钾(KMnO4)和双氧水(H2O2)都是常见的消毒试剂,在日常生活和工业生产中都有广泛的应用。回答下面问题:(1)、酸性高锰酸钾与双氧水混合有气体产生,经检验产生的气体为氧气。写出反应的离子方程式。(2)、H2O2是一种二元弱酸,与NaOH反应的化学方程式为NaOH+H2O=NaHO2+H2O,写出H2O2电离的方程式(只写第一步)。在酸性条件下H2O2的分解速度变大,利用平衡移动的原理进行解释:。(3)、现有H2O2-Al燃料电池电解尿素[CO(NH2)2]制备氢气的装置,b、c、d为石墨电极,电解池中的隔膜只阻止气体通过,如图:

①a电极是Al,写出电极反应 , 反应后b电极区溶液的pH(填“增大”“减小”或“不变”)。
②c电极是(填“正极”“负极”“阴极”或“阳极”),d电极的电极反应为。
(4)、某化学兴趣小组为了探究KMnO4与H2O2氧化性强弱,设计了如图实验装置:
①当闭合电键K时,电流表指针向左偏转,甲烧杯中溶液颜色逐渐变浅,则石墨电极a上发生反应(填“氧化”或“还原”),石墨电极b上发生的电极反应为。
②反应一段时间后,向甲烧杯中滴加KOH溶液,同时向乙烧杯中滴加硫酸溶液,发现电流表指针逐渐翻转,最后向右偏转,说明KMnO4与H2O2氧化性与有关。
-