浙江省温州新力量联盟2022-2023学年高二 上学期期中联考化学试题
试卷更新日期:2022-11-22 类型:期中考试
一、单选题
-
1. 自发过程:在一定的条件下,不需要外力就可以自动进行的过程。在常温常压下,下列诗句反映的景象与自发过程不一致的一项是( )A、云开雾散旭风暖 B、飞流直下三千尺 C、雪消门外千山绿 D、欲渡黄河冰塞川2. 下列物质的水溶液因水解而呈碱性的是( )A、NaOH B、(NH4)2SO4 C、NaCl D、Na2CO33. 下列说法正确的是( )A、C(石墨,s)=C(金刚石,s) ∆H>0,说明反应物总键能大于生成物总键能 B、需要高温条件才能发生的反应一定是吸热反应 C、已知稀溶液中, , 则稀硫酸与氢氧化钡稀溶液反应生成1mol水时放出57.3kJ的热量 D、增大压强,加快反应速率,是因为提高了单位体积内活化分子百分比4. 中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法错误的是( )
 A、通过该催化反应,实现了太阳能向化学能的转化 B、反应Ⅰ中涉及到O-H键的断裂和H-H、O-O键的形成 C、反应Ⅱ为2H2O22H2O+O2↑ D、光催化剂明显降低了2H2O22H2O+O2↑的反应热5. 下列说法正确的是( )A、的溶液一定是碱性溶液 B、内能是指体系内物质的热能 C、任何化学反应都有热效应,表示吸热反应,表示放热反应 D、与反应放出的热就是的燃烧热6. 下列变化过程中,体系的熵减小的是( )A、水合离子的形成 B、氯化钠固体融化 C、酒香四溢 D、碘的升华7. 根据实验操作和现象,不能得出相应结论的是( )A、等体积、的两种酸HA和HB,分别与足量的Zn反应,酸HA放出的氢气多,则酸性: B、相同条件下,将0.01mol/L的分别逐滴加入到相同浓度的含的溶液中,后者先产生沉淀,则AgCl的溶度积小 C、将充满的密闭玻璃球没泡在热水中,气体红棕色加深,则 D、向含有酚酞的溶液中加入少量固体,有白色沉淀生成,溶液红色变浅,则纯碱溶液呈碱性是由水解引起的8. 已知完全分解1molH2O2放出热量为98kJ,在含有少量I-的溶液中H2O2分解的机理为
A、通过该催化反应,实现了太阳能向化学能的转化 B、反应Ⅰ中涉及到O-H键的断裂和H-H、O-O键的形成 C、反应Ⅱ为2H2O22H2O+O2↑ D、光催化剂明显降低了2H2O22H2O+O2↑的反应热5. 下列说法正确的是( )A、的溶液一定是碱性溶液 B、内能是指体系内物质的热能 C、任何化学反应都有热效应,表示吸热反应,表示放热反应 D、与反应放出的热就是的燃烧热6. 下列变化过程中,体系的熵减小的是( )A、水合离子的形成 B、氯化钠固体融化 C、酒香四溢 D、碘的升华7. 根据实验操作和现象,不能得出相应结论的是( )A、等体积、的两种酸HA和HB,分别与足量的Zn反应,酸HA放出的氢气多,则酸性: B、相同条件下,将0.01mol/L的分别逐滴加入到相同浓度的含的溶液中,后者先产生沉淀,则AgCl的溶度积小 C、将充满的密闭玻璃球没泡在热水中,气体红棕色加深,则 D、向含有酚酞的溶液中加入少量固体,有白色沉淀生成,溶液红色变浅,则纯碱溶液呈碱性是由水解引起的8. 已知完全分解1molH2O2放出热量为98kJ,在含有少量I-的溶液中H2O2分解的机理为反应Ⅰ:H2O2(aq)+I-(aq)IO-(aq)+H2O(l) △H1
反应Ⅱ:H2O2(aq)+IO-(aq)O2(g)+I-(aq)+H2O(l) △H2
在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法错误的是( )
 A、反应Ⅱ高温下能自发进行 B、H2O2分解产生氧气的速率是由反应I决定的 C、I-、IO-都是催化剂 D、△H1+△H2=-196kJ•mol-19. 下列有关说法正确的是( )A、足量的FeCl3溶液与少量KI溶液反应后,用CCl4萃取生成的I2 , 分液。再往水溶液中滴加KSCN溶液,溶液变红,说明该反应为可逆反应 B、2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的∆H>0 C、过量锌与少量稀硫酸反应制备氢气,往稀硫酸中加入少量醋酸钠固体,可以减慢氢气的产生速率,但是不会影响生成氢气的总量 D、已知2NO2N2O4 ∆H<0,升高温度,v正下降,v逆增加,N2O4百分含量下降10. 在2个容积均为2L的恒容密闭容器中按照下述方式投入反应物,发生反应:CO(g)+H2O(g)CO2(g)+H2(g) ∆H=-a kJ/mol(a>0)。相关反应数据如下:
A、反应Ⅱ高温下能自发进行 B、H2O2分解产生氧气的速率是由反应I决定的 C、I-、IO-都是催化剂 D、△H1+△H2=-196kJ•mol-19. 下列有关说法正确的是( )A、足量的FeCl3溶液与少量KI溶液反应后,用CCl4萃取生成的I2 , 分液。再往水溶液中滴加KSCN溶液,溶液变红,说明该反应为可逆反应 B、2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的∆H>0 C、过量锌与少量稀硫酸反应制备氢气,往稀硫酸中加入少量醋酸钠固体,可以减慢氢气的产生速率,但是不会影响生成氢气的总量 D、已知2NO2N2O4 ∆H<0,升高温度,v正下降,v逆增加,N2O4百分含量下降10. 在2个容积均为2L的恒容密闭容器中按照下述方式投入反应物,发生反应:CO(g)+H2O(g)CO2(g)+H2(g) ∆H=-a kJ/mol(a>0)。相关反应数据如下:容器
容器类型
起始温度/℃
起始物质的量/mol
平衡时H2物质的量/mol
CO
H2O
CO2
H2
Ⅰ
恒温恒容
800
1.2
0.6
0
0
0.4
Ⅱ
绝热恒容
800
1.2
0.6
0
0
下列说法错误的是( )
A、达到平衡时,容器Ⅱ中n(H2)<0.4mol B、达到平衡时,容器Ⅱ中反应放出的热量小于0.4a kJ C、反应Ⅰ在10min刚好到达平衡,则前10min内的平均反应速率v(CO)=0.02mol/(L·min) D、平衡常数KⅠ=KⅡ11. 下列事实不能用平衡移动原理解释的是( )A、氯水在光照下颜色变浅,最终变为无色 B、夏天打开啤酒瓶,有很多气泡冒出 C、由NO2(g)、N2O4(g)组成的平衡体系通过缩小体积加压后颜色变深 D、实验室用排饱和食盐水的方法收集Cl212. 在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+ , 对于该平衡,下列叙述正确的是( )A、加水,平衡向逆反应方向移动 B、滴加少量0.1mol/L HCl溶液,溶液中c(H+ )减少 C、加入少量CH3COONa固体,平衡向正反应方向移动 D、加入少量NaOH固体,平衡向正反应方向移动13. 向密闭容器中充入1molA,发生反应aA(g)=bB(g)+cC(g),达到平衡时,体系中B的体积分数φ(B)随温度、压强的变化如图所示。下列说法正确的是( ) A、该反应的△H<0,△S<0 B、M、N两点对应的化学平衡常数:M>N C、P、M两点对应的A的转化率:P<M D、恒温恒容时,再充入少量A,达到新平衡,φ(B)增大14. 如图为某化学反应的速率与时间的关系图,在t1时刻升高温度或者增大压强,速率的变化都符合图示的反应的是( )
A、该反应的△H<0,△S<0 B、M、N两点对应的化学平衡常数:M>N C、P、M两点对应的A的转化率:P<M D、恒温恒容时,再充入少量A,达到新平衡,φ(B)增大14. 如图为某化学反应的速率与时间的关系图,在t1时刻升高温度或者增大压强,速率的变化都符合图示的反应的是( ) A、2SO2(g)+O2(g)2SO3(g) ΔH<0 B、C(s)+H2O(g)CO(g)+H2(g) ΔH>0 C、H2(g)+I2(g)2HI(g) ΔH>0 D、4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<015. 将4molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生如下反应;4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L。下列说法中正确的是( )A、4s内用物质B表示的反应速率为 B、达平衡后若通入一定量氦气,A的转化率降低 C、此时A的浓度为0.6mol/L D、达平衡后若升高温度,C的浓度将增大16. 高温时在催化剂作用下,某可逆反应达到平衡,平衡常数 , 恒容时,温度升高,浓度减小。下列说法正确的是( )A、该反应的方程式为 B、恒温恒容下,增大压强,浓度一定减小 C、升高温度,逆反应速率减小 D、该反应的反应热为负值17. 已知:硫酸银(Ag2SO4)的溶解度大于氯化银且硫酸银(Ag2SO4)的溶解度随温度升高而增大,T ℃时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A、2SO2(g)+O2(g)2SO3(g) ΔH<0 B、C(s)+H2O(g)CO(g)+H2(g) ΔH>0 C、H2(g)+I2(g)2HI(g) ΔH>0 D、4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<015. 将4molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生如下反应;4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L。下列说法中正确的是( )A、4s内用物质B表示的反应速率为 B、达平衡后若通入一定量氦气,A的转化率降低 C、此时A的浓度为0.6mol/L D、达平衡后若升高温度,C的浓度将增大16. 高温时在催化剂作用下,某可逆反应达到平衡,平衡常数 , 恒容时,温度升高,浓度减小。下列说法正确的是( )A、该反应的方程式为 B、恒温恒容下,增大压强,浓度一定减小 C、升高温度,逆反应速率减小 D、该反应的反应热为负值17. 已知:硫酸银(Ag2SO4)的溶解度大于氯化银且硫酸银(Ag2SO4)的溶解度随温度升高而增大,T ℃时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( ) A、a点溶液加入硝酸银固体,则a点可沿虚线移动到b点 B、a点溶液若降低温度,则a点可沿虚线移动到c点 C、向a点的悬浊液中加入NaCl固体,溶液组成可能会由a向d方向移动 D、根据曲线数据计算可知,T ℃下,Ksp(Ag2SO4)=2.25×10-418. 在常温下,有关下列4种溶液的叙述中错误的是( )
A、a点溶液加入硝酸银固体,则a点可沿虚线移动到b点 B、a点溶液若降低温度,则a点可沿虚线移动到c点 C、向a点的悬浊液中加入NaCl固体,溶液组成可能会由a向d方向移动 D、根据曲线数据计算可知,T ℃下,Ksp(Ag2SO4)=2.25×10-418. 在常温下,有关下列4种溶液的叙述中错误的是( )编号
①
②
③
④
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
pH
11
11
3
3
A、将溶液①、④等体积混合,所得溶液中: B、在溶液①、②中分别加入适量的氯化铵晶体后,两种溶液的pH均减小 C、分别取1mL稀释至10mL,四种溶液的pH:①>②>④>③ D、将aL溶液④与bL溶液②混合后,若所得溶液的 , 则19. 下列说法错误的是( )A、25℃时,中和pH和体积均相等的乙酸和盐酸溶液,乙酸消耗NaOH的物质的量多 B、25℃时,的溶液浓度小于的溶液浓度的10倍 C、50℃时, 1L0.1mol/L的氯化铵溶液中滴入氨水至 , 数目大于数目 D、25℃时,某溶液水电离出的 , 则该溶液的溶质可能是酸、碱或盐20. 乙醇在催化脱水时存在竞争关系,具体反应如下,相对能量与反应进程如图所示
①
②
下列说法正确的是( )
A、比更稳定 B、高温有利于增大的选择性 C、反应②的大于反应①的 D、增加乙醇的浓度,可以增大活化分子百分数,提高化学反应速率21. 工业上,冶炼铁的有关热化学方程式如下:①C(s)+O2(g)=CO2(g) ΔH1=a kJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH2=b kJ·mol-1
③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH3=c kJ·mol-1
④2Fe2O3(s)+3C(s)=4Fe(s)+3CO2(g) ΔH4=d kJ·mol-1
(上述热化学方程式中,a、b、c、d均不等于0)下列说法正确的是( )
A、b<a B、C(s)+O2(g)=CO(g) ΔH=kJ·mol-1 C、d=3c+2b D、CO(g)+O2(g)=CO2(g) ΔH<a kJ·mol-122. 反应 2SiHCl3(g) SiH2Cl2(g) + SiCl4(g)在催化剂作用下,于 323 K 和 343 K 时充分反应,SiHCl3 的转化率随时间变化的结果如图所示:
下列说法错误的是( )
A、343 K 时反应物的平衡转化率为 22% B、a、b 处反应速率大小:va>vb C、要提高 SiHCl3 转化率,可采取的措施是降温和及时移去反应产物 D、已知反应速率 ,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,则 343 K 时23. 已知反应:2NO2(红棕色)N2O4(无色) ΔH<0,将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),下列说法正确的是( ) A、b点的操作为拉伸注射器 B、c点与a点相比,c(NO2)增大,c(N2O4)减小 C、d点正<逆 D、若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)24. 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。设起始 =Z,在恒压条件下,平衡时CH4的体积分数φ(CH4)与Z和温度T的关系如图所示,下列说法正确的是( )
A、b点的操作为拉伸注射器 B、c点与a点相比,c(NO2)增大,c(N2O4)减小 C、d点正<逆 D、若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)24. 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。设起始 =Z,在恒压条件下,平衡时CH4的体积分数φ(CH4)与Z和温度T的关系如图所示,下列说法正确的是( ) A、该反应的焓变ΔH<0 B、图中X点对应的平衡混合物中=3 C、图中Z的大小关系为b>3>a D、温度不变时,增大X点对应的平衡体系的压强后,φ(CH4)减小25. 25℃时,向20.00mL浓度均为0.1000mol/L的三种酸中分别加入浓度为0.1000mol/L的NaOH溶液,结果如图所示,下列说法正确的是( )
A、该反应的焓变ΔH<0 B、图中X点对应的平衡混合物中=3 C、图中Z的大小关系为b>3>a D、温度不变时,增大X点对应的平衡体系的压强后,φ(CH4)减小25. 25℃时,向20.00mL浓度均为0.1000mol/L的三种酸中分别加入浓度为0.1000mol/L的NaOH溶液,结果如图所示,下列说法正确的是( ) A、电离常数 B、酸性强弱: C、在加入NaOH溶液为20mL时,HX溶液中有: D、若加入过程温度发生变化,则时最大
A、电离常数 B、酸性强弱: C、在加入NaOH溶液为20mL时,HX溶液中有: D、若加入过程温度发生变化,则时最大二、综合题
-
26. 某化学兴趣小组要完成中和热的测定。
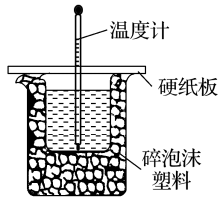 (1)、实验室用盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的不正确,其中一处是缺少一种玻璃仪器,该仪器的名称为 , 另一处不正确是;碎泡沫塑料的作用是;实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应选择mol/L的溶液进行实验反应会更充分。(2)、的水溶液呈(填“酸”、“中”、“碱”)性,把溶液蒸干,灼烧,最后得到的主要固体产物是:。(3)、已知101kPa时,的燃烧热为285.8kJ/mol,请写出表示燃烧热的热化学方程式;27. 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体()进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
(1)、实验室用盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的不正确,其中一处是缺少一种玻璃仪器,该仪器的名称为 , 另一处不正确是;碎泡沫塑料的作用是;实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应选择mol/L的溶液进行实验反应会更充分。(2)、的水溶液呈(填“酸”、“中”、“碱”)性,把溶液蒸干,灼烧,最后得到的主要固体产物是:。(3)、已知101kPa时,的燃烧热为285.8kJ/mol,请写出表示燃烧热的热化学方程式;27. 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体()进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体()中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性溶液进行滴定:
学习小组的同学设计了滴定的方法测定x值
①称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液
②取25.00mL待测液放入锥形瓶中,再加入适量的稀
③用浓度为0.1000mol/L的标准溶液进行滴定,达到终点记录消耗体积。
(1)、滴定时,将酸性标准液装在如图中的(填“甲”或“乙”)滴定管中。若在25mL滴定管中盛有溶液,液面恰好在10.00mL刻度处。把滴定管中的溶液全部排出,承接在量筒中,量筒内溶液的体积:
A.大于15.00mL B.为15.00mL C.小于15.00mL D.为10.00mL
选出其准备工作的正确操作顺序,写出字母:检查滴定管是否漏水→蒸馏水洗涤→→→→→→滴定管准备完成。
a.从滴定管上口加入高于“0”刻度3mL所要盛装的溶液
b.从滴定管上口加入3mL所要盛装的溶液,倾斜着转动滴定管
c.将洗涤液从滴定管上口倒入预置的烧杯中
d.将洗涤液从滴定管下部放入预置的烧杯中
e.调整液面至“0”刻度或“0”刻度以下,记录数据
f.轻轻转动活塞使滴定管的尖嘴部分充满溶液,无气泡
g.轻轻挤压玻璃球使滴定管的尖嘴部分充满溶液,无气泡
(2)、滴定时,左手操作滴定管,右手轻轻摇动锥形瓶,眼睛注视。(3)、本实验滴定达到终点的标志是。(4)、为了提高实验的准确性,学习小组共进行3次实验,记录数据如下表:待测液/mL
25.00
0.00
9.95
25.00
1.05
11.10
25.00
0.50
13.50
通过上述数据,可求得。
(5)、讨论:若滴定终点时俯视滴定管刻度,则由此测得的x值会(填“偏大”、“偏小”或“不变”,下同)。28. 的回收与利用是科学家研究的热点课题。工业上有一种用生产甲醇燃料的方法:。将和充入2L的恒温刚性密闭容器中,测得的氢气物质的量随时间变化如图所示(实线)。 (1)、该反应能自发进行的条件是。(2)、下列说法能表明该反应已经达到平衡状态的是____(填序号)。A、 B、混合气体的平均相对分子质量不变 C、保持不变 D、压强保持不变(3)、a点正反应速率(填大于、等于或小于)b点逆反应速率,前4min内,用表示的平均反应速率为。(保留两位有效数字)(4)、平衡时的转化率为 , 若达到平衡后往容器中分别充入 , 各2mol,请问(填“大于”,“小于”或者“等于”)。(5)、仅改变某一实验条件再进行实验,测得的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是。29. 25℃时,的电离常数。常温下,往25mL氢氧化钠标准溶液中逐滴加入0.1mol/L的溶液,pH变化曲线如图所示:
(1)、该反应能自发进行的条件是。(2)、下列说法能表明该反应已经达到平衡状态的是____(填序号)。A、 B、混合气体的平均相对分子质量不变 C、保持不变 D、压强保持不变(3)、a点正反应速率(填大于、等于或小于)b点逆反应速率,前4min内,用表示的平均反应速率为。(保留两位有效数字)(4)、平衡时的转化率为 , 若达到平衡后往容器中分别充入 , 各2mol,请问(填“大于”,“小于”或者“等于”)。(5)、仅改变某一实验条件再进行实验,测得的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是。29. 25℃时,的电离常数。常温下,往25mL氢氧化钠标准溶液中逐滴加入0.1mol/L的溶液,pH变化曲线如图所示: (1)、该氢氧化钠溶液的物质的量浓度为。(2)、A点对应的横坐标为25mL,请用离子方程式解释A点所示的溶液显碱性的原因:。(3)、C点所示溶液为等浓度的和混合溶液,请判断该溶液中(填“>”“<”或“=”)。并写出C点溶液中的物料守恒。(4)、B点所示溶液中,。(可用分数表示)30. 丙烯广泛用于合成聚丙烯、丙烯醛、丙烯酸等工业领域。回答下列问题:(1)、丙烷无氧脱氢法制备丙烯反应如下:
(1)、该氢氧化钠溶液的物质的量浓度为。(2)、A点对应的横坐标为25mL,请用离子方程式解释A点所示的溶液显碱性的原因:。(3)、C点所示溶液为等浓度的和混合溶液,请判断该溶液中(填“>”“<”或“=”)。并写出C点溶液中的物料守恒。(4)、B点所示溶液中,。(可用分数表示)30. 丙烯广泛用于合成聚丙烯、丙烯醛、丙烯酸等工业领域。回答下列问题:(1)、丙烷无氧脱氢法制备丙烯反应如下:①总压分别为100kPa、10kPa时发生该反应,平衡体系中和的物质的量分数随温度变化关系如图所示:

10kPa时,和的物质的量分数随温度变化关系的曲线分别是、。
②某温度下,在刚性容器中充入 , 起始压强为10kPa,平衡时总压为13.3kPa,该反应的平衡常数kPa(保留1位小数)。
(2)、丙烷氧化脱氢法制备丙烯主要反应如下: , 在催化剂作用下,氧化脱氢除生成外,还生成等物质。转化率和的产率随温度变化关系如图所示。
①已知。由此计算。
②图中的转化率随温度升高而上升的原因是。
③时,的选择性为。(的选择性)
④基于本研究结果,能提高选择性的措施是。