湖北省宜昌市协作体2022-2023学年高二上学期期中考试化学试题
试卷更新日期:2022-11-22 类型:期中考试
一、单选题
-
1. 对于反应3H2(g)+N2(g)2NH3(g) ΔH<0,下列条件中能使活化分子百分数增加的是( )A、增加反应物浓度 B、增大气体的压强 C、缩小反应容器的体积 D、升高体系的温度2. 反应M(g)+3N(g)2P(g)+2Q(g)在四种不同情况下的反应速率最快的是( )A、v(M)=6mol/(L·min) B、v(N)=1.5mol/(L·s) C、v(P)=0.4mol/(L·s) D、v(Q)=0.5mol/(L·s)3. 某同学设计如图所示实验,探究化学反应中的能量变化。
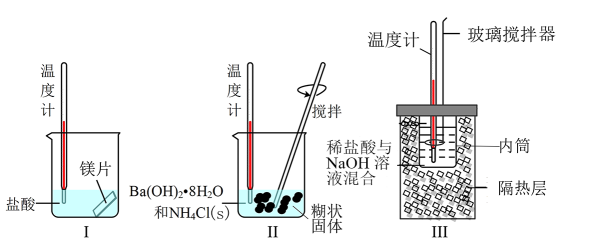
下列判断正确的是( )
A、由实验可知,Ⅰ、Ⅱ、Ⅲ所涉及的反应都是放热反应 B、将实验Ⅰ中的镁片更换为等质量的镁粉后释放出的热量增多 C、实验Ⅲ中将玻璃搅拌器改为铜质搅拌器对实验结果没有影响 D、实验Ⅲ中若用NaOH固体测定中和反应的反应热,则测定的ΔH偏低4. 下列事实不能用勒夏特列原理解释的是( )A、加压后,由H2、I2(g)、HI组成的平衡体系颜色加深 B、氯水中加入CaCO3粉末以提高氯水中HClO的浓度 C、将碳酸饮料瓶摇晃后,拧开瓶盖立即有大量泡沫溢出 D、实验室常用排饱和食盐水的方法收集Cl25. 下列物质间的转化属于化学变化且能量变化符合图示变化的是( ) A、2Cl→Cl2 B、NaOH(s)溶解 C、水煤气燃烧 D、煅烧石灰石6. 常温常压下,下列热化学方程式书写正确的是( )
A、2Cl→Cl2 B、NaOH(s)溶解 C、水煤气燃烧 D、煅烧石灰石6. 常温常压下,下列热化学方程式书写正确的是( )选项
已知条件
热化学方程式
A
H2的燃烧热为akJ•mol-1
H2(g)+Cl2(g)=2HCl(g) △H=akJ•mol-1
B
1molCH4完全燃烧生成液态水和CO2 , 放出890.3kJ的热量
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ
C
12g石墨比12g金刚石能量少bkJ
C(石墨,s)=C(金刚石,s) △H=bkJ•mol-1
D
2molAB分解生成A2和B2气体,吸收热量ckJ
2AB=A2+B2 △H=ckJ•mol-1
A、A B、B C、C D、D7. 如图表示使用不同催化剂(AuF和AuPF)催化乙烯加氢生成乙烷[C2H4(g)+H2(g)=C2H6(g) △H=akJ•mol-1]的反应历程。下列说法错误的是( )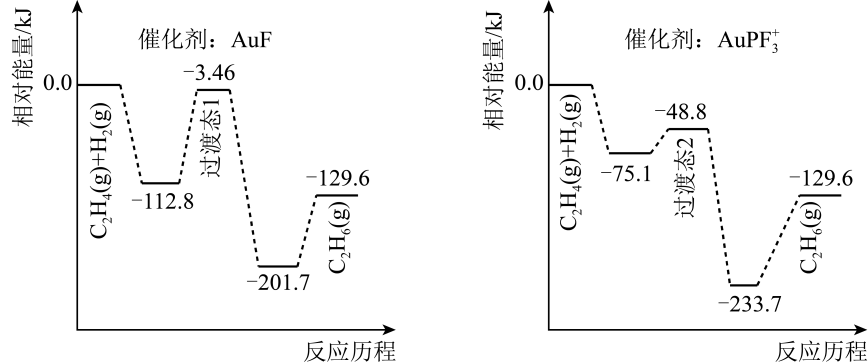 A、乙烯催化加氢是放热反应 B、稳定性:过渡态1<过渡态2<乙烷 C、催化剂不同,反应路径不同 D、总能量:断键吸收>成键释放8. 相同条件下,下列各组热化学方程式中ΔH1>ΔH2的是( )A、C(s)+O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2 B、2Al(s)+O2(g)=Al2O3(s) ΔH1;2Fe(s)+O2(g)=Fe2O3(s) ΔH2 C、2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1;2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH2 D、CaO(s)+H2O(l)=Ca(OH)2(s) ΔH1;NH4HCO3(s)=NH3(g)+CO2(g)+H2O(g) ΔH29. SO2与O2反应生成SO3的热化学方程式为2SO2(g)+O2(g)2SO3(g) ΔH=-196.6kJ/mol。下列说法正确的是( )A、其他条件不变,将反应器的体积压缩,该反应的平衡常数增大 B、若反应转移的电子数为6.02×1023 , 反应放出的热量约为98.3kJ C、若混合气体的平均相对分子质量不变,则该反应达到了平衡状态 D、向平衡体系中加入SO2 , 能加快正反应速率,提高SO2的平衡转化率10. 在200℃、1.01×105Pa下, 1mol H2燃烧生成气态水的能量变化如图所示,已知:2H2(g)+O2(g)=2H2O(g) ΔH=-490kJ/mol。下列有关说法正确的是( )
A、乙烯催化加氢是放热反应 B、稳定性:过渡态1<过渡态2<乙烷 C、催化剂不同,反应路径不同 D、总能量:断键吸收>成键释放8. 相同条件下,下列各组热化学方程式中ΔH1>ΔH2的是( )A、C(s)+O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2 B、2Al(s)+O2(g)=Al2O3(s) ΔH1;2Fe(s)+O2(g)=Fe2O3(s) ΔH2 C、2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1;2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH2 D、CaO(s)+H2O(l)=Ca(OH)2(s) ΔH1;NH4HCO3(s)=NH3(g)+CO2(g)+H2O(g) ΔH29. SO2与O2反应生成SO3的热化学方程式为2SO2(g)+O2(g)2SO3(g) ΔH=-196.6kJ/mol。下列说法正确的是( )A、其他条件不变,将反应器的体积压缩,该反应的平衡常数增大 B、若反应转移的电子数为6.02×1023 , 反应放出的热量约为98.3kJ C、若混合气体的平均相对分子质量不变,则该反应达到了平衡状态 D、向平衡体系中加入SO2 , 能加快正反应速率,提高SO2的平衡转化率10. 在200℃、1.01×105Pa下, 1mol H2燃烧生成气态水的能量变化如图所示,已知:2H2(g)+O2(g)=2H2O(g) ΔH=-490kJ/mol。下列有关说法正确的是( ) A、a=498 B、H-O键的键能为930kJ/mol C、物质所具有的总能量:甲>丙>乙 D、1mol H2O(g)分解为2mol H与1mol O时吸收1860kJ的热量11. 科学家设计出三条在含Pt-O结构的化合物中插入CO的反应路径,相对能量与反应历程的关系如图所示。下列说法正确的是( )
A、a=498 B、H-O键的键能为930kJ/mol C、物质所具有的总能量:甲>丙>乙 D、1mol H2O(g)分解为2mol H与1mol O时吸收1860kJ的热量11. 科学家设计出三条在含Pt-O结构的化合物中插入CO的反应路径,相对能量与反应历程的关系如图所示。下列说法正确的是( ) A、路径Ⅱ决速反应为第一步反应 B、路径Ⅰ中正反应的活化能大于逆反应的 C、反应过程中Pt的成键数目没发生改变 D、路径Ⅲ中没有非极性键的形成与断裂12. 下列实验方法、操作均正确,且能达到实验目的的是( )
A、路径Ⅱ决速反应为第一步反应 B、路径Ⅰ中正反应的活化能大于逆反应的 C、反应过程中Pt的成键数目没发生改变 D、路径Ⅲ中没有非极性键的形成与断裂12. 下列实验方法、操作均正确,且能达到实验目的的是( )选项
实验目的
实验方法或操作
A
测定中和反应反应热
酸碱中和的同时,用铜质环形搅拌棒搅拌
B
判断反应后Ag+是否沉淀完全
将AgNO3溶液与NaCl溶液混合,反应后静置,向上层清液中再加入1滴NaCl溶液
C
探究压强对化学反应平衡移动的影响
容器中反应H2(g)+Br2(g)=2HBr(g)达平衡时,将容器压缩为原体积的 , 观察颜色变化
D
探究浓度对化学反应速率的影响
量取同体积不同浓度的盐酸,分别加入等体积、等浓度的NaOH溶液,对比现象
A、A B、B C、C D、D13. 下列关于化学反应速率及平衡的说法中正确的是( )A、决定化学反应速率的主要因素是反应物自身的性质 B、加入适宜的催化剂,可使正反应的活化能降低,逆反应的升高 C、其他条件不变,压缩合成氨反应体系的体积,使活化分子百分数增大 D、50mL 1mol/L硫酸与足量铁片反应,加入少量的CH3COONa溶液,反应速率增大14. 在0.1MPa时,按n(M):n(N)=2:5投料,密闭恒压容器中发生反应2M(g)+5N(g)P(s)+3Q(g) ΔH,平衡时各物质的物质的量(n)与温度(T)的关系如图所示。下列有关说法错误的是( ) A、该反应逆反应的ΔH>0 B、曲线b表示的物质为Q C、温度升高,平衡常数Kc减小 D、不断分离出P,可以提高M的转化率15. 在体积为2L的恒容密闭容器中充入一定量的SO3气体,发生反应2SO3O2(g)+2SO2(g) ΔH>0,平衡时各物质的物质的量浓度与温度的关系如图所示。下列说法正确的是( )
A、该反应逆反应的ΔH>0 B、曲线b表示的物质为Q C、温度升高,平衡常数Kc减小 D、不断分离出P,可以提高M的转化率15. 在体积为2L的恒容密闭容器中充入一定量的SO3气体,发生反应2SO3O2(g)+2SO2(g) ΔH>0,平衡时各物质的物质的量浓度与温度的关系如图所示。下列说法正确的是( ) A、X点和Y点:SO2的物质的量的浓度之比为5:4 B、温度为T1时的平衡常数大于温度为T2时的平衡常数 C、T1时,反应达到平衡时SO3的转化率为50% D、T1时,向X点容器中再充入mol SO3和mol SO2 , 重新平衡前v(逆)>v(正)
A、X点和Y点:SO2的物质的量的浓度之比为5:4 B、温度为T1时的平衡常数大于温度为T2时的平衡常数 C、T1时,反应达到平衡时SO3的转化率为50% D、T1时,向X点容器中再充入mol SO3和mol SO2 , 重新平衡前v(逆)>v(正)二、综合题
-
16. 化学反应速率的影响因素及化学反应中的能量变化是高中化学中的重要组成部分。回答下列问题:(1)、H2O2(g)分解生成H2O(g)与O2(g)的热化学方程式为[已知O-O、H-O、O=O的键能(kJ/mol)分别为138、465、498]。(2)、某化学兴趣小组设计实验探究H+对MnO2与H2O2反应速率的影响:取等量MnO2和表中有关物质,在相同温度下进行4组实验,分别记录收集20.0mL O2所需时间。
实验编号
1
2
3
4
10% H2O2的体积/mL
10.0
10.0
10.0
V2
20%硫酸的体积/mL
0
0.5
1.0
1.5
水的体积/mL
15.0
14.5
V1
13.5
所需时间t/s
t1
t2
t3
t4
已知酸性条件下:MnO2+H2O2+2H+=Mn2++O2↑+2H2O。
①表中V1=mL,V2=mL。
②实验测得t2>t3>t4 , 则可得出的实验结论是。
(3)、一定温度下,某密闭容器中发生反应2NO(g)+2H2(g)=N2(g)+2H2O(g),v(正)=k正c2(NO)·c2(H2),v(逆)=k逆c2(H2O)·c(N2)(k正、k逆为速率常数)。①温度升高,k逆(填“增大”“减小”或“不变”)。
②该温度下该反应的平衡常数为(用k正、k逆表示)。
三、综合题
-
17. 甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,相关反应的热化学方程式为:
ⅰ.CO(g)+2H2(g)CH3OH(g) ΔH=a kJ/mol;
ⅱ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=b kJ/mol;
ⅲ. CO2(g)+H2(g)CO(g)+H2O(g) ΔH=-c kJ/mol。
回答下列问题:
(1)、a=(用b、c表示),已知反应ⅱ在一定条件下可自发进行,则b(填“>”“<”或“=”)0。(2)、在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2与H2 , 在催化剂的作用下仅发生反应ⅲ。①下列叙述能表示该反应达到平衡状态的是(填标号)。
a.容器中混合气体的压强不再改变
b.容器中CO、CO2的物质的量相等
c.容器中气体的密度不再改变
d.相同时间内,断裂H-O的数目是断裂H-H的2倍
②该反应达到平衡时,其他条件不变,通入CO2时,则v(正)(填“>”“<”或“=”)v(逆),平衡常数(填“变大”“变小”或“不变”)。
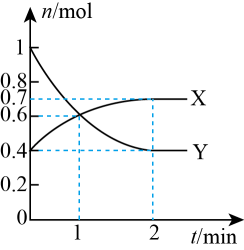 (3)、一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。
(3)、一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。①Y为(填化学式)。
②0~1min时v(CO)为mol/(L·min)。
③该温度下,该反应的平衡常数Kc=。
18. 研究化学反应过程与能量变化的关系具有重要意义。回答下列问题:(1)、CO2和NH3合成尿素[CO(NH2)2]的能量变化如图1所示,写出该反应的热化学方程式:。 (2)、C6H6(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以测量,原因是。已知CO的燃烧热,还需要的一组数据是(写出热化学方程式,焓变用△H表示)。(3)、H2(g)与F2(g)发生反应生成HF(g)过程中的能量变化如图2所示,仿照图1,在图3中画出该反应的能量一反应历程曲线图(标出该反应的焓变)。
(2)、C6H6(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以测量,原因是。已知CO的燃烧热,还需要的一组数据是(写出热化学方程式,焓变用△H表示)。(3)、H2(g)与F2(g)发生反应生成HF(g)过程中的能量变化如图2所示,仿照图1,在图3中画出该反应的能量一反应历程曲线图(标出该反应的焓变)。 (4)、图4表示VIA族的O、S、Se、Te在生成1mol气态氢化物时的焓变数据,根据数据可确定c代表(填元素符号)的氢化物,写出H2Te发生分解反应的热化学方程式:。
(4)、图4表示VIA族的O、S、Se、Te在生成1mol气态氢化物时的焓变数据,根据数据可确定c代表(填元素符号)的氢化物,写出H2Te发生分解反应的热化学方程式:。 (5)、已知:S8(s)+8O2(g)=8SO2(g) △H=-8akJ•mol-1;1个S8分子中有8个硫硫键,1个SO2分子中有2个硫氧键;破坏1mol硫氧键、1mol氧氧键所需能量分别为bkJ、ckJ,则生成1mol硫硫键所释放能量为。19. 甲烷是重要的气体燃料和化工原料,由CH4制取合成气(CO、H2)的反应原理为CH4(g)+H2O(g)CO(g)+3H2(g) ΔH>0。回答下列问题:(1)、若生成7g CO,吸收热量a kJ,相关化学键的键能(断裂1mol化学键所吸收的能量),如表所示。
(5)、已知:S8(s)+8O2(g)=8SO2(g) △H=-8akJ•mol-1;1个S8分子中有8个硫硫键,1个SO2分子中有2个硫氧键;破坏1mol硫氧键、1mol氧氧键所需能量分别为bkJ、ckJ,则生成1mol硫硫键所释放能量为。19. 甲烷是重要的气体燃料和化工原料,由CH4制取合成气(CO、H2)的反应原理为CH4(g)+H2O(g)CO(g)+3H2(g) ΔH>0。回答下列问题:(1)、若生成7g CO,吸收热量a kJ,相关化学键的键能(断裂1mol化学键所吸收的能量),如表所示。化学键
C-H
H-H
H-O
键能/ kJ/mol
414
436
467
①C≡O(CO)的键能为(用含a的式子表示) kJ/mol。
②当体系温度等于T K时ΔH−TΔS=0,温度大于T时ΔH−TΔS(填“>”“<”或“=”)0。
(2)、在体积为1L的恒容密闭容器中通入1mol CH4和1mol H2O(g),在不同条件下发生反应CH4(g)+H2O(g)CO(g)+3H2(g),测得平衡时H2O(g)的体积分数与温度、压强的关系如图所示。
①X表示(填“温度”或“压强”),该反应的平衡常数表达式Kc=。
②m、n、q点的平衡常数由大到小的顺序为。
③若q点对应的纵坐标为30,此时甲烷的转化率为 , 该条件下平衡常数Kc=(保留两位有效数字)。
-