广东省三校联考2022-2023学年高二上学期期中考试化学试题
试卷更新日期:2022-11-22 类型:期中考试
一、单选题
-
1. 研究表明I-可以作为水溶液中SO2歧化反应的催化剂:3SO2(g)+2H2O (l)=2H2SO4 (aq)+S(s) ΔH<0;该过程一般通过如下步骤来实现:①SO2(g)+4I-(aq)+4H+(aq)= S(s)+ 2I2(g) + 2H2O(l) ΔH>0;②I2(g)+2H2O(l)+SO2(g)=SO(aq)+4H+(aq)+2I-(aq) ΔH<0;已知反应①为慢反应,示意图中能体现上述反应过程中能量变化的是( )A、
 B、
B、 C、
C、 D、
D、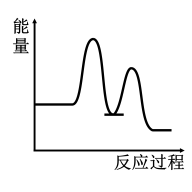 2. 下列实验装置,不能完成相应实验的是( )
2. 下列实验装置,不能完成相应实验的是( ) A、用甲装置测量稀盐酸和NaOH溶液的反应热 B、用乙装置验证:KCl浓度增大,导致反应的平衡逆向移动 C、用丙装置测定锌与稀硫酸反应速率 D、用丁装置测定某NaOH溶液的浓度3. 在实验室用50mL0.25mol/L稀硫酸与50mL0.55mol/L溶液进行中和热测定,实验测得中和热为 , 下列叙述正确的是( )A、若改用60mL0.25mol/L稀硫酸进行实验,实验中放出的热量会增加,所测得的中和热数值也会变大 B、用环形玻璃搅拌棒是为了加快反应速率,减小实验误差,也可以换成铜质环形搅拌棒 C、实验中测得的中和热数值低于理论值,可能是由于用温度计测定NaOH溶液起始温度后直接测定稀硫酸溶液的温度 D、用同浓度、同体积的氨水和溶液代替NaOH溶液进行上述实验,测得的中和热分别为和 , 则4. 工厂的氨氮废水可用电化学催化氧化法加以处理,其中在电极表面的氧化过程的微观示意图如图:
A、用甲装置测量稀盐酸和NaOH溶液的反应热 B、用乙装置验证:KCl浓度增大,导致反应的平衡逆向移动 C、用丙装置测定锌与稀硫酸反应速率 D、用丁装置测定某NaOH溶液的浓度3. 在实验室用50mL0.25mol/L稀硫酸与50mL0.55mol/L溶液进行中和热测定,实验测得中和热为 , 下列叙述正确的是( )A、若改用60mL0.25mol/L稀硫酸进行实验,实验中放出的热量会增加,所测得的中和热数值也会变大 B、用环形玻璃搅拌棒是为了加快反应速率,减小实验误差,也可以换成铜质环形搅拌棒 C、实验中测得的中和热数值低于理论值,可能是由于用温度计测定NaOH溶液起始温度后直接测定稀硫酸溶液的温度 D、用同浓度、同体积的氨水和溶液代替NaOH溶液进行上述实验,测得的中和热分别为和 , 则4. 工厂的氨氮废水可用电化学催化氧化法加以处理,其中在电极表面的氧化过程的微观示意图如图:
下列说法中,错误的是( )
A、使用催化剂降低了反应的活化能,可加快反应速率,提高反应的平衡转化率 B、催化剂不可以降低该反应的焓变 C、过程①②均有N-H键断裂,N-H键断裂时需要吸收能量 D、过程④中有非极性键形成5. 活泼自由基与氧气的反应一直是科学家关注的热点。HNO自由基与反应过程的能量变化如图所示,下列说法错误的是( ) A、该反应为放热反应 B、从反应过程图可知,生成产物P2的过程中,中间产物Z生成产物P2的过程为整个反应过程的决速步骤 C、该历程中最大正反应的活化能 D、相同条件下,由中间产物Z转化为产物的速率:6. 下列依据热化学方程式得出的结论正确的是( )A、已知: , 则金刚石比石墨稳定 B、已知: , 则的燃烧热 C、已知:; , 则 D、下,将和置于密闭的容器中充分反应生成 , 放热19.3kJ,则其热化学方程式为:7. 环戊二烯
A、该反应为放热反应 B、从反应过程图可知,生成产物P2的过程中,中间产物Z生成产物P2的过程为整个反应过程的决速步骤 C、该历程中最大正反应的活化能 D、相同条件下,由中间产物Z转化为产物的速率:6. 下列依据热化学方程式得出的结论正确的是( )A、已知: , 则金刚石比石墨稳定 B、已知: , 则的燃烧热 C、已知:; , 则 D、下,将和置于密闭的容器中充分反应生成 , 放热19.3kJ,则其热化学方程式为:7. 环戊二烯 广泛用于农药、橡胶、塑料等工业合成,是一种重要的有机化工原料。其相关键能和能量循环图如下所示,下列说法错误的是( )
广泛用于农药、橡胶、塑料等工业合成,是一种重要的有机化工原料。其相关键能和能量循环图如下所示,下列说法错误的是( )
共价键
键能/(kJ/mol)
H-H
436
H-I
299
I-I
151
A、在相同条件下,反应: , 则 B、表中三种物质,H-H键能最大,故相同条件下,最稳定 C、 D、将和混合加热,充分反应后测得的反应热与相同8. 某温度时,在催化剂作用下,2 L恒容密闭容器中发生反应I2(g)+H2(g) 2HI(g),部分数据如表:t/min
0
2.0
4.0
6.0
8.0
n(HI)/mol
0
0.18
0.35
0.50
0.62
则2~6 min内,以H2的物质的量浓度变化表示的反应速率为( )
A、0.02 mol•L-1•min-1 B、0.04 mol•L-1•min-1 C、0.08 mol•L-1•min-1 D、0.16 mol•L-1•min-19. 开发催化加氢合成甲醇技术是有效利用资源,实现“碳达峰、碳中和”目标的重要途径。某温度下,在恒容密闭容器中发生反应: , 下列有关说法正确的是( )A、增大体系的压强,平衡正向移动,平衡常数K增大 B、升高反应温度有利于提高的平衡转化率 C、平衡后再通入适量 , 平衡正向移动,的转化率增大 D、加入合适的催化剂,能提高单位时间内的产量10. 一定温度下,将浓度为0.1mol/LHF溶液加水不断稀释,始终保持增大的是( )A、 B、 C、 D、11. 已知:。以太阳能为热源分解 , 经热化学铁氧化合物循环分解水制的过程如下:
过程Ⅰ:
过程Ⅱ:……
下列说法正确的是( )
A、起催化剂的作用,在反应过程中化学性质不发生改变 B、过程Ⅰ中每消耗转移4mol电子 C、过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能 D、过程Ⅱ的热化学方程式为12. 环丙烷(△)与丙烷(CH3CH2CH3)都是重要的化学燃料,已知: , 环丙烷(g)的燃烧热 , 丙烷(g)的燃烧热 , 1mol液态水蒸发为气态水的焓变为。则2mol氢气完全燃烧生成气态水的(kJ/mol)为( )A、-658 B、-482 C、-329 D、-28513. 在密闭容器发生下列反应aA(g)⇌cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )A、a<c+d B、平衡向正反应方向移动 C、D的体积分数变大 D、A的转化率变大14. 下列图示与对应叙述不相符的是( ) A、图1各物质均为气体,升高温度时,反应的平衡常数会减小 B、图2为在绝热恒容密闭容器中,反应的正反应速率随时间变化的示意图,由图可知该反应为放热反应 C、图3为合成氨反应中,其它条件不变时,起始时H2用量对反应的影响图,则图中温度T1<T2 , a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 D、图4中,反应 , L线上所有的点都是平衡点,则E点v正>v逆15. 下列关于电解质溶液的说法中正确的是( )A、常温下的某碱溶液,取1mL稀释到100mL,稀释后pH为a,则a≤12 B、用等浓度的NaOH溶液中和等体积与的醋酸,所消耗的NaOH溶液的体积前者是后者的10倍 C、常温下的与的氨水等体积混合后,加入酚酞溶液仍为无色 D、某温度下纯水中 , 则该温度下0.1mol/L的盐酸的16. 某温度下,HNO2和CH3COOH的电离常数分别为和。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A、图1各物质均为气体,升高温度时,反应的平衡常数会减小 B、图2为在绝热恒容密闭容器中,反应的正反应速率随时间变化的示意图,由图可知该反应为放热反应 C、图3为合成氨反应中,其它条件不变时,起始时H2用量对反应的影响图,则图中温度T1<T2 , a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 D、图4中,反应 , L线上所有的点都是平衡点,则E点v正>v逆15. 下列关于电解质溶液的说法中正确的是( )A、常温下的某碱溶液,取1mL稀释到100mL,稀释后pH为a,则a≤12 B、用等浓度的NaOH溶液中和等体积与的醋酸,所消耗的NaOH溶液的体积前者是后者的10倍 C、常温下的与的氨水等体积混合后,加入酚酞溶液仍为无色 D、某温度下纯水中 , 则该温度下0.1mol/L的盐酸的16. 某温度下,HNO2和CH3COOH的电离常数分别为和。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( ) A、曲线Ⅰ代表HNO2溶液 B、取相同体积b、c两点的溶液,分别与NaOH恰好中和后,b点对应溶液中n(Na+)更大 C、取等体积a点的两种溶液,稀释到相同的pH值,CH3COOH所需水的体积更小 D、相应酸的电离程度:d点>c点,溶液导电性:d点>c点17. 部分弱酸的电离平衡常数如下表,则下列说法错误的是( )
A、曲线Ⅰ代表HNO2溶液 B、取相同体积b、c两点的溶液,分别与NaOH恰好中和后,b点对应溶液中n(Na+)更大 C、取等体积a点的两种溶液,稀释到相同的pH值,CH3COOH所需水的体积更小 D、相应酸的电离程度:d点>c点,溶液导电性:d点>c点17. 部分弱酸的电离平衡常数如下表,则下列说法错误的是( )弱酸
HCOOH
HClO
电离平衡常数(25℃)
A、酸性: B、同浓度的离子结合的能力由强到弱的顺序为: C、碳酸钠滴入足量甲酸溶液中的反应为: D、少量通入NaClO溶液中的反应为:18. 25℃时,用0.10 mol/L的氨水滴定10.00 mL0.05 mol/LH2A溶液,加入氨水的体积(V)与溶液中的关系如图所示(忽略溶液体积变化)。下列说法错误的是( ) A、A点溶液的pH等于1 B、由图中数据可知,H2A为弱酸 C、B点水电离出的H+浓度为1.0×10-6 mol/L D、水的电离程度为:B>C>A19. 草酸二甲酯[(COOCH3)2]催化加氢制乙二醇的反应体系中,发生的主要反应为
A、A点溶液的pH等于1 B、由图中数据可知,H2A为弱酸 C、B点水电离出的H+浓度为1.0×10-6 mol/L D、水的电离程度为:B>C>A19. 草酸二甲酯[(COOCH3)2]催化加氢制乙二醇的反应体系中,发生的主要反应为反应I:(COOCH3)2(g)+2H2(g)CH3OOCCH2OH(g)+CH3OH(g) ΔH1<0
反应II:(COOCH3)2(g)+4H2(g)HOCH2CH2OH(g)+2CH3OH(g) ΔH2<0
压强一定的条件下,将(COOCH3)2、H2按一定比例、流速通过装有催化剂的反应管,测得(COOCH3)2的转化率及CH3OOCCH2OH、HOCH2CH2OH的选择性[×100%]与温度的关系如图所示。下列说法正确的是( )
 A、曲线B表示HOCH2CH2OH的选择性随温度变化 B、190~198℃范围内,温度升高,(COOCH3)2的平衡转化率增大 C、190~198℃范围内,温度升高,逐渐减小 D、192℃时,其他条件一定,加快气体的流速可以提高(COOCH3)2转化率
A、曲线B表示HOCH2CH2OH的选择性随温度变化 B、190~198℃范围内,温度升高,(COOCH3)2的平衡转化率增大 C、190~198℃范围内,温度升高,逐渐减小 D、192℃时,其他条件一定,加快气体的流速可以提高(COOCH3)2转化率二、多选题
-
20. CO2催化加氢制取甲醇的研究,对解决环境、能源问题都具有重要的意义。CO2与H2反应的热化学方程式表示如下:
反应ⅰ:
反应ⅱ:
在催化加氢制取甲醇的反应体系中,两个反应同时进行,则下列说法错误的是( )
A、恒容条件下,体系达到平衡后,升高温度,的浓度增大,说明温度对反应ⅰ的影响大于反应ⅱ B、恒温条件下,体系达到平衡后,压缩体积,反应ⅰ平衡正向移动,反应ⅱ平衡不移动 C、恒温恒压条件下,容器内气体的密度不变时反应体系已达平衡 D、相同时间内,有1molC=O断裂的同时,有1molH-O断裂,则反应体系已达平衡三、综合题
-
21.(1)、Ⅰ.碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。
探究不同条件下空气中氧气氧化KI的速率。
组别
温度
KI溶液
H2SO4溶液
蒸馏水
淀粉溶液
c(KI)
V
c(H2SO4)
V
1
298 K
0.1 mol/L
5 mL
0.1 mol/L
5 mL
10 mL
3滴
2
313 K
0.1 mol/L
5 mL
0.1 mol/L
5 mL
10 mL
3滴
3
298 K
0.1 mol/L
10 mL
0.1 mol/L
5 mL
5 mL
3滴
①酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为。
②设计实验组别3的目的是。
(2)、探究反应“2Fe3++2I-=2Fe2++I2”为可逆反应。试剂:0.01 mol/LKI溶液,0.005 mol/LFe2(SO4)3溶液,淀粉溶液,0.01 mol/LAgNO3溶液,KSCN溶液。实验如图:

①甲同学通过试管ⅰ和试管ⅱ中现象结合可证明该反应为可逆反应,则试管ⅰ中现象为:;乙同学认为该现象无法证明该反应为可逆反应,原因为:。
②请选择上述试剂重新设计实验,证明该反应为可逆反应:。
(3)、Ⅱ.次磷酸(H3PO2)是一种精细化工产品,已知10 mL1 mol/LH3PO2与20 mL1 mol/L的NaOH溶液充分反应后生成组成为NaH2PO2的盐,则:NaH2PO2属于(填“正盐”“酸式盐”或“无法确定”)。
(4)、设计实验方案,证明次磷酸是弱酸:。22. 食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。25℃时,HAc的。(1)、某小组研究25℃下HAc电离平衡的影响因素。提出假设。稀释HAc溶液或改变浓度,HAc电离平衡会发生移动。
设计方案并完成实验。用浓度均为0.1mol/L的HAc和NaAc溶液,按下表配制总体积相同的系列溶液:测定pH,记录数据如下。
【表1】
序号
pH
Ⅰ
40.00
/
/
0
2.86
Ⅱ
4.00
/
36.00
0
3.36
…
Ⅶ
4.00
a
b
4.53
Ⅷ
4.00
4.00
32.00
4.65
①根据表中信息,补充数据:a= , b=。
②由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡(填“正”或“逆”)向移动:结合表中数据,给出判断理由:。
③由实验Ⅱ~Ⅷ可知,增大浓度,HAc电离平衡逆向移动。
实验结论假设成立。
(2)、实验过程中,溶液浓度的准确性对结果会有影响,该小组同学认为应先用0.1000mol/L的NaOH溶液准确测定HAc溶液的浓度再验证,实验中:①应选用作指示剂,判断到达滴定终点的实验现象是。
②下列操作会导致实验结果偏低的是。(填标号)
A.碱式滴定管未用标准NaOH溶液润洗
B.盛装未知液的锥形瓶用蒸馏水洗后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.滴定过程中振荡锥形瓶,液体不慎溅出
③某学生进行3次实验得到相关数据如下所示。
【表2】
滴定次数
待测HAc的体积/mL
消耗0.1000mol/LNaOH溶液的体积/mL
滴定前读数
滴定后读数
第一次
25.00
0.00
28.13
第二次
25.00
1.56
32.30
第三次
25.00
0.22
28.29
则HAc的物质的量浓度为mol/L(保留四位小数)。
(3)、小组分析上【表1】数据发现:随着的增加,的值逐渐接近HAc的。查阅资料获悉:一定条件下,按配制的溶液中,的值等于HAc的。
如果只有浓度均约为0.1mol/L的HAc和NaOH溶液,如何准确测定HAc的?小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
Ⅰ
移取20.00mLHAc溶液,用NaOH溶液滴定至终点,消耗NaOH溶液
Ⅱ
, 测得溶液的pH为4.76
实验总结得到的结果与资料数据相符,方案可行。
23. 氮的氧化物是造成大气污染的主要物质,研究氮氧化物间的相互转化及脱除具有重要意义。(1)、已知的反应历程分两步:第一步(快速平衡)
第二步(慢反应)
①用表示的速率方程为:;表示的速率方程为: , 与分别表示速率常数(只与温度有关),则。
②下列关于反应的说法正确的是(填序号)。
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能小于第二步反应的活化能
C.升高温度,正反应速率减小,逆反应速率增大
D.反应达到平衡时,
(2)、容积均为1L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器,相同温度下,分别充入0.2mol的 , 发生反应: , 甲中的相关量随时间变化如图所示。
①请写出内,甲容器中的反应速率增大的原因:。
②甲达平衡时,温度若为 , 此温度下的平衡常数K=。
③平衡时, , (填“>”“<”或“=”)。
(3)、以为还原剂在脱硝装置中消除烟气中的氮氧化物。主反应:
副反应:

将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图,试分析脱硝的适宜温度是(填序号)。
a. b. c.
24. 由与制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由人工合成淀粉(节选途径见图)中的重要反应之一已知:

反应②:
反应③:
(1)、反应①:的。(2)、反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。
该反应历程中,使用催化剂条件下的决速步骤的反应方程式为:。
(3)、某研究小组将通入2L的刚性密闭容器内,只发生反应③,5分钟后容器压强变为原来的2.5倍,则这段时间内,;的转化率为:。(4)、某研究小组采用上述催化剂,向密闭容器中通入和 , 只发生反应①和反应②,在不同条件下达到平衡。其中,在下甲醇的物质的量分数随压强p的变化、在下随温度T的变化,如图所示。
①Y点对应的温度和压强为℃、kPa。
②M点时容器中为 , CO为 , 反应①的压强平衡常数(压强平衡常数是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
③图中M点的高于N点的原因是。
-