福建省三明市将乐县2022-2023学年九年级上学期期中化学试题
试卷更新日期:2022-11-21 类型:期中考试
一、单选题
-
1. 下列现象中,主要与物质的物理性质有关的是( )A、石蜡熔化 B、纸张燃烧 C、食物腐烂 D、铁生锈2. 地壳中含量最多的元素是( )A、Si B、Al C、O D、Fe3. 下列物质的化学式书写错误的是( )A、氮气N2 B、二氧化硫SO2 C、氧化镁MgO2 D、氯化钠NaCl4. 下列物质中,属于化合物的是( )A、空气 B、五氧化二磷 C、矿泉水 D、氧气5. “含氟牙膏”中的“氟”指的是( )A、氟单质 B、氟原子 C、氟分子 D、氟元素6. 钛元素具有增强免疫力的作用。在元素周期表中,钛元素的信息如图所示,对图中信息解释错误的是( )
 A、原子序数为22 B、质子数为48 C、元素符号为Ti D、相对原子质量为47.877. 下列实验操作正确的是( )A、
A、原子序数为22 B、质子数为48 C、元素符号为Ti D、相对原子质量为47.877. 下列实验操作正确的是( )A、 倾倒液体
B、
倾倒液体
B、 加热液体
C、
加热液体
C、 点燃酒精灯
D、
点燃酒精灯
D、 取用固体粉末
8. 下列有关化学“SO2”含义的认识错误的是( )A、表示二氧化硫这种物质 B、表示二氧化硫由硫元素和氧元素组成 C、表示1个二氧化硫分子 D、表示1个二氧化硫分子由1个硫原子和1个氧分子构成9. 下列对日常生活中的现象解释合理的是( )
取用固体粉末
8. 下列有关化学“SO2”含义的认识错误的是( )A、表示二氧化硫这种物质 B、表示二氧化硫由硫元素和氧元素组成 C、表示1个二氧化硫分子 D、表示1个二氧化硫分子由1个硫原子和1个氧分子构成9. 下列对日常生活中的现象解释合理的是( )生活中的现象
解释
A
50mL水和50mL酒精混合后的体积小于100 mL
分子间有间隔
B
酒精需要密闭保存
分子质量很小
C
夏天汽车轮胎容易爆炸
温度升高,分子体积增大
D
水蒸气遇冷凝结
分子种类发生了变化
A、A B、B C、C D、D10. 科学家发现,水在-157℃超低温、正常压力或真空条件下仍呈液态,比蜂蜜还粘稠,称为“高密度液态水”。下列关于这种“高密度液态水"的说法正确的是( )A、化学性质与水不同 B、氢、氧两种原子的个数比为2:1 C、分子不再运动 D、分子间的间隔比普通的液态水(0~100℃)的大二、填空题
-
11. 空气是一种宝贵的资源,学习化学从认识空气、保护空气开始。(1)、空气中含有稀有气体,写出其中一种。(2)、空气成分中能供给呼吸的是。(3)、食品包装中充入氮气用以防腐,因为氮气的化学性质。(4)、下列物质中,不属于“空气污染物”的是____(填标号)。A、二氧化氮 B、二氧化硫 C、PM2.5 D、氮气12. 化学用语是学习化学的重要工具,是国际通用的化学语言。(1)、用“
 ”表示一个氢原子,则“
”表示一个氢原子,则“ ”表示(填标号),“
”表示(填标号),“ ”表示(填标号)。
”表示(填标号)。A.H2 B.2H2 C.2H D.
(2)、用化学用语填空:①金属汞中的汞原子。
②构成氯化钠的钠离子。
③保持氧气化学性质的最小粒子。
④氧化铝。
(3)、符号“3H2O”中的“3”表示 , “2”表示。13. 水是生命之源,没有水就没生命。(1)、Ⅰ、“生命吸管”可直接将污水净化为饮用水,主要处理步骤与自来水的净化过程相似,如图所示。(③中离子交换树脂的主要作用是去除重金属离子、软化水质)

②中活性炭的作用是(填标号), ④中超滤膜的作用是(填标号)。
A.去除有害菌和部分病毒
B.吸附杂质
C.除去较大的不溶性杂质
(2)、若无生命吸管,取用河水时,要降低水的硬度和杀灭病原微生物,生活中常采取方法。(3)、Ⅱ、电解水实验揭示了水的组成,装置如图1所示。
图1中得到氧气的试管是 , 此实验说明水由元素组成。
(4)、图 2为电解水反应过程中各阶段微观示意图,将上述图示按反应前、反应中、反应后排序:(填序号)。(5)、该反应的文字(或化学式)表达式为 , 该反应属于(填“化合反应”或“分解反应”)。14. 构建知识网络是一种重要的学习方法。如图是有关氧气获得和性质的网络图。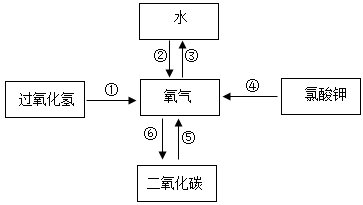
请根据图回答有关问题:
(1)、氯酸钾(KClO3)中氯元素的化合价为。(2)、氢气燃烧是实现转化③的途径之一,该反应的文字(或化学式)表达式为。(3)、实验室用转化①、④获得氧气时,通常都需要加入一定量的MnO2 , 它在反应中起作用。(4)、在自然界中,二氧化碳转化为氧气的主要途径是绿色植物的作用。15. 核电荷数为 1~18 的元素的原子结构示意图等信息如下,回答有关问题: (1)、3号元素的元素名称为。(2)、仔细观察上表,我们能发现很多规律:
(1)、3号元素的元素名称为。(2)、仔细观察上表,我们能发现很多规律:①同一周期元素原子的相同;
②表中不同种元素最本质的区别是。
(3)、氧元素是非金属元素,钠元素是金属元素,它们的化学性质有明显的差异,其本质原因:氧原子最外层有6个电子,易得2个电子,达到8个电子的稳定结构;钠原子。(4)、第 35号元素是溴元素,如图为溴原子的原子结构示意图,图中x的值为 , 溴元素应该排在元素的下方(填序号)。
A.钠 B.硫 C.氯 D.氩
三、综合题
-
16. 分析相关实验及其原理。(1)、用如图所示装置探究分子的性质。

①一段时间后,观察到烧杯B中溶液变红。该现象说明分子具有的性质是。
②列举一个生活中同样说明该性质的现象:。
(2)、用下图所示实验对蜡烛的燃烧进行探究。
①实验1中,将一根火柴梗平放入火焰中,约1s后取出,该实验的目的是。
②实验2中,能推测蜡烛燃烧后生成了水的现象是。
(3)、用如图所示装置测定空气中氧气的含量。
①冷却前,用弹簧夹夹紧胶皮管的目的是。
②能证明“氧气体积约占空气体积的1/5”的实验现象是。
17. 实验室用高锰酸钾制取氧气,并验证氧气的化学性质。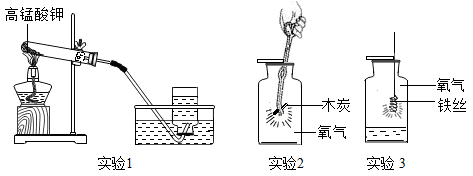 (1)、实验1中,检查装置气密性的方法是。发生化学反应的文字表达式(或化学方程式)为 , 用排水法收集氧气的理由是。待氧气收集满后,停止反应的操作是。(2)、实验2中观察到的现象是 , 反应的文字表达式(或化学方程式)为 , 反应后,往瓶内滴入澄清石灰水,震荡,该操作的目的是。(3)、实验3中反应的文字表达式(或化学方程式)为 , 说明反应产生新物质的现象是。18. 小林同学在体育课上腿部擦伤,医务室的大夫在她伤口上涂了医用过氧化氢溶液,小林看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?
(1)、实验1中,检查装置气密性的方法是。发生化学反应的文字表达式(或化学方程式)为 , 用排水法收集氧气的理由是。待氧气收集满后,停止反应的操作是。(2)、实验2中观察到的现象是 , 反应的文字表达式(或化学方程式)为 , 反应后,往瓶内滴入澄清石灰水,震荡,该操作的目的是。(3)、实验3中反应的文字表达式(或化学方程式)为 , 说明反应产生新物质的现象是。18. 小林同学在体育课上腿部擦伤,医务室的大夫在她伤口上涂了医用过氧化氢溶液,小林看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢? (1)、I、小林准备用如下图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气。记录2分钟收集的气体体积。
(1)、I、小林准备用如下图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气。记录2分钟收集的气体体积。
请写出过氧化氢分解的文字(或化学式)表达式:。
(2)、若要检验生成的气体是否为氧气,可将导气管从水中取出,取带火星的木条放在导气管口处,观察到 , 说明生成的气体是氧气。(3)、II、小林查阅了相关资料,并进行了探究实验【查阅资料】
①过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
②温度对化学反应的快慢有影响,人体正常体温是37℃。
【提出猜想】
猜想1:过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
【进行实验】
序号
实验步骤
实验现象
实验结论
①
分两次进行实验,均注入5 mL过氧化氢溶液
第一次在常温下进行
第二次将试管浸在37℃的温水中
量筒中2分钟收集到的气体体积均为5 mL
②
分两次进行实验
第一次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,注入5 mL过氧化氢溶液
第二次
第一次,量筒中2分钟收集到的气体体积为56 mL
第二次,量筒中2分钟收集到的气体体积为5 mL
过氧化氢分解加快是因为过氧化氢酶的作用
实验①得出的结论是。
实验②中横线部分应进行的操作是(4)、【实验反思】小林反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
加入过氧化氢酶
不加过氧化氢酶
反应温度/ ℃
25
37
42
25
37
42
收集到气体体积/ mL
39
56
34
5
5
5
通过这些数据,你能得出的新结论是。
四、计算题
-
19. 某饮用矿泉水1000g中的成分如图所示。
 (1)、此矿泉水中至少含有种元素。(2)、在偏硅酸H2SiO3中,氢元素与氧元素的质量比为。(3)、在偏硅酸H2SiO3中,求算硅元素的质量分数的计算式为。(4)、某同学喝了500 g该矿泉水,他同时摄入的钾元素的质量为mg。
(1)、此矿泉水中至少含有种元素。(2)、在偏硅酸H2SiO3中,氢元素与氧元素的质量比为。(3)、在偏硅酸H2SiO3中,求算硅元素的质量分数的计算式为。(4)、某同学喝了500 g该矿泉水,他同时摄入的钾元素的质量为mg。