辽宁省县级重点高中联合体2022-2023学年高三上学期期中考试化学试题
试卷更新日期:2022-11-18 类型:期中考试
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一个选项是符合题目要求的。
-
1. 中华文化源远流长、博大精深,西安博物馆馆藏文物是中华文化的重要代表。下列文物主要是由金属材料制成的是( )A、唐代三彩腾空马
 B、白瓷马蹬壶
B、白瓷马蹬壶 C、金虎符
C、金虎符 D、秦代玉高足杯
D、秦代玉高足杯 2. 下列事实用化学用语表述错误的是( )A、用电子式表示NaCl的形成过程:
2. 下列事实用化学用语表述错误的是( )A、用电子式表示NaCl的形成过程: B、中子数为20的K原子:
C、常温时,0.1 mol·L-1氨水的pH≈11.1:NH3·H2O+OH-
D、O2-的结构示意图:
B、中子数为20的K原子:
C、常温时,0.1 mol·L-1氨水的pH≈11.1:NH3·H2O+OH-
D、O2-的结构示意图: 3. 2022年春晚上,《只此青绿》惊艳了许多观众,生动还原了北宋名画——《千里江山图》。画中的青色来自蓝铜矿颜料[Cu(OH)2·2CuCO3],下列有关蓝铜矿颜料的说法合理的是( )A、可表示为3CuO·CO2·H2O B、不稳定,受热易分解 C、可溶于氢氧化钠 D、属于复盐4. 某有机物的结构简式如图。下列有关该有机物的说法错误的是( )
3. 2022年春晚上,《只此青绿》惊艳了许多观众,生动还原了北宋名画——《千里江山图》。画中的青色来自蓝铜矿颜料[Cu(OH)2·2CuCO3],下列有关蓝铜矿颜料的说法合理的是( )A、可表示为3CuO·CO2·H2O B、不稳定,受热易分解 C、可溶于氢氧化钠 D、属于复盐4. 某有机物的结构简式如图。下列有关该有机物的说法错误的是( ) A、该有机物含有4种官能团 B、该分子中所有原子不可能共平面 C、1 mol该有机物最多与3 mol NaOH反应 D、该有机物既能发生加成反应,又能发生氧化反应5. 劳动成就梦想。下列劳动项目与化学知识不相符的是( )
A、该有机物含有4种官能团 B、该分子中所有原子不可能共平面 C、1 mol该有机物最多与3 mol NaOH反应 D、该有机物既能发生加成反应,又能发生氧化反应5. 劳动成就梦想。下列劳动项目与化学知识不相符的是( )选项
劳动项目
化学知识
A
饮食卫生:高温蒸煮,给碗筷消毒
高温能使蛋白质变性
B
自主探究:植物油可使酸性高锰酸钾溶液褪色
植物油中含有碳碳双键,能被酸性高锰酸钾氧化
C
家务劳动:用食醋清洗水壶内的水垢
醋酸的酸性比碳酸强
D
工厂参观:燃煤时,加入生石灰
增大煤与空气的接触面积,从而提高煤的燃烧效率
A、A B、B C、C D、D6. 根据下列装置和物质,能达到相应实验目的的是( )A、分离碘和酒精 B、进行酸碱中和滴定
B、进行酸碱中和滴定 C、制备并收集NH3
C、制备并收集NH3 D、制备NaHCO3
D、制备NaHCO3 7. 一种实现二氧化碳固定及再利用的反应如图所示。下列叙述正确的是( )
7. 一种实现二氧化碳固定及再利用的反应如图所示。下列叙述正确的是( ) A、化合物1的分子式为C8H10 B、化合物1与乙烯互为同系物 C、化合物2可以与乙二醇发生缩聚反应 D、化合物2中有两个手性碳(一个碳原子连四个不同的原子或原子团)8. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、c(H+)=c(OH-)的溶液:Fe2+、K+ , Cl- , Na+ B、硫化钠溶液:Fe2+、K+、Cl-、 C、焰色试验呈黄色的溶液:、K+、、 D、水电离出的c(H+)=1×10-10 mol·L-1的溶液:Na+、K+、、Cl-9. 设NA表示阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,22.4 L氯乙烷所含分子数为NA B、25℃时,pH=14的NaOH溶液中阴、阳离子总数为2NA C、2 mol SO2和1 mol 18O2充分反应,产物中含18O原子数为2NA D、78g苯和立方烷(
A、化合物1的分子式为C8H10 B、化合物1与乙烯互为同系物 C、化合物2可以与乙二醇发生缩聚反应 D、化合物2中有两个手性碳(一个碳原子连四个不同的原子或原子团)8. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、c(H+)=c(OH-)的溶液:Fe2+、K+ , Cl- , Na+ B、硫化钠溶液:Fe2+、K+、Cl-、 C、焰色试验呈黄色的溶液:、K+、、 D、水电离出的c(H+)=1×10-10 mol·L-1的溶液:Na+、K+、、Cl-9. 设NA表示阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,22.4 L氯乙烷所含分子数为NA B、25℃时,pH=14的NaOH溶液中阴、阳离子总数为2NA C、2 mol SO2和1 mol 18O2充分反应,产物中含18O原子数为2NA D、78g苯和立方烷( )的混合物中,C-H键数目为6NA
10. 有机化合物分子中基团之间的相互影响会导致物质的化学性质不同。下列事实不可以用上述观点解释的是( )A、苯不能与溴水发生取代反应,而苯酚能与溴水发生取代反应 B、乙醇不能与碱发生中和反应,而乙酸能与碱发生中和反应 C、2-甲基-1-丙醇能发生消去反应,2,2-二甲基-1-丙醇不能发生消去反雇 D、乙烷不能使高锰酸钾溶液褪色,而甲苯能使高锰酸钾溶液褪色11. 由下列实验操作及现象得出的结论正确的是( )
)的混合物中,C-H键数目为6NA
10. 有机化合物分子中基团之间的相互影响会导致物质的化学性质不同。下列事实不可以用上述观点解释的是( )A、苯不能与溴水发生取代反应,而苯酚能与溴水发生取代反应 B、乙醇不能与碱发生中和反应,而乙酸能与碱发生中和反应 C、2-甲基-1-丙醇能发生消去反应,2,2-二甲基-1-丙醇不能发生消去反雇 D、乙烷不能使高锰酸钾溶液褪色,而甲苯能使高锰酸钾溶液褪色11. 由下列实验操作及现象得出的结论正确的是( )选项
实验操作
现象
结论
A
取5 mL0.11 mol·L-1KI 溶液于试管中,加入1 mL0.1 mol·L-1FeCl3溶液,充分反应后滴入5滴15%KSCN溶液
溶液变血红色
KI与FeCl3的反应有一定限度
B
向溶液X中滴加少量NaOH稀溶液,将湿润的红色石蕊试纸靠近试管口
石蕊试纸不变蓝
溶液X中肯定不含
C
将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中
溶液变黄色
氧化性:H2O2> Fe3+ (酸性条件)
D
向一定浓度的CuSO4溶液中通入适量H2S气体
产生黑色沉淀
H2S的酸性比H2SO4的强
A、A B、B C、C D、D12. 已知:M、N、P、Q是化学中常见的物质,它们之间有如图反应关系。下列说法正确的是( ) A、若M是具有磁性的黑色金属氧化物,则P、Q不可相互转化 B、若N是石灰乳,则工业上可以上述物质转化关系为原理处理尾气中的氯气 C、若M、N分别为NH4Cl固体和NaOH固体,则上述物质转化关系为实验室制备氨气的原理 D、若M、N、P、Q均含同一种元素,且常温下P为黄色固体单质,则M、N均能与Q反应13. 漂白粉和漂粉精都是生产生活中的常见物质,工业上生产漂粉精的流程如图所示。下列有关说法正确的是( )
A、若M是具有磁性的黑色金属氧化物,则P、Q不可相互转化 B、若N是石灰乳,则工业上可以上述物质转化关系为原理处理尾气中的氯气 C、若M、N分别为NH4Cl固体和NaOH固体,则上述物质转化关系为实验室制备氨气的原理 D、若M、N、P、Q均含同一种元素,且常温下P为黄色固体单质,则M、N均能与Q反应13. 漂白粉和漂粉精都是生产生活中的常见物质,工业上生产漂粉精的流程如图所示。下列有关说法正确的是( ) A、漂粉精的有效成分为氯酸钙,应密封存放于避光干燥处 B、电解饱和食盐水时,两个电极均不能使用金属材料 C、反应②的化学方程式为2Na2CO2+H2O+2Cl2=2NaCl+2NaHCO3+C2O D、上述生产过程涉及的反应有氧化还原反应、置换反应、复分解反应14. 由原子序数依次增大的四种短周期主族元素X、Y、Z、W组成的化合物Q广泛应用于锂离子电池,化合物Q的结构如图,其中Y、W为同主族的元素。下列说法正确的是( )
A、漂粉精的有效成分为氯酸钙,应密封存放于避光干燥处 B、电解饱和食盐水时,两个电极均不能使用金属材料 C、反应②的化学方程式为2Na2CO2+H2O+2Cl2=2NaCl+2NaHCO3+C2O D、上述生产过程涉及的反应有氧化还原反应、置换反应、复分解反应14. 由原子序数依次增大的四种短周期主族元素X、Y、Z、W组成的化合物Q广泛应用于锂离子电池,化合物Q的结构如图,其中Y、W为同主族的元素。下列说法正确的是( ) A、非金属性:Z>Y>X B、单核阴离子半径:W<Y C、Y在同周期元素中最难失电子 D、Y元素只能形成双原子分子的单质15. 在“价一类”二维图中融入“杠杆模型”,可直观辨析部分物质间的转化及其定量关系。图中的字母分别代表常见的含氯元素的物质,下列相关推断不合理的是( )
A、非金属性:Z>Y>X B、单核阴离子半径:W<Y C、Y在同周期元素中最难失电子 D、Y元素只能形成双原子分子的单质15. 在“价一类”二维图中融入“杠杆模型”,可直观辨析部分物质间的转化及其定量关系。图中的字母分别代表常见的含氯元素的物质,下列相关推断不合理的是( ) A、室温下,c的稀溶液和变价金属反应一定生成相应金属的高价盐 B、b、d、f既具有氧化性又具有还原性 C、若e为钠盐,实验室可用e和浓硫酸反应制取少量气态a D、若d在加热条件下与强碱溶液反应生成的含氯化合物只有e和f,则n(e):n(f)=5:1
A、室温下,c的稀溶液和变价金属反应一定生成相应金属的高价盐 B、b、d、f既具有氧化性又具有还原性 C、若e为钠盐,实验室可用e和浓硫酸反应制取少量气态a D、若d在加热条件下与强碱溶液反应生成的含氯化合物只有e和f,则n(e):n(f)=5:1二、非选择题:本题共4小题,共55分。
-
16. 物质之间的转化关系如图,部分生成物省略。金属M在潮湿的空气中生锈有A生成。C、D是由短周期元素X,Y、Z中两种组成的化合物,X、Y,Z的原子序数依次增大,在周期表中X的原子半径最小,Y,Z的原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色气体单质,J、M为常见金属单质,I有漂白作用。

请回答下列问题:
(1)、I的结构式为。(2)、写出反应②的化学方程式: , 反应中体现葡萄糖的性。(3)、YX4与X2Z中沸点较高的是 (填化学式)。(4)、写出A的化学式:。(5)、已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体,请写出该反应的离子方程式:。(6)、在含有K和L的混合溶液中,检验K中金属阳离子的方法为。17. 磁性氧化铁因其特殊的超顺磁性,在巨磁电阻、磁性液体和磁记录、软磁、永磁、磁致冷,巨磁阻抗材料以及磁光器件、磁探测器等方面具有广阔的应用前景。以高硫铝土矿(主要含Al2O3、Fe2O3、SiO2和少量的FeS2等)为原料提取氧化铝和磁性氧化铁的流程如下: (1)、磁性氧化铁的化学式为;写出滤渣Ⅰ中主要成分的两种用途:。(2)、操作Ⅰ在实验中要用到的玻璃仪器有。(3)、焙烧Ⅰ中,FeS2发生反应的化学方程式为。(4)、焙烧Ⅰ的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是(任答一点)。
(1)、磁性氧化铁的化学式为;写出滤渣Ⅰ中主要成分的两种用途:。(2)、操作Ⅰ在实验中要用到的玻璃仪器有。(3)、焙烧Ⅰ中,FeS2发生反应的化学方程式为。(4)、焙烧Ⅰ的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是(任答一点)。 (5)、焙烧Ⅱ中氧化铝参与反应的化学方程式为。(6)、反应Ⅲ中加入FeS2的目的是作(填“氧化剂"或“还原剂")。反应I的煅烧温度对磁性氧化铁的纯度有很大影响。已知温度对磁性氧化铁纯度的影响如图所示,则煅烧时,温度最好控制在℃。
(5)、焙烧Ⅱ中氧化铝参与反应的化学方程式为。(6)、反应Ⅲ中加入FeS2的目的是作(填“氧化剂"或“还原剂")。反应I的煅烧温度对磁性氧化铁的纯度有很大影响。已知温度对磁性氧化铁纯度的影响如图所示,则煅烧时,温度最好控制在℃。 (7)、滤液经过一系列操作可获得Al2O3 , 请简述这一系列操作的具体过程:。18. 亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。某实验小组设计实验制备氯化亚砜并探究其性质。
(7)、滤液经过一系列操作可获得Al2O3 , 请简述这一系列操作的具体过程:。18. 亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。某实验小组设计实验制备氯化亚砜并探究其性质。已知:①实验室制备原理为PCl3+SO2+Cl2 POCl3+SOCl2
②资料卡片:
物质
熔点/℃
沸点/℃
相对分子质量
其他
PCl3
-112
76.1
137.5
遇水剧烈水解,易与O2反应
POCl3
1.25
105.8
153. 5
遇水剧烈水解,能溶于PCl3
SOCl2
-105
78.8
119
遇水剧烈水解,受热易分解
实验一:制备并探究SOCl2的性质,制备SOCl2的装置如图(夹持装置已略去)。
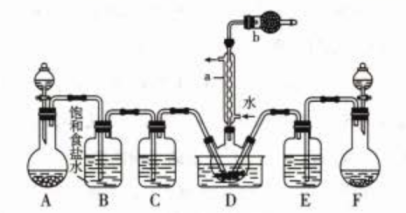 (1)、a仪器的名称为 , b装置的作用是。(2)、SO2可通过Na2SO3固体与70%浓H2SO4反应制取,Cl2可通过KMnO4固体与浓盐酸
(1)、a仪器的名称为 , b装置的作用是。(2)、SO2可通过Na2SO3固体与70%浓H2SO4反应制取,Cl2可通过KMnO4固体与浓盐酸反应制取,则上图中制取Cl2的装置为(填字母)。
(3)、把用上述装置制得的SOCl2通过蒸馏方法提取出来(加热及夹持装置略),装置安装顺序为①⑨⑧(填序号)。 (4)、甲同学认为SOCl2可用作热分解FeCl3·6H2O制取无水FeCl3的脱水剂,反应的化学方程式为;但乙同学认为该实验可能发生副反应使产品不纯,所以乙同学取少量FeCl3·6H2O在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2 , 加水溶解,取溶解后的溶液少许,加入(填写试剂和实验现象),说明发生了副反应。
(4)、甲同学认为SOCl2可用作热分解FeCl3·6H2O制取无水FeCl3的脱水剂,反应的化学方程式为;但乙同学认为该实验可能发生副反应使产品不纯,所以乙同学取少量FeCl3·6H2O在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2 , 加水溶解,取溶解后的溶液少许,加入(填写试剂和实验现象),说明发生了副反应。实验二:测定某SOCl2样品中SOCl2的纯度。
①准确称量称量瓶和盖的总质量m1g,迅速加入0.6 mLSOCl2样品,立即盖紧,称量,质量为m2g。
②连同称量瓶一起放入盛有300 mL NaOH溶液的密封水解瓶中,盖紧并用蒸馏水封口,轻轻摇动,待称量瓶盖打开,将水解瓶放人冰水浴,浸泡水解1 h后,将水解瓶中的溶液全部转移到500 mL.容量瓶中,洗涤水解瓶2~3次,洗涤液一并转 人容量瓶中,静置至室温,定容,摇匀,得到溶液M。
③准确量取50.00 mL.溶液M于250 ml碘量瓶中,加入两滴指示剂,用2 mol·L-1的盐酸中和过量的NaOH溶液至恰好完全。
④准确加入50.00 mL 0.0500 mol·L-1碘标准溶液,充分反应后,用淀粉溶液作指示剂,用
0.1000 mol·L-1的Na2S2O3溶液滴定过量的碘,反应为I2+2Na2S2O3=Na2S4O6+2Nal。平行测定两次,反应消耗Na2S2O3溶液的平均体积为V mL。
(5)、判断滴定终点的方法为 , 样品中SOCl2的质量分数为;下列情况会导致测定的SOCl2的质量分数偏高的是(填标号)。A.实际碘标准溶液浓度偏低
B.实际Na2S2O3溶液浓度偏低
C.水解过程,气体吸收不充分,有部分气体逸出
D.滴定达终点时发现滴定管尖嘴内有气泡生成
19. 天然产物G具有抗肿瘤等生物活性,某课题组设计的合成路线如图(部分反应条件已省略):
请回答:
(1)、有机物G中含有的官能团的名称为。(2)、化合物B的结构简式为 。(3)、写出B→C的化学方程式 , 其反应类型为。(4)、有机物K是G的同分异构体,其中含有3个六元碳环(其结构为 ),同时符合下列条件的有机物K有种。
),同时符合下列条件的有机物K有种。 ①遇FeCl3溶液会发生显色反应
②与NaHCO3溶液反应有气体生成
(5)、以化合物 和
和 为原料合成
为原料合成 的路线如下。则反应条件①为 , 中间产物Ⅰ的结构简式为。
的路线如下。则反应条件①为 , 中间产物Ⅰ的结构简式为。 