江苏省苏州市高新区2022-2023学年九年级上学期期中化学试题
试卷更新日期:2022-11-15 类型:期中考试
一、单选题
-
1. 2022年北京冬奥会秉承“绿色、开放、共享、廉洁”理念,采用多种措施力图实现“碳中和”。下列做法没有体现绿色化学思想的是( )A、市民乘坐私家车观看奥运赛事 B、在赛事场馆附近和周围植树种草 C、采用二氧化碳跨临界直冷技术制冰造雪 D、采用光伏发电和风力发电提供电力支持2. “神舟十三号”执行的下列任务中,一定涉及化学变化的是( )A、出舱行走 B、展示国旗 C、采集水样 D、点火返回3. 下列物质由离子构成的是( )A、铜 B、金刚石 C、氯化钠 D、干冰4. 实验室用于盛放少量石灰石的仪器是( )A、
 B、
B、 C、
C、 D、
D、 5. 我国的下列科技新成果,不属于化学研究范畴的是( )A、实现从一氧化碳到蛋白质的人工合成 B、实现从二氧化碳到淀粉的人工合成 C、C60与金属铜复合催化低温合成乙二醇 D、射电望远镜捕获世界最大快速射电暴6. 下列变化中,属于缓慢氧化的是( )A、木炭燃烧 B、粮食腐烂 C、干冰人工降雨 D、燃放烟花7. 下列化学反应属于分解反应的是( )A、Cu+O2CuO B、Cu2(OH)2CO3CuO + CO2 + H2O C、CO+Fe2O3Fe+CO2 D、NaOH+HClNaCl+H2O8. 下列图示实验操作中,正确的是( )A、检查装置的气密性
5. 我国的下列科技新成果,不属于化学研究范畴的是( )A、实现从一氧化碳到蛋白质的人工合成 B、实现从二氧化碳到淀粉的人工合成 C、C60与金属铜复合催化低温合成乙二醇 D、射电望远镜捕获世界最大快速射电暴6. 下列变化中,属于缓慢氧化的是( )A、木炭燃烧 B、粮食腐烂 C、干冰人工降雨 D、燃放烟花7. 下列化学反应属于分解反应的是( )A、Cu+O2CuO B、Cu2(OH)2CO3CuO + CO2 + H2O C、CO+Fe2O3Fe+CO2 D、NaOH+HClNaCl+H2O8. 下列图示实验操作中,正确的是( )A、检查装置的气密性 B、滴加液体
B、滴加液体 C、准备收集气体
C、准备收集气体 D、读取液体体积
D、读取液体体积 9. 人类的生存离不开氧气,下列关于氧气说法错误的是:( )A、保持氧气化学性质的最小粒子是氧分子 B、鱼类能在水中生存,说明氧气易溶于水 C、植物的光合作用是空气中氧气的主要来源 D、氧气能供给呼吸,与物质反应释放能量,维持生命活动10. 对下列实验中出现的异常现象分析合理的是( )A、加热碱式碳酸铜固体粉末时,试管破裂——加热时试管口略向下倾斜 B、细铁丝在氧气中燃烧时,集气瓶底炸裂——没有等火柴燃尽就放入集气瓶中 C、盛有稀盐酸的试剂瓶的标签腐蚀——倾倒液体时,标签没有向着手心 D、做测定空气中氧气含量实验时,进入集气瓶中的水大于——红磷过量11. 北京冬奥会上采用了碲化镉发电玻璃,碲元素在元素周期表中的信息如下图所示。下列有关碲的说法正确的是( )
9. 人类的生存离不开氧气,下列关于氧气说法错误的是:( )A、保持氧气化学性质的最小粒子是氧分子 B、鱼类能在水中生存,说明氧气易溶于水 C、植物的光合作用是空气中氧气的主要来源 D、氧气能供给呼吸,与物质反应释放能量,维持生命活动10. 对下列实验中出现的异常现象分析合理的是( )A、加热碱式碳酸铜固体粉末时,试管破裂——加热时试管口略向下倾斜 B、细铁丝在氧气中燃烧时,集气瓶底炸裂——没有等火柴燃尽就放入集气瓶中 C、盛有稀盐酸的试剂瓶的标签腐蚀——倾倒液体时,标签没有向着手心 D、做测定空气中氧气含量实验时,进入集气瓶中的水大于——红磷过量11. 北京冬奥会上采用了碲化镉发电玻璃,碲元素在元素周期表中的信息如下图所示。下列有关碲的说法正确的是( )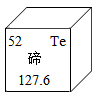 A、碲原子的最外层电子数为52 B、碲的元素符号为Te C、碲的相对原子质量为127.6g D、碲属于金属元素12. 下列物质的性质与用途具有对应关系的是( )A、石墨能导电,可用于制作铅笔芯 B、氮气化学性质稳定,可用作保护气 C、镁带具有银白色金属光泽,可用作烟花 D、酒精具有挥发性,可用于杀菌消毒13. 下列有关化学用语表示正确的是( )A、8个硫原子:S8 B、氧化铝: AlO C、2个镁离子:2Mg+2 D、硅元素:Si14. 下列探究影响化学反应速率因素的实验中,实验方案正确的是( )
A、碲原子的最外层电子数为52 B、碲的元素符号为Te C、碲的相对原子质量为127.6g D、碲属于金属元素12. 下列物质的性质与用途具有对应关系的是( )A、石墨能导电,可用于制作铅笔芯 B、氮气化学性质稳定,可用作保护气 C、镁带具有银白色金属光泽,可用作烟花 D、酒精具有挥发性,可用于杀菌消毒13. 下列有关化学用语表示正确的是( )A、8个硫原子:S8 B、氧化铝: AlO C、2个镁离子:2Mg+2 D、硅元素:Si14. 下列探究影响化学反应速率因素的实验中,实验方案正确的是( )选项
影响因素
实验方案
A
接触面积
将1g块状石灰石和20mL10%的稀盐酸、1g粉末状石灰石与20mL10%的稀硫酸混合,比较产生气泡的快慢
B
催化剂的种类
将0.5g二氧化锰、1g氧化铁分别与10mL6%的过氧化氢溶液混合,比较产生气泡的快慢
C
反应物的种类
分别将木炭在空气中、氧气中燃烧,比较反应的剧烈程度
D
反应物的性质
分别用酒精灯加热表面积相同的镁片和铁片,比较在空气中能否被点燃
A、A B、B C、C D、D15. 归纳是学习化学的重要方法,下列说法正确的是( )A、质子数决定元素的种类 B、带正电荷的微粒一定是阳离子 C、原子中一定含有质子、中子、电子 D、组成元素相同的物质,化学性质一定相同16. 从中药中提取的calebinA(化学式为C21H20O7)可用于治疗阿尔茨海默症(也称“老年痴呆症”)。下列关于calebinA的说法正确的是( )A、calebinA的相对分子质量为384g B、1个calebinA分子是由48个原子构成的 C、calebinA由21个碳原子、20个氢原子和7个氧原子构成 D、calebinA中氧元素的质量分数最小17. 下列实验方案不能达到实验目的的是( )选项
实验目的
实验方案
A
除去氮气中的少量氧气
将气体通过灼热的木炭
B
验证纸张中含有碳元素
将纸张燃烧产生的气体通入澄清石灰水
C
鉴别食盐和碳酸氢铵
取样,分别加热,闻其气味
D
鉴别食盐水和蒸馏水
玻璃棒蘸取水样,分别在酒精灯火焰上灼烧,观察现象
A、A B、B C、C D、D18. 航天员饮用水属于小分子团水,小分子团水由5~8个水分子构成,一次饮用125mL 小分子团水可维持人6小时正常需水量。下列说法正确的是( )A、小分子团水是由水分子构成的 B、小分子团水中的水分子是静止的 C、小分子团水的组成元素和普通水不同 D、小分子团水与普通水的密度一样19. 推理是一种重要的化学思维方法,以下推理正确的是( )A、H2O和 H2O2的组成元素相同,所以它们的化学性质相同 B、氧化物含有氧元素,所以含有氧元素的化合物一定是氧化物 C、化学变化常常伴随能量的变化,所以有能量变化的一定属于化学变化 D、单质是由一种元素组成的纯净物,所以由一种元素组成的纯净物一定是单质20. 利用铁粉、炭粉、氧化钠进行铁的锈蚀实验(装置如图所示,装置气密性良好)。实验1min后温度计读数上升,8min后打开止水夹,水倒吸入锥形瓶。实验数据如下表,下列说法合理的是( )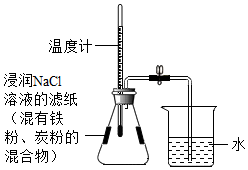
实验前的体积
实验后的体积
锥形瓶内空气(含导管内空气)
烧杯内水
烧杯内剩余水
246.0mL
100.0mL
51.5mL
A、铁的锈蚀是吸热反应 B、此实验能推断出铁的锈蚀需要水的参与消耗氧气 C、使用氯化钠溶液的目的是加快铁的锈蚀 D、计算得出空气中氧气的含量约为21.0%二、填空题
-
21. 化学与人类生活息息相关。请回答下列问题。(1)、“75%消毒酒精”涂抹在手上,手很快变干,说明微粒。(2)、进入久未开启的菜窖之前必须先检验菜窖中的含量,防止危害到人的健康。(3)、木耳中铁元素量很高,可对患有的人群有很好的辅助治疗作用。(4)、金刚石可用于切割玻璃,是因为金刚石的大。22. 水是生命之源。2022年3月22日是第三十届“世界水日”,其主题为“珍惜地下水,珍视隐藏的资源”。(1)、地下水是(填“混合物”或“纯净物”)。(2)、地下水在土壤和岩石中渗透到井中,就形成井水,在生活中可以用的方法来降低井水的硬度;可加入 , 振荡,比较该操作前后井水的硬度大小。(3)、机场、车站等公共场所设有许多直饮水机,能将自水进一步净化处理得到可直接饮用水,其处理水的过程如图所示。

吸附罐中固体颗粒的主要作用是吸附杂质,固体颗粒可选用。
(4)、宇航员一部分生活用氧可通过电解水制得。如右图是电解水的实验示意图,玻璃管(填“a”或“b”)中的气体能使带火星的木条复燃。该实验说明水是由组成的。 (5)、通常所说的水为H2O,而更广义的水还包括矿物中的氢氧基团(OH)、其他形式的氢(H),它们在高温下以水分子的形式释放出来。下图(A~C)是氢、氧原子及其构成微粒的示意图。
(5)、通常所说的水为H2O,而更广义的水还包括矿物中的氢氧基团(OH)、其他形式的氢(H),它们在高温下以水分子的形式释放出来。下图(A~C)是氢、氧原子及其构成微粒的示意图。
①一定条件下由A生成C的符号表达式为。ABC的变化过程中,不变的是。
②参照如图微粒表示方法,面出“氢氧基团(OH)和氢(H)结合成水分子”的微观示意图:。
23. 氧气支持生命活动,同时也是一种重要的化工原料。(1)、Ⅰ.工业上有多种制取氧气的方法,如:方法一:在低温、加压条件下,将空气液化。然后将温度升高至-196℃~-183℃之间,使液态氮气先蒸发,剩余液态氧气储存于钢瓶里。
方法二:利用电解水的方法制取氧气,将得到的氧气干燥。在低温,加压条件下,使之转化为液态,储存于钢瓶里。
从构成物质的微粒视角分析,在方法一空气液化过程中,主要改变的是。
(2)、某工厂用方法二制取氧气,且所得氧气中有少量的臭氧(O3)。请推测:电解水时,正极收集的气体与负极收集的气体的体积比(填写“小于”或“等于”或“大于”)。(3)、Ⅱ.氢气和氧气在Pd基催化剂表面可反应生成H2O2 , 其微观示意图如图: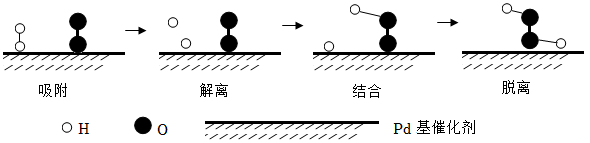
“解离”时,结构被破坏的分子是(填化学式)。
(4)、Ⅲ.实验室可以用过氧化氢制取氧气,为探究过氧化氢的分解,进行以下两个实验:ⅰ.小组同学不加催化剂,在不同温度下,用不同浓度的H2O2进行实验,记录实验现象如下表1。
表1探究温度、反应物的浓度对反应速率的影响
50℃
60℃
70℃
5%(H2O2)
无明显气泡
无明显气泡
极少量气泡
10%(H2O2)
无明显气泡
无明显气泡
少量气泡
15%(H2O2)
无明显气泡
少量气泡
较多气泡
由表1可知: 温度或反应物浓度可加快 H2O2的分解。
(5)、ⅱ.在室温条件下,小组同学使用6.0mL30%双氧水,进行实验1.5h,记录如下表2。资料:常见可溶性氯化物在水溶液中大都是以阳离子和氯离子形式分散的。
表2探究氯化物对反应速率的影响
实验1
实验 2
实验 3
氯化物的种类
NaCl
MgCl2
CuCl2
氯化物的质量
0.1 g
a g
0.1 g
放出氧气的体积/mL
2.0
4.0
420.0
双氧水的分解率/%
0.30
0.60
63.18
在表2中,a的值为;
(6)、由表2可知:实验3中反应的符号表达式是;(7)、双氧水保存时应绝对避免引入的离子是(写离子符号)。(8)、【拓展延伸】用双氧水可制得“钙多宝”。“钙多宝”主要成分是CaO2 , 常温下能与水反应生成氢氧化钙和氧气。长时间存放的过氧化钙中含有主要杂质是Ca(OH)2和CaCO3。
请用符号表达式说明出现上述杂质的原因:;。
三、综合题
-
24. 高锰酸钾是一种医疗、实验室经常使用的药品。请阅读下列资料,完成相关问题。
高锰酸钾为紫黑色晶体,有毒,对人体组织器官一定的腐蚀性,具有强氧化性,其稀溶液为浅紫红色,能与维生素C反应得到无色溶液。高锰酸钾在酸性环境中会缓慢反应生成二氧化锰、钾盐和氧气,且光对这种分解有催化作用。
高锰酸钾遇有机物时即释救出初生态氧,初生态氧即游离态的氧原子,具有极强的氧化性,作用于子菌体蛋白,破坏其结构,从而使之死亡。高锰酸钾杀菌所需浓度较低,0.01%-0.1%作用 10-30分钟可杀灭细菌繁殖体、病毒和破坏肉毒杆菌毒素,过氧化氢溶液杀菌的原理类似于高锰酸钾,但高锰酸钟抗菌除臭作用比过氧化氯溶液强而持久,其杀菌力随浓度升高而增强。 0.1%时可杀死多数细菌的繁殖体,2%-5%溶液能在24小时内可杀死细菌。在酸性条件下可明显提高杀菌作用,如在1%溶液中加入11%盐酸,能在 30 秒钟内杀死炭疽芽孢。
工业上可用二氧化锰和氢氧化钾为原料,经熔融、氧化、电解等环节生产高锰酸钾。
(1)、实验室可以用高锰酸钾制取氧气:①实验前,要在试管口放置一小团蓬松的以防止;高锰酸钾受热分解的符号表达式为。
②加热高锰酸钾后的试管内壁上往往有棕色物质,很难刷洗干净。所以除了用酸性物质清洗以外,还可以用洗涤沾有高锰酸钾的试管。
③在实验室里,高锰酸钾常用的保存方法是。
(2)、下列有关说法正确的是____A、高锰酸钾的杀菌原理属于化学变化 B、高锰酸钾溶液的浓度越大,杀菌效果越好 C、酸性环境会导致高锰酸钾的氧化性增强 D、过氧化氢溶液也有杀菌作用,因为该溶液中也含有初生态氧(3)、某工厂生产高锰酸钾的流程如图所示。
①在氧化室中,除了二氧化锰和氢氧化钾外,还有参与发应,此反应还生成水,则反应的符号表达式为。
②为了实现电解室中的反应,还需要提供含元素的反应物,该过程的能量转化形式是。
25. 在实验室里,利用下列实验装置制取有关气体,并进行有关气体的性质实验。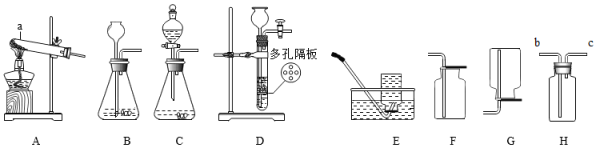 (1)、图中仪器a的名称是。(2)、实验室制备氧气,进行蜡烛燃烧实验,并验证产物。
(1)、图中仪器a的名称是。(2)、实验室制备氧气,进行蜡烛燃烧实验,并验证产物。①应选择的药品是(填下列字母序号)。
a.氯酸钾和二氧化锰 b.过氧化氢溶液和二氧化锰
②应选择的装置组合是从上述实验装置“A-G”中选择)。
(3)、为了研究铁丝燃烧的剧烈程度与氧气浓度的关系,需要用法收集不同浓度的氧气。请写出铁丝在氧气燃烧的符号表达式。(4)、实验室用大理石和稀盐酸反应制取二氧化碳,反应的符号表达式是。(5)、B、C、D装置均可用作制取二氧化碳的发生装置,D装置与B、C装置相比,其突处的优点是。关闭开关后,C中多孔隔板处依此观察到的显示是(如下图所示,用字母e、f、g进行排序)。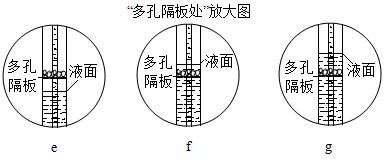 (6)、若选择H装置采用排空气法收集二氧化碳,验满的方法是。(7)、若将产生的二氧化碳通入紫色石蕊溶液中,溶液变色,其原因是,(写出该反应的符号表达式)。(8)、实验室可以用锌粒和稀硫酸常温下反应制取氢气,若要获得平稳的氢气流,应选择的发生装置是(填字母号)。E、G装置可用来收集氢气,据此说明氢气具有物理性质(写出一点即)。26. 电石渣[主要成分为Ca(OH)2 , 还含有MgO等杂质]是一种工业废渣,以它为原料可生产纳米碳酸钙,制备方案如下:
(6)、若选择H装置采用排空气法收集二氧化碳,验满的方法是。(7)、若将产生的二氧化碳通入紫色石蕊溶液中,溶液变色,其原因是,(写出该反应的符号表达式)。(8)、实验室可以用锌粒和稀硫酸常温下反应制取氢气,若要获得平稳的氢气流,应选择的发生装置是(填字母号)。E、G装置可用来收集氢气,据此说明氢气具有物理性质(写出一点即)。26. 电石渣[主要成分为Ca(OH)2 , 还含有MgO等杂质]是一种工业废渣,以它为原料可生产纳米碳酸钙,制备方案如下: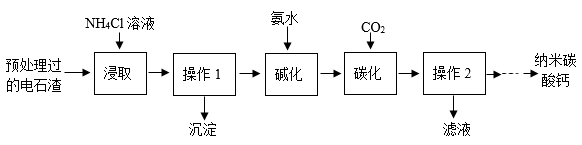
已知:①氨水中含有氨气、水以及NH3·H2O,且NH3·H2O受热易分解。
②“浸取”时的主要反应为;
③“碳化”时的主要反应为。
(1)、电石渣久置在空气中会产生一定量的碱式碳酸钙[Ca3(OH)2(CO3)n],化学式中的n为。(2)、用不同质量分数的NH4Cl溶液浸取电石渣时,Ca元素提取率和Mg元素去除率的数值如图所示,你认为较适宜的NH4Cl质量分数是。 (3)、浸取时,向浸取液中滴加一定量的氨水,将镁元素全部沉淀,则操作1为(填操作名称)。(4)、工业上将操作1所得溶液碱化后,得到碱化液,再进行喷雾碳化,碳化塔的构造如图所示,CO2从A处通入,其目的是。
(3)、浸取时,向浸取液中滴加一定量的氨水,将镁元素全部沉淀,则操作1为(填操作名称)。(4)、工业上将操作1所得溶液碱化后,得到碱化液,再进行喷雾碳化,碳化塔的构造如图所示,CO2从A处通入,其目的是。 (5)、测得不同温度下碳化反应所需时间如下表(其他条件相同):
(5)、测得不同温度下碳化反应所需时间如下表(其他条件相同):温度
反应液浑浊所需时间(单位:秒)
反应完全所需时间(单位:分钟)
20℃
480
>180
40℃
120
180
60℃
1
50
80℃
1
68
实际碳化反应的温度采用了60℃,理由是、。
(6)、该工艺流程中循环利用的物质为。