浙江省三校2022-2023学年高一上学期10月联考化学试题
试卷更新日期:2022-11-09 类型:月考试卷
一、单选题
-
1. 下列物质中属于正盐的是( )A、 B、NaH C、 D、2. 下列分散系属于胶体的是( )A、硫酸溶液 B、泥浆水 C、云雾 D、生理盐水3. 下列仪器名称为“漏斗”的是( )A、
 B、
B、 C、
C、 D、
D、 4. 下列说法正确的是( )A、根据能否发生丁达尔效应,将分散系划分为溶液、胶体、浊液 B、根据能否电离出氢离子判断电解质是否为酸 C、碱性氧化物都是金属氧化物,酸性氧化物都是非金属氧化物 D、金刚石、石墨互为同素异形体5. 在下列反应中,水既不是氧化剂又不是还原剂的是( )A、F2 + H2O (生成F2和HF) B、Na + H2O C、NaH + H2O(生成H2和NaOH) D、Na2O2 + H2O6. 下列物质中,属于电解质且该状态下能导电的是( )A、稀盐酸 B、熔融的氢氧化钠 C、石墨 D、固体氯化钠7. 下列物质在水溶液中的电离方程式中,正确的是( )A、 B、 C、 D、8. 化学创造美好生活,下列相关说法错误的是( )A、为防止中秋月饼等富脂食品被氧化,常在包装袋中放入生石灰 B、节日燃放的烟花的焰火,实质上是金属元素的焰色试验所呈现的色彩 C、过氧化钠可用作呼吸面具的供氧剂 D、红酒中的花青素在碱性环境下显蓝色,可用苏打粉检验假红酒9. 下列微粒只能表现氧化性的是( )A、 B、 C、 D、10. 下列各组离子在无色强酸性溶液中能大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、11. 钠是一种非常活泼的金属,可以和很多物质发生反应,例如 , 下列有关说法错误的是( )A、反应中CO2是氧化剂 B、反应中Na2CO3是氧化产物 C、该反应中氧化剂和还原剂的质量比为33:23 D、反应中钠失电子,被氧化12. 下列离子反应方程式书写正确的是( )A、少量钠投入水中: B、小苏打溶液与足量盐酸反应: C、硫酸镁溶液与氢氧化钡溶液反应: D、NH4HSO4溶液与少量的NaOH溶液反应:13. 依据下列相关实验,所得结论正确的是( )
4. 下列说法正确的是( )A、根据能否发生丁达尔效应,将分散系划分为溶液、胶体、浊液 B、根据能否电离出氢离子判断电解质是否为酸 C、碱性氧化物都是金属氧化物,酸性氧化物都是非金属氧化物 D、金刚石、石墨互为同素异形体5. 在下列反应中,水既不是氧化剂又不是还原剂的是( )A、F2 + H2O (生成F2和HF) B、Na + H2O C、NaH + H2O(生成H2和NaOH) D、Na2O2 + H2O6. 下列物质中,属于电解质且该状态下能导电的是( )A、稀盐酸 B、熔融的氢氧化钠 C、石墨 D、固体氯化钠7. 下列物质在水溶液中的电离方程式中,正确的是( )A、 B、 C、 D、8. 化学创造美好生活,下列相关说法错误的是( )A、为防止中秋月饼等富脂食品被氧化,常在包装袋中放入生石灰 B、节日燃放的烟花的焰火,实质上是金属元素的焰色试验所呈现的色彩 C、过氧化钠可用作呼吸面具的供氧剂 D、红酒中的花青素在碱性环境下显蓝色,可用苏打粉检验假红酒9. 下列微粒只能表现氧化性的是( )A、 B、 C、 D、10. 下列各组离子在无色强酸性溶液中能大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、11. 钠是一种非常活泼的金属,可以和很多物质发生反应,例如 , 下列有关说法错误的是( )A、反应中CO2是氧化剂 B、反应中Na2CO3是氧化产物 C、该反应中氧化剂和还原剂的质量比为33:23 D、反应中钠失电子,被氧化12. 下列离子反应方程式书写正确的是( )A、少量钠投入水中: B、小苏打溶液与足量盐酸反应: C、硫酸镁溶液与氢氧化钡溶液反应: D、NH4HSO4溶液与少量的NaOH溶液反应:13. 依据下列相关实验,所得结论正确的是( )选项
A
B
C
D
实验装置或观图




实验结论
铜丝可以导电,所以铜单质是电解质。
干燥的氯化钠不导电,所以晶体中无阴阳离子。
NaCl在水中的电离需要通电才可完成。
熔融的NaCl能导电,所以NaCl是电解质。
A、A B、B C、C D、D14. 某溶液中大量存在以下五种离子:、、Fe3+、H+、M,它们的微粒数比为n():n():n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能为( )A、Mg2+ B、Na+ C、 D、Ba2+15. 下列有关和比较中,取等质量的碳酸钠和碳酸氢钠做下列实验,其中结论正确的是( )A、分别进行加热,热稳定性: B、分别加水至恰好溶解完全,消耗水的质量: C、分别与足量盐酸反应放出气体的量: D、分别与等浓度的盐酸反应,剧烈程度:16. 氧化还原对立统一,同时存在。下列变化中,必须加入还原剂才能实现的是( )A、Cu→ B、KClO3→KCl C、CuO→Cu D、Na→NaCl17. 焰色试验过程中铂丝的清洗和灼烧与钾的焰色试验的观察两项操作如图所示:下列叙述中正确的是( ) A、焰色试验是一种化学变化 B、铁丝会和盐酸反应,所以它不能代替铂丝进行焰色试验 C、焰色试验可以检验所有的金属元素 D、若某无色溶液的焰色试验不用蓝色钴玻璃直接观察到焰色为浅紫色,则说明该溶液只含K+无Na+18. 已知还原性 , 下列反应不能发生的是( )A、 B、 C、 D、19. 为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气,下列关于Na2O2的叙述正确的是( )
A、焰色试验是一种化学变化 B、铁丝会和盐酸反应,所以它不能代替铂丝进行焰色试验 C、焰色试验可以检验所有的金属元素 D、若某无色溶液的焰色试验不用蓝色钴玻璃直接观察到焰色为浅紫色,则说明该溶液只含K+无Na+18. 已知还原性 , 下列反应不能发生的是( )A、 B、 C、 D、19. 为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气,下列关于Na2O2的叙述正确的是( )①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,转移电子数相等
③Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
④Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑤Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
A、①③⑤ B、②③⑤ C、①②⑤ D、①④⑤20. 某已经配平的氧化还原反应 , 有关m和X元素的化合价取值合理的是( )A、7,+5 B、4,+7 C、4,+6 D、3,+521. 18.6g由、NaOH组成的混合物与100g质量分数为14.6%的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体的质量为( )A、23.4g B、16.5g C、11.7g D、8.0g22. 为除去括号中的杂质,下列所选择的试剂正确的是( )A、CO2(CO):加热条件下通入足量氧气 B、CO2气体(HCl):通入饱和碳酸钠溶液 C、固体(固体):加热至不再产生气体 D、溶液():加适量盐酸23. A、B、C三种物质可以发生转化如图,A含钙元素,B、C的焰色试验均为黄色,下列说法错误的是( ) A、若A为 , 则B→C的反应可以为 B、若A为 , D是 , 则是难溶于水的盐 C、若A为 , 则B只能是碳酸钠,E为盐酸 D、若A为 , 则B→C的反应可以是24. 某固体混合物中可能含有:K+、Na+、Cl-、、等离子,将该固体溶解所得到的溶液进行如下实验:
A、若A为 , 则B→C的反应可以为 B、若A为 , D是 , 则是难溶于水的盐 C、若A为 , 则B只能是碳酸钠,E为盐酸 D、若A为 , 则B→C的反应可以是24. 某固体混合物中可能含有:K+、Na+、Cl-、、等离子,将该固体溶解所得到的溶液进行如下实验:
下列说法正确的是( )
A、该混合物一定是和NaCl B、该混合物一定是和NaCl C、该混合物可能是和 D、该混合物可能是和KCl二、多选题
-
25. 某兴趣小组的同学向一定体积的溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间的变化曲线如图所示。下列有关说法错误的是( )
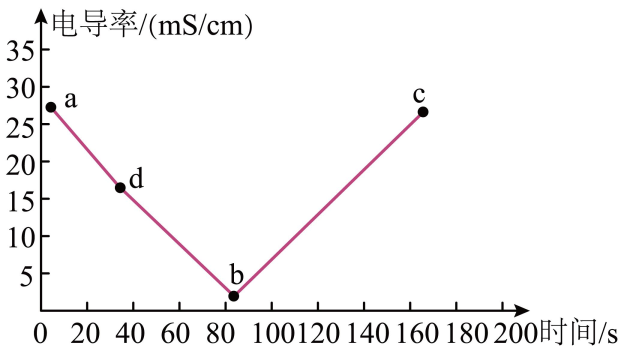 A、b处时和硫酸恰好完全中和 B、ab段导电能力不断减弱,说明不是电解质 C、b处导电能力约为0,说明此时溶液中几乎没有自由移动的离子 D、bc段导电能力逐渐增强,主要是由于过量的电离出离子导电
A、b处时和硫酸恰好完全中和 B、ab段导电能力不断减弱,说明不是电解质 C、b处导电能力约为0,说明此时溶液中几乎没有自由移动的离子 D、bc段导电能力逐渐增强,主要是由于过量的电离出离子导电三、填空题
-
26. 回答下列问题(1)、写出物质化学式
①纯碱
②熟石灰
(2)、①胆矾;②硫酸钡;③铜;④氨水;⑤CO2;⑥蔗糖;⑦CCl4;⑧Na2O,其中能导电的是;属于电解质的是(3)、从Na、Na2O、、NaOH、、H2O中选择适当的物质按照要求写化学方程式。①置换反应
②分解反应
27. 回答下列问题(1)、工业废水中含有重铬酸根离子()有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)做处理剂,有关离子反应:①该反应未配平且残缺一种常见物质,该反应中还原剂是 , 被还原的元素是
②试补充完整并配平离子反应方程式,用单线桥法标明电子转移的方向和数目:
(2)、在反应中,氧化剂与还原剂个数之比为 , 浓HCl表现出的性质是。(3)、利用如下反应制氧气:①
②
③
④
若要制得相同质量的氧气,反应中电子转移的数目之比为(按照①②③④顺序)。
28. 按要求写方程式。(1)、写离子方程式:向溶液中逐滴加入溶液至中性,反应的总离子方程式为:。(2)、和都属于酸式盐,但将二者同时加入水中可产生气泡,写出该反应的离子方程式为:。(3)、可用于实验室制O2 , 若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式。29. 现有失去标签的四瓶溶液,分别是BaCl2溶液、溶液、盐酸溶液、碳酸钠溶液。为了确定四瓶溶液,将它们编号为A、B、C、D,然后进行鉴别试验,实验记录如下:实验序号
实验内容
实验现象
①
A+B
产生白色沉淀
②
B+C
产生无色无味气体
(1)、根据上述实验能鉴别的两种溶液的化学式是BC(2)、写出离子反应方程式B+C→(3)、请设计简单实验方案,鉴别A、D30. 由A和B两种正盐组成的混合物,进行下列实验: (1)、A,B盐的化学式分别是。(2)、滤液1加硝酸钡发生的离子方程式。(3)、写出生成沉淀1 Cu (OH)2·CuCO3离子方程式。31. 某兴趣小组为测定工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究。请填空:(1)、方案一:纯碱样品经加热后测定剩余固体质量,并计算碳酸钠的质量分数。
(1)、A,B盐的化学式分别是。(2)、滤液1加硝酸钡发生的离子方程式。(3)、写出生成沉淀1 Cu (OH)2·CuCO3离子方程式。31. 某兴趣小组为测定工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究。请填空:(1)、方案一:纯碱样品经加热后测定剩余固体质量,并计算碳酸钠的质量分数。加热样品所选用的仪器是____(填标号)。
A、 B、
B、 C、
C、 D、
D、 (2)、方案二:纯碱样品可通过加热分解得到的CO2质量进行计算。某同学设计的实验装置示意图如下:
(2)、方案二:纯碱样品可通过加热分解得到的CO2质量进行计算。某同学设计的实验装置示意图如下:
装置B中冰水的作用是
(3)、该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是____A、样品分解不完全 B、装置B、C之间缺少CO2的干燥装置 C、产生CO2气体的速率太快,没有被碱石灰完全吸收 D、反应完全后停止加热,通入过量的空气(4)、方案三:将11.44g的样品与足量稀硫酸反应,通过称量反应前后盛有碱石灰的干燥管质量,利用其质量差计算碳酸钠的质量分数。实验装置如图:
该实验的操作步骤:
①关闭止水夹,在干燥管内填满碱石灰,称量干燥管A质量15.66g
②取一定量样品装入广口瓶中
③检查装置的气密性
④打开止水夹,缓慢鼓入空气数分钟,再称量干燥管A质量20.50g
⑤缓慢加入稀硫酸至不再产生气体为止
⑥打开止水夹,缓慢鼓入空气数分钟
正确的操作顺序是(填序号)
(5)、实验流程中有两次鼓入空气,它们的作用分别为、。(6)、请计算该样品中碳酸钠的质量百分数(保留1位小数)
-