山东省百校联考2023届高三上学期10月联考化学试题
试卷更新日期:2022-11-09 类型:月考试卷
一、单选题
-
1. 中华传统文化源远流长,下列说法与氧化还原反应无关的是( )A、《七步诗》:“煮豆燃豆萁,豆在釜中泣” B、《咏煤炭》:“凿开混沌得乌金……不辞辛苦出山林” C、《周礼》:“煤饼烧蛎房(注:牡蛎壳)成灰” D、《抱朴子》:“丹砂(注:HgS)烧之成水银,积变又还成丹砂”2. 氨气是一种重要的工业原料,在工业上可用氨气检验氯气管道是否漏气,其反应原理为。下列有关叙述错误的是( )A、N2的结构式:N≡N B、N原子的原子结构示意图:
 C、的电子式:
C、的电子式: D、中子数为18的氯原子:
3. 化学离不开生活,生活也离不开化学。下列叙述在科学上没有错误的是( )A、施农家肥的蔬菜,无公害,绝对不含任何化学物质 B、一种可令所有化学物质黯然失色的漂白粉 C、面包、饼干加工时加入的少量小苏打粉是作膨松剂 D、一种富含氮、磷、锌等微量元素的口服液4. 下列物质的性质与用途具有对应关系的是( )A、Na具有强还原性,可用于冶炼金属钛 B、CO2不支持燃烧,干冰可用于人工降雨 C、NaOH具有强碱性,可用作干燥剂 D、NaHCO3受热易分解,可用作泡沫灭火剂5. 化学是一门以实验为基础的学科。下图所示能达到相应实验目的的是( )
D、中子数为18的氯原子:
3. 化学离不开生活,生活也离不开化学。下列叙述在科学上没有错误的是( )A、施农家肥的蔬菜,无公害,绝对不含任何化学物质 B、一种可令所有化学物质黯然失色的漂白粉 C、面包、饼干加工时加入的少量小苏打粉是作膨松剂 D、一种富含氮、磷、锌等微量元素的口服液4. 下列物质的性质与用途具有对应关系的是( )A、Na具有强还原性,可用于冶炼金属钛 B、CO2不支持燃烧,干冰可用于人工降雨 C、NaOH具有强碱性,可用作干燥剂 D、NaHCO3受热易分解,可用作泡沫灭火剂5. 化学是一门以实验为基础的学科。下图所示能达到相应实验目的的是( )
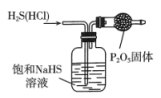


A.收集气体
B.的净化
C.的制备
D.制备胶体
A、A B、B C、C D、D6. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、的溶液: B、硫化钠溶液: C、焰色试验呈黄色的溶液: D、水电离出的的溶液:7. 下列实验操作与现象及对应的实验解释(或结论)均正确的是( )选项
实验操作与现象
实验解释(或结论)
A
向和的混合溶液中通入 , 未观察到明显现象
沉淀不能在酸性环境下生成
B
将依次通入溶液中,观察到有白色沉淀产生
将氧化为 , 白色沉淀为
C
将未打磨的铝片插入溶液中,观察到铝片表面有红色物质附着
铝单质能置换出铜单质
D
把分别盛有NaCl溶液和胶体的两烧杯置于暗处,均用红色激光笔照射烧杯中的液体,观察到胶体中有一条光亮的“通路”,NaCl溶液无明显现象
丁达尔效应是胶体和溶液的本质区别
A、A B、B C、C D、D8. 某化学小组用如图装置模拟呼吸面具中的有关反应,测定样品中的纯度。已知实验中样品的质量为8.0g,实验结束后共收集到1.12L(已折合为标准状况下)气体,下列说法错误的是( ) A、装置Ⅰ中的稀盐酸不可用稀硫酸代替 B、装置Ⅰ中a的作用是保持上下压强一致,使液体顺利滴下 C、根据题中数据,可求得样品中的纯度一定为97.5% D、实验结束后,取少量装置Ⅲ中的固体并滴入稀盐酸,若产生能使澄清石灰水变浑浊的气体,说明装置Ⅲ中有盐类生成9. 一种以黄铁矿(主要成分是 , 设杂质均不参与反应)为原料生产硫酸的简要流程图如图(图中标注的热量表示各阶段1mol含硫物质完全反应时放出的热量,忽略催化氧化的可逆性):
A、装置Ⅰ中的稀盐酸不可用稀硫酸代替 B、装置Ⅰ中a的作用是保持上下压强一致,使液体顺利滴下 C、根据题中数据,可求得样品中的纯度一定为97.5% D、实验结束后,取少量装置Ⅲ中的固体并滴入稀盐酸,若产生能使澄清石灰水变浑浊的气体,说明装置Ⅲ中有盐类生成9. 一种以黄铁矿(主要成分是 , 设杂质均不参与反应)为原料生产硫酸的简要流程图如图(图中标注的热量表示各阶段1mol含硫物质完全反应时放出的热量,忽略催化氧化的可逆性):
下列说法正确的是( )
A、黄铁矿“煅烧”时反应的化学方程式为 B、依据上述流程,当最终生成时,共转移7.5mol电子 C、生成 , 上述流程放出的总热量为634.2kJ D、上述流程中,当有完全转化为时,反应中共消耗了10. 已知:M、N、P、Q是化学中常见的物质,它们之间有如图反应关系。下列说法正确的是( ) A、若M是具有磁性的黑色金属氧化物,则P、Q不可相互转化 B、若N是石灰乳,则工业上可以上述物质转化关系为原理处理尾气中的氯气 C、若M、N分别为固体和NaOH固体,则上途物质转化关系为实验室制备氨气的原理 D、若M、N、P、Q均含同一种元素,且常温下P为黄色固体单质,则M,N均能与Q反应11. 由原子序数依次增大的四种短周期主族元素X、Y、Z、W组成的化合物Q广泛应用于锂离子电池,化合物Q的结构如图,其中Y、W为同主族的元素。下列说法正确的是( )
A、若M是具有磁性的黑色金属氧化物,则P、Q不可相互转化 B、若N是石灰乳,则工业上可以上述物质转化关系为原理处理尾气中的氯气 C、若M、N分别为固体和NaOH固体,则上途物质转化关系为实验室制备氨气的原理 D、若M、N、P、Q均含同一种元素,且常温下P为黄色固体单质,则M,N均能与Q反应11. 由原子序数依次增大的四种短周期主族元素X、Y、Z、W组成的化合物Q广泛应用于锂离子电池,化合物Q的结构如图,其中Y、W为同主族的元素。下列说法正确的是( ) A、Y在同周期元素中最难失电子 B、单核阴离子半径: C、非金属性: D、Y元素只能形成双原子分子的单质12. 漂白粉和漂粉精都是生产生活中的常见物质,工业上生产漂粉精的流程如图所示。下列有关说法正确的是( )
A、Y在同周期元素中最难失电子 B、单核阴离子半径: C、非金属性: D、Y元素只能形成双原子分子的单质12. 漂白粉和漂粉精都是生产生活中的常见物质,工业上生产漂粉精的流程如图所示。下列有关说法正确的是( ) A、漂粉精的有效成分为氯酸钙,应密封存放于避光干燥处 B、电解饱和食盐水时,两个电极均不能使用金属材料 C、反应②的化学方程式为 D、上述生产过程涉及的反应有氧化还原反应、置换反应、复分解反应
A、漂粉精的有效成分为氯酸钙,应密封存放于避光干燥处 B、电解饱和食盐水时,两个电极均不能使用金属材料 C、反应②的化学方程式为 D、上述生产过程涉及的反应有氧化还原反应、置换反应、复分解反应二、多选题
-
13. 为完成下列各组实验,所选的玻璃仪器和试剂均符合题意,完整的是(非玻璃仪器任选,不考虑存放试剂的容器)( )
选项
实验
玻璃仪器
试剂
A
食盐精制
漏斗、烧杯、玻璃棒
粗食盐水,稀盐酸,NaOH溶液、溶液,溶液
B
比较S、C、Si的非金属性强弱
蒸馏烧瓶、分液漏斗、试管、导管
稀硫酸,碳酸钠固体、硅酸钠溶液
C
喷泉实验
圆底烧瓶、胶头滴管,烧杯
NO气体、无色酚酞溶液
D
除去NaBr溶液中的少量NaI
烧杯、玻璃棒、胶头滴管、分液漏斗
溴水、
A、A B、B C、C D、D14. 在“价—类”二维图中融入“杠杆模型”,可直观辨析部分物质间的转化及其定量关系。图中的字母分别代表常见的含氯元素的物质,下列相关推断不合理的是( )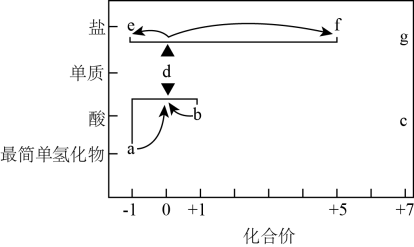 A、室温下,c的稀溶液和变价金属反应一定生成相应金属的高价盐 B、b、d、f既具有氧化性又具有还原性 C、若e为钠盐,实验室可用e和浓硫酸反应制取少量气态a D、若d在加热条件下与强碱溶液反应生成的含氯化合物只有e和f,则15. 汽车的安全气囊系统是一种被动安全性的保护系统,它与座椅安全带配合使用,可以为乘员提供有效的防撞保护,当汽车遭受一定碰撞力量以后,安全气囊中的物质会发生剧烈的反应[(未配平)],生成大量气体。设NA为阿伏加德罗常数的值,下列说法正确的是( )A、上述反应中只有离子键的断裂和形成 B、的溶液中含氧原子的数目为0.3NA C、当反应过程中转移0.125mol电子时,产生4.48L(已折合成标准状况下)气体 D、若被氧化的N原子的物质的量为3mol,则氧化产物比还原产物多1.4mol
A、室温下,c的稀溶液和变价金属反应一定生成相应金属的高价盐 B、b、d、f既具有氧化性又具有还原性 C、若e为钠盐,实验室可用e和浓硫酸反应制取少量气态a D、若d在加热条件下与强碱溶液反应生成的含氯化合物只有e和f,则15. 汽车的安全气囊系统是一种被动安全性的保护系统,它与座椅安全带配合使用,可以为乘员提供有效的防撞保护,当汽车遭受一定碰撞力量以后,安全气囊中的物质会发生剧烈的反应[(未配平)],生成大量气体。设NA为阿伏加德罗常数的值,下列说法正确的是( )A、上述反应中只有离子键的断裂和形成 B、的溶液中含氧原子的数目为0.3NA C、当反应过程中转移0.125mol电子时,产生4.48L(已折合成标准状况下)气体 D、若被氧化的N原子的物质的量为3mol,则氧化产物比还原产物多1.4mol三、填空题
-
16. 已知:为短周期主族元素中某元素的氧化物。根据下列信息,回答相关问题:(1)、若镁条在中燃烧生成黑色粉末(单质)和白色粉末,则的化学式为。(2)、若常温下,能与氢氟酸反应生成一种气体和一种液态化合物。和纯碱混合在铁坩埚中熔融生成R的含氧酸盐,和纯碱反应的化学方程式为。(3)、若向酸性溶液、含酚酞的烧碱溶液中分别通入无色气体 , 两溶液颜色均逐渐褪去。酸性溶液吸收的离子方程式为;向烧碱溶液中通入过量的离子方程式为。(4)、设NA为阿伏加德罗常数的值。若烧杯中固体W为银粉,向该烧杯中通入 , 固体W逐渐溶解(如图所示),则的化学式为 , 向某密闭容器中充入和 , 则产物的分子数(填“大于”、“小于”或“等于”)2NA。
 (5)、若是一种绿色饮用水消毒剂,则具有性而能杀菌消毒;工业上,常用+5价R的含氧酸的钠盐和HR的浓溶液在常温下反应制备气态 , 同时还有R单质和水生成,该反应的离子方程式为。17. 某溶液Q中含有如表所示离子中的5种离子,且离子浓度均为0.5mol/L(不考虑水的电离与离子水解)。现向溶液Q中加入足量稀氢溴酸,有单一气体R产生,经分析,反应前后阴离子种类不变。
(5)、若是一种绿色饮用水消毒剂,则具有性而能杀菌消毒;工业上,常用+5价R的含氧酸的钠盐和HR的浓溶液在常温下反应制备气态 , 同时还有R单质和水生成,该反应的离子方程式为。17. 某溶液Q中含有如表所示离子中的5种离子,且离子浓度均为0.5mol/L(不考虑水的电离与离子水解)。现向溶液Q中加入足量稀氢溴酸,有单一气体R产生,经分析,反应前后阴离子种类不变。阳离子
阴离子
、、、、、、、
、、、、、、、
已知在酸性溶液中会发生歧化反应。请回答下列问题:
(1)、由“加入足量稀氢溴酸,……”“反应前后阴离子种类不变”推知:溶液Q中一定不含的阴离子有(填数字)种。(2)、综合推断,溶液Q中一定含有的阳离子有(填离子符号,下同)。产生气体R的反应中,原溶液中过量的离子是 , 反应后溶液中物质的量一定发生变化的阳离子有。(3)、一定量溶液Q与氯气缓慢反应,反应后的溶液分为3份,分别进行以下操作,实验现象如图:
①铜粉参与的反应中,氧化产物是(填离子符号)。
②当V=448时,向溶液Q中通入氯气时发生反应的离子方程式为;假设不考虑与的反应,则根据实验现象可推算出V的范围为<V<。
18. 硫酸亚铁(FeSO4)是中学化学常用试剂,可用于治疗缺铁性贫血症。(1)、实验室配备FeSO4溶液时为防止硫酸亚铁变质,常采用的措施是(填一种)。(2)、以FeSO4为原料可制备碱式硫酸铁[]、铁红、硫酸亚铁铵[ , 俗名摩尔盐],转化关系如图1所示。
①制备时,若过高会导致碱式硫酸铁的产率偏低,其原因是。
②制备时,向溶液中加入过量的溶液,该反应的离子方程式为;铁红的化学式为。
③制备摩尔盐时将反应物混合,经蒸发浓缩、冷却结晶、、洗涤、干燥得到产品。
(3)、隔绝空气条件下,分解时的物质转化关系如图2:
①关于M的成分提出三种猜想:
猜想1:M是;
猜想2:M是;
猜想3:M是和。
②已知三种气体的部分性质如表所示:
物质
熔点/℃
16.8
-72.4
-210
沸点/℃
44.8
-10
-195.8
利用图3装置探究硫酸亚铁部分分解产物。能否将低温浴槽A的温度控制在?(填“能”或“否”),理由是。C中试剂可能是。
 19. 利用铝锂钴废料(主要成分为 , 还含有少量铝箔、等杂质)制备的工艺流程如图所示。
19. 利用铝锂钴废料(主要成分为 , 还含有少量铝箔、等杂质)制备的工艺流程如图所示。
已知:具有较强氧化性,均难溶于水。
回答下列问题:
(1)、“碱溶”的目的是 , 在“碱溶”前,先将铝锂钴废料粉碎的目的为。(2)、“酸溶”时发生的氧化还原反应的离子方程式为(写出一个);该过程使用盐酸也能达到目的,与使用和的混合液对比,使用盐酸的缺点是。(3)、溶液与草酸铵反应的离子方程式为;已知 , 要使溶液中的完全沉淀(即浓度小于),则溶液中浓度最小为mol/L。(4)、在有存在的高温条件下,能与反应制备 , 该反应的化学方程式为。(5)、在空气中热分解的热重曲线(剩余固体质量分数随温度变化情况)如图,则时剩余的固体为钴的氧化物,则该钴的氧化物的化学式为。 `20. 亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。某实验小组设计实验制备氯化亚砜并探究其性质。
`20. 亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。某实验小组设计实验制备氯化亚砜并探究其性质。已知:①实验室制备原理为。
②资料卡片:
物质
熔点/℃
沸点/℃
相对分子质量
其他
76.1
137.5
遇水剧烈水解,易与反应
1.25
105.8
153.5
遇水剧烈水解,能溶于
78.8
119
遇水剧烈水解,受热易分解
(1)、实验一:制备并探究SOCl2的性质,制备SOCl2的装置如图(夹持装置已略去)。
a仪器的名称为 , b装置的作用是。
(2)、可通过固体与70%浓反应制取,可通过固体与浓盐酸反应制取,则上图中制取的装置为(填字母)。(3)、将上述装置制得的SOCl2通过蒸馏方法提取出来(加热及夹持装置略),装置安装顺序为①⑨⑧(填序号)。 (4)、甲同学认为SOCl2可用作热分解制取无水的脱水剂,反应的化学方程式为;但乙同学认为该实验可能发生副反应使产品不纯,所以乙同学取少量在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2 , 加水溶解,取溶解后的溶液少许,加入(填写试剂和实验现象),说明发生了副反应。(5)、实验二:测定某SOCl2样品中SOCl2的纯度。
(4)、甲同学认为SOCl2可用作热分解制取无水的脱水剂,反应的化学方程式为;但乙同学认为该实验可能发生副反应使产品不纯,所以乙同学取少量在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2 , 加水溶解,取溶解后的溶液少许,加入(填写试剂和实验现象),说明发生了副反应。(5)、实验二:测定某SOCl2样品中SOCl2的纯度。①准确称量称量瓶和盖的总质量 , 迅速加入样品,立即盖紧,称量,质量为。
②连同称量瓶一起放入盛有溶液的密封水解瓶中,盖紧并用蒸馏水封口,轻轻摇动,待称量瓶盖打开,将水解瓶放入冰水浴,浸泡水解1h后,将水解瓶中的溶液全部转移到容量瓶中,洗涤水解瓶2~3次,洗涤液一并转入容量瓶中,静置至室温,定容,摇匀,得到溶液M。
③准确量取溶液M于碘量瓶中,加入两滴指示剂,用的盐酸中和过量的溶液至恰好完全。
④准确加入碘标准溶液,充分反应后,用淀粉溶液作指示剂,用的溶液滴定过量的碘,反应为。平行测定两次,反应消耗溶液的平均体积为。
判断滴定终点的方法为 , 样品中SOCl2的质量分数为;下列情况会导致测定的SOCl2的质量分数偏高的是(填标号)。
A.实际碘标准溶液浓度偏低
B.实际溶液浓度偏低
C.水解过程,气体吸收不充分,有部分气体逸出
D.滴定达终点时发现滴定管尖嘴内有气泡生成