湖北省百校联考2022-2023学年高三上学期10月联考化学试题
试卷更新日期:2022-11-09 类型:月考试卷
一、单选题
-
1. 下列有关说法错误的是( )A、金刚砂常作砂纸和砂轮的磨料 B、高纯度硅是制造光伏电池板的主要材料 C、生产普通玻璃和水泥的原料都是石英砂 D、我国古代烧制的精美瓷器,其主要成分是硅酸盐2. 我国科学家在铜电催化剂上锚定离子液体,提高了转化为的效率。化学反应原理是 , 下列说法正确的是( )A、的结构式为
 B、中子数为36的铜原子表示为
C、的分子式为
D、的空间填充模型为
B、中子数为36的铜原子表示为
C、的分子式为
D、的空间填充模型为 3. 粘康酸常用作抗紫外线的防护剂及航天隐形飞机的涂层材料,它的结构简式如图所示。下列说法错误的是( )
3. 粘康酸常用作抗紫外线的防护剂及航天隐形飞机的涂层材料,它的结构简式如图所示。下列说法错误的是( ) A、粘康酸的分子式为 B、粘康酸能与H2发生加成反应 C、粘康酸中只含有2种官能团 D、1mol粘康酸与足量NaHCO3溶液反应生成88g CO24. 铁粉与稀硝酸反应的化学方程式为8Fe+30HNO3=8Fe(NO3)3+3NH4NO3+9H2O。下列有关说法正确的是( )A、氧化性:HNO3<Fe3+ B、作氧化剂的HNO3是参与反应的HNO3的10% C、若铁粉过量,则氧化剂与还原剂的物质的量之比为3∶8 D、在反应后的混合物中滴加少量氢氧化钠溶液,有气体逸出5. 在我国古代,春节的民间习俗有祭灶、扫尘、吃灶糖等。下列说法错误的是( )A、“祭灶”时燃放鞭炮,会产生一种大气污染物 B、“祭灶”时烧纸钱,纸钱的主要成分是纤维素 C、“扫尘”时阳光照射空气,会产生丁达尔效应 D、“灶糖”的主要成分是蔗糖,一定条件下蔗糖能水解生成葡萄糖和果糖6. 下列各组离子在指定溶液中能大量共存的是( )A、NaI溶液中:Al3+、Fe3+、NO、Cl− B、能使酚酞变红的溶液中:K+、Na+、S2O、CO C、稀H2SO4中:Mg2+、Na+、NO、CH3COO− D、常温下由水电离的c(H+)·c(OH−)=1×10−26的溶液中:Ba2+、Na+、HCO、Cl−7. 工业上制备粗硅发生的反应之一是。在一定温度下,向某恒容密闭容器中加入足量的和炭粉,仅发生上述反应。下列说法正确的是( )A、、SiO和CO均属于酸性氧化物 B、当时,该反应达到平衡 C、平衡后再加入 , 平衡正向移动 D、当CO的质量不再改变时,该反应达到平衡8. 下列实验操作正确的是( )
A、粘康酸的分子式为 B、粘康酸能与H2发生加成反应 C、粘康酸中只含有2种官能团 D、1mol粘康酸与足量NaHCO3溶液反应生成88g CO24. 铁粉与稀硝酸反应的化学方程式为8Fe+30HNO3=8Fe(NO3)3+3NH4NO3+9H2O。下列有关说法正确的是( )A、氧化性:HNO3<Fe3+ B、作氧化剂的HNO3是参与反应的HNO3的10% C、若铁粉过量,则氧化剂与还原剂的物质的量之比为3∶8 D、在反应后的混合物中滴加少量氢氧化钠溶液,有气体逸出5. 在我国古代,春节的民间习俗有祭灶、扫尘、吃灶糖等。下列说法错误的是( )A、“祭灶”时燃放鞭炮,会产生一种大气污染物 B、“祭灶”时烧纸钱,纸钱的主要成分是纤维素 C、“扫尘”时阳光照射空气,会产生丁达尔效应 D、“灶糖”的主要成分是蔗糖,一定条件下蔗糖能水解生成葡萄糖和果糖6. 下列各组离子在指定溶液中能大量共存的是( )A、NaI溶液中:Al3+、Fe3+、NO、Cl− B、能使酚酞变红的溶液中:K+、Na+、S2O、CO C、稀H2SO4中:Mg2+、Na+、NO、CH3COO− D、常温下由水电离的c(H+)·c(OH−)=1×10−26的溶液中:Ba2+、Na+、HCO、Cl−7. 工业上制备粗硅发生的反应之一是。在一定温度下,向某恒容密闭容器中加入足量的和炭粉,仅发生上述反应。下列说法正确的是( )A、、SiO和CO均属于酸性氧化物 B、当时,该反应达到平衡 C、平衡后再加入 , 平衡正向移动 D、当CO的质量不再改变时,该反应达到平衡8. 下列实验操作正确的是( )A
B
C
D




提纯乙烷
制备氨气
制备无水
制乙酸乙酯
A、A B、B C、C D、D9. 设为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,22.4L葡萄糖中含羟基的数目为 B、10g 92%的酒精与足量钠反应转移的电子数为 C、30g由乙酸和甲醛(HCHO)组成的混合物中含原子数为 D、和恰好完全反应生成96g氧化产物,氧化剂的分子数为10. 某化学反应X+Y→Z分两步进行:①X→M;②M+Y→Z。其能量变化如图所示。下列说法正确的是( )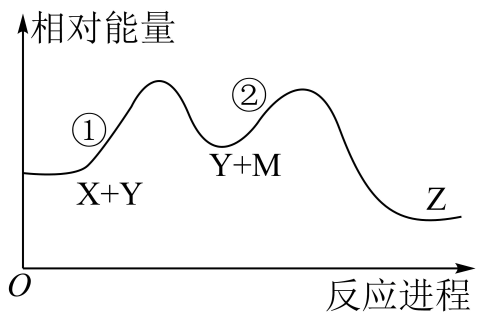 A、M是总反应的催化剂 B、总反应是理想的绿色化学反应 C、反应①②和总反应都是放热反应 D、反应物(X和Y)的总能量低于产物(Z)的总能量11. 铁和铜部分物质的价一类关系如图所示。下列说法正确的是( )
A、M是总反应的催化剂 B、总反应是理想的绿色化学反应 C、反应①②和总反应都是放热反应 D、反应物(X和Y)的总能量低于产物(Z)的总能量11. 铁和铜部分物质的价一类关系如图所示。下列说法正确的是( ) A、a和d不能发生化合反应 B、a分别与硝酸、氯气、稀硫酸反应可制得对应的d C、b、f都是黑色固体,d溶液和h溶液都是透明溶液 D、f与盐酸反应生成e和h,在该反应中f既表现氧化性,又表现还原性12. 我国科学家最近开发出锌硒电池,工作原理如图所示。放电时,电池总反应为Se+2CuSO4+2Zn=Cu2Se+2ZnSO4。下列说法错误的是( )
A、a和d不能发生化合反应 B、a分别与硝酸、氯气、稀硫酸反应可制得对应的d C、b、f都是黑色固体,d溶液和h溶液都是透明溶液 D、f与盐酸反应生成e和h,在该反应中f既表现氧化性,又表现还原性12. 我国科学家最近开发出锌硒电池,工作原理如图所示。放电时,电池总反应为Se+2CuSO4+2Zn=Cu2Se+2ZnSO4。下列说法错误的是( ) A、放电时化学能转化成电能 B、b极的电极反应式为Zn−2e−=Zn2+ C、放电时,溶液中SO向b极迁移 D、79g Se完全反应时外电路中转移2mol电子13. 下列操作、现象和结论均正确的是( )
A、放电时化学能转化成电能 B、b极的电极反应式为Zn−2e−=Zn2+ C、放电时,溶液中SO向b极迁移 D、79g Se完全反应时外电路中转移2mol电子13. 下列操作、现象和结论均正确的是( )操作
现象
结论
A
将铁片投入浓硫酸中
没有明显现象
铁不和浓硫酸反应
B
在淀粉溶液中滴加KI溶液
溶液变蓝色
淀粉遇碘变蓝色
C
在酸性溶液中滴加葡萄糖溶液
溶液逐渐褪色
葡萄糖具有还原性
D
在KSCN溶液中滴加溶液
溶液变红色
A、A B、B C、C D、D14. 硝酸镉晶体常用于瓷器上色。以镉黄废料(主要含CdS,含少量的FeO、、)为原料制备硝酸镉晶体的流程如图所示。下列说法正确的是( ) A、“酸溶”时,硝酸只作氧化剂 B、“酸溶”时温度越高,酸溶效率越高 C、“滤渣2”中含有、 D、“系列操作”时,最好采用高温烘干15. 短周期主族元素R、X、Y、Z、W的原子序数依次增大,Y和W位于同族。我国科学家合成的一种比硫酸酸性更强的超强酸M,广泛应用于有机合成,M的结构式如图所示。下列说法正确的是( )
A、“酸溶”时,硝酸只作氧化剂 B、“酸溶”时温度越高,酸溶效率越高 C、“滤渣2”中含有、 D、“系列操作”时,最好采用高温烘干15. 短周期主族元素R、X、Y、Z、W的原子序数依次增大,Y和W位于同族。我国科学家合成的一种比硫酸酸性更强的超强酸M,广泛应用于有机合成,M的结构式如图所示。下列说法正确的是( ) A、简单离子半径:W>Y>Z B、最简单氢化物稳定性:Y>Z>W C、M中含有极性键和非极性键 D、R、X、Y只能组成一种三元化合物
A、简单离子半径:W>Y>Z B、最简单氢化物稳定性:Y>Z>W C、M中含有极性键和非极性键 D、R、X、Y只能组成一种三元化合物二、综合题
-
16. 磺酰氯可用于制造锂电池的正极材料。实验室用和在活性炭催化下反应制取少量 , 该反应为放热反应,装置如图所示(部分夹持装置省略)。回答下列问题:

已知:熔点为℃,沸点为69.1℃,密度为 , 常温下较稳定,遇水剧烈反应,100℃以上易分解。
(1)、A装置中盛装硫酸的仪器名称是。(2)、A装置中硫酸在该反应中表现出来的性质有(填标号)。a.强氧化性 b.酸性 c.吸水性 d.脱水性
(3)、B装置中试剂是(填名称)。实验前烘热C装置中三颈瓶和活性炭,其目的是。(4)、D装置中冷水浴的作用是。(5)、E装置的作用是。(6)、遇水生成两种强酸,写出发生反应的化学方程式:。(7)、标准状况下,通入C装置中的和的体积分别为2.24L和3.36L,最终得到。则的产率为(保留4位有效数字)。17. 长效缓释阿司匹林(G)是日常生活中的常用药。一种合成G的路线如下:

回答下列问题:
(1)、D中官能团的名称是 , B的化学名称是。(2)、B→C的反应类型是。(3)、在D的同分异构体中,同时满足下列条件的结构有种(不考虑立体异构体)。①含有羟基和酯基 ②水解产物之一为HCOOH
(4)、A、B、C、D、E中,属于手性分子的有种。提示:与4个互不相同的原子或原子团相连的碳原子叫手性碳原子,含手性碳原子的分子叫手性分子。(5)、阿司匹林的结构简式为 , F→G的化学方程式为。(6)、以环己醇为原料合成 ,设计合成路线 (无机试剂任选)。 18. 我国科学家开发单原子电催化剂,实现了在温和条件下利用和合成。回答下列问题:(1)、工业合成氨的化学方程式为。已知:和总能量大于总能量,则工业合成氨的反应是(填“放热”或“吸热”反应。(2)、其他条件相同,在Cat1、Cat2、Cat3三种催化剂作用下,测得反应速率增大倍数与温度关系如图所示。实际生产中,宜选择的催化剂是(填“Cat1”、“Cat2”或“Cat3”),如果Cat1、Cat3是同一种催化剂,时反应速率增大倍数小于时的可能原因是。
,设计合成路线 (无机试剂任选)。 18. 我国科学家开发单原子电催化剂,实现了在温和条件下利用和合成。回答下列问题:(1)、工业合成氨的化学方程式为。已知:和总能量大于总能量,则工业合成氨的反应是(填“放热”或“吸热”反应。(2)、其他条件相同,在Cat1、Cat2、Cat3三种催化剂作用下,测得反应速率增大倍数与温度关系如图所示。实际生产中,宜选择的催化剂是(填“Cat1”、“Cat2”或“Cat3”),如果Cat1、Cat3是同一种催化剂,时反应速率增大倍数小于时的可能原因是。 (3)、一定温度下,在1L恒容密闭容器中充入和 , 测得的物质的量(n)与时间(t)关系如表所示:
(3)、一定温度下,在1L恒容密闭容器中充入和 , 测得的物质的量(n)与时间(t)关系如表所示:时间/min
0
5
10
15
20
25
物质的量/mol
0
0.30
0.50
0.65
0.70
0.70
①0~10min内,的平均反应速率。
②15min时,的正反应速率(填“大于”、“小于”或“等于”)的逆反应速率。
③在上述条件下,的平衡转化率为。
(4)、氨气碱性(KOH溶液)燃料电池能量转化率较高,电池反应为 , 电池放电时,负极的电极反应式为。19. 硫酸锰晶体常用作动物饲料的添加剂。工业上以软锰矿(含和少量的、、)为原料制备硫酸锰晶体的流程如下:
已知几种金属离子沉淀的pH如表所示:
金属氢氧化物
开始沉淀的pH
2.7
7.6
4.0
7.7
完全沉淀的pH
3.7
9.6
5.2
9.8
回答下列问题:
(1)、“酸浸”前需要将软锰矿粉碎,粉碎的目的是 , “酸浸”中和反应的离子方程式为。(2)、“滤渣1”的主要成分是(填化学式)。“系列操作”包括、降温结晶、过滤、洗涤、干燥等。(3)、“过滤”时,用到的玻璃仪器有。(4)、从绿色化学角度分析,试剂A宜选择(填标号)。a. b. c. d.
(5)、如果省略“氧化”工艺,产品中可能会混有(填化学式)。(6)、测定产品纯度:准确称取w g样品,加适量ZnO及煮沸、冷却后,转移至锥形瓶中,用 , 标准溶液滴定至溶液呈红色且半分钟不褪色,消耗标准溶液V mL。样品的纯度为(用含w、c、V的代数式表示)。已知:①。②杂质不与反应。