广东省湛江市2023届高中毕业班10月调研测试化学试题
试卷更新日期:2022-11-09 类型:月考试卷
一、单选题
-
1. 化学在生产生活中具有重要应用,下列有关说法正确的是( )
A.
B.
C.
D.




溶洞形成时,涉及的溶解
不锈钢镀铜水龙头:镀铜时,纯铜作阴极
植物光合作用中,碳元素被氧化
植物奶油的制作过程:为取代反应
A、A B、B C、C D、D2. 北京故宫的屋顶有各种颜色的琉璃瓦,其坚实耐用,经历几百年的风雨洗礼仍能保存完整,下列说法错误的是( )A、琉璃瓦的主要成分是硅酸盐 B、制作琉璃瓦的主要原料是黏土 C、琉璃瓦坚实耐用取决于硅酸盐的结构 D、黄色和绿色琉璃瓦中分别含有、3. 明矾[KAl(SO4)2•12H2O]可用于净水。下列说法正确的是( )A、半径大小:r(K+)<r(Al3+) B、电负性大小:χ(S)<χ(O) C、电离能大小:I1(O)<I1(K) D、碱性强弱:KOH<Al(OH)34. 氨气是一种重要的工业原料,在工业上可用氨气检验氯气管道是否漏气,其反应原理为。下列有关叙述错误的是( )A、N2的结构式:N≡N B、N原子的原子结构示意图: C、的电子式:
C、的电子式: D、中子数为18的氯原子:
5. 中华传统文化源远流长,下列说法与氧化还原反应无关的是( )A、《七步诗》:“煮豆燃豆萁,豆在釜中泣” B、《咏煤炭》:“凿开混沌得乌金……不辞辛苦出山林” C、《周礼》:“煤饼烧蛎房(注:牡蛎壳)成灰” D、《抱朴子》:“丹砂(注:HgS)烧之成水银,积变又还成丹砂”6. 一种实现二氧化碳固定及再利用的反应如图所示。下列叙述正确的是( )
D、中子数为18的氯原子:
5. 中华传统文化源远流长,下列说法与氧化还原反应无关的是( )A、《七步诗》:“煮豆燃豆萁,豆在釜中泣” B、《咏煤炭》:“凿开混沌得乌金……不辞辛苦出山林” C、《周礼》:“煤饼烧蛎房(注:牡蛎壳)成灰” D、《抱朴子》:“丹砂(注:HgS)烧之成水银,积变又还成丹砂”6. 一种实现二氧化碳固定及再利用的反应如图所示。下列叙述正确的是( )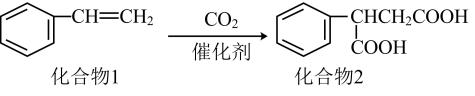 A、化合物1中碳原子的杂化类型为sp3杂化 B、化合物1与乙烯互为同系物 C、化合物2可以与乙二醇发生缩聚反应 D、化合物2中所有碳原子一定共平面7. 下列鉴别各组物质所选试剂错误的是( )
A、化合物1中碳原子的杂化类型为sp3杂化 B、化合物1与乙烯互为同系物 C、化合物2可以与乙二醇发生缩聚反应 D、化合物2中所有碳原子一定共平面7. 下列鉴别各组物质所选试剂错误的是( )选项
待鉴别物质
鉴别试剂
A
和
品红溶液
B
溶液和碘水
四氯化碳
C
乙酸乙酯和乙酸
水
D
和
湿润的KI—淀粉试纸
A、A B、B C、C D、D8. 一种有机废水发电装置示意图如图所示,装置工作时,下列说法错误的是( ) A、从a极区向b极区迁移 B、a极上的电势比b极上的高 C、该发电装置应在条件温和的环境下进行 D、 , 完全被还原为时,a极有0.5mol电子流出9. 劳动成就梦想。下列劳动项目与化学知识不相符的是( )
A、从a极区向b极区迁移 B、a极上的电势比b极上的高 C、该发电装置应在条件温和的环境下进行 D、 , 完全被还原为时,a极有0.5mol电子流出9. 劳动成就梦想。下列劳动项目与化学知识不相符的是( )选项
劳动项目
化学知识
A
饮食卫生:高温蒸煮,给碗筷消毒
高温能使蛋白质变性
B
自主探究:植物油可使酸性高锰酸钾溶液褪色
植物油中含有碳碳双键,能被酸性高锰酸钾氧化
C
家务劳动:用食醋清洗水壶内的水垢
醋酸的酸性比碳酸强
D
工厂参观:燃煤时,加入生石灰
增大煤与空气的接触面积,从而提高煤的燃烧效率
A、A B、B C、C D、D10. 自然界中硫元素的转化如图所示。下列说法错误的是( ) A、步骤a、j的转化需要加入氧化剂才能实现 B、在氧化还原反应中只能表现还原性 C、在燃煤中添加生石灰可减少的排放 D、用盐酸和溶液可以检验可溶性硫酸盐中的阴离子11. X、Y、Z、M为原子序数依次增大的前四周期元素,其有关性质或结构信息如下:
A、步骤a、j的转化需要加入氧化剂才能实现 B、在氧化还原反应中只能表现还原性 C、在燃煤中添加生石灰可减少的排放 D、用盐酸和溶液可以检验可溶性硫酸盐中的阴离子11. X、Y、Z、M为原子序数依次增大的前四周期元素,其有关性质或结构信息如下:元素
X
Y
Z
M
性质或结构信息
原子核外有三个能级,每个能级含有的电子数都相等
原子核外有两个电子层,最外层有3个未成对电子
氢化物为二元弱酸
基态原子核外价电子排布式为
下列说法错误的是A.X元素与Z元素的原子可构成直线形分子( )
A、Y元素氢化物的沸点一定比X元素氢化物的沸点高 B、Z元素的二价阴离子是正四面体结构 C、将M的低价硝酸盐溶解在足量稀硝酸中,有气体产生12. 一种以黄铁矿(主要成分是 , 设杂质均不参与反应)为原料生产硫酸的简要流程图如图(图中标注的热量表示各阶段1mol含硫物质完全反应时放出的热量,忽略催化氧化的可逆性):
下列说法正确的是( )
A、黄铁矿“煅烧”时反应的化学方程式为 B、依据上述流程,当最终生成时,共转移7.5mol电子 C、生成 , 上述流程放出的总热量为634.2kJ D、上述流程中,当有完全转化为时,反应中共消耗了13. 和少量水蒸气置于容积可变的真空密闭容器中,受热逐渐失去的三个反应式为Ⅰ.;
Ⅱ.;
Ⅲ.;
25℃和50℃下,上述三个反应中水蒸气的平衡压强数据如表所示;不同温度下上述三个反应中水蒸气的平衡压强随温度的变化情况如图所示。
反应
25℃
50℃
Ⅰ
1.04
6.05
Ⅱ
0.75
4.12
Ⅲ
0.11
0.60

下列说法错误的是( )
A、表示反应Ⅰ的是曲线a B、图中表示稳定存在的区域是区域B C、上述三个反应处于M点时,正逆反应速率的关系均为 D、25℃下,反应Ⅲ达到平衡后,再通入 , 重新平衡后,增大14. 下列由实验操作和现象得出的结论正确的是( )选项
实验操作
现象
结论
A
将过量通入Ba(OH)2溶液中
先生成白色沉淀,后沉淀
碳酸钡不溶于水,碳酸氢钡易溶于水
B
向麦芽糖溶液中加入足量NaOH溶液,再加入新制的悬浊液,加热
产生砖红色沉淀
麦芽糖已发生水解
C
加热乙醇与浓硫酸的混合液,将产生的气体通入酸性溶液中
溶液由紫色变成无色
气体中一定含有乙烯
D
将通入碘水中
碘水褪色
具有漂白性
A、A B、B C、C D、D15. 乙烯和氯气是有机化工的基础原材料,利用电解催化装置将电催化生成 , 实现减排的同时生产氯气,下列说法正确的是( ) A、玻碳电极为阴极 B、X溶液可能为NaOH溶液 C、离子交换膜一定为阳离子交换膜 D、当生成12molb时,生成2mola16. 25℃时,与pH的关系如图所示,X代表或或 , 下列说法错误的是( )
A、玻碳电极为阴极 B、X溶液可能为NaOH溶液 C、离子交换膜一定为阳离子交换膜 D、当生成12molb时,生成2mola16. 25℃时,与pH的关系如图所示,X代表或或 , 下列说法错误的是( )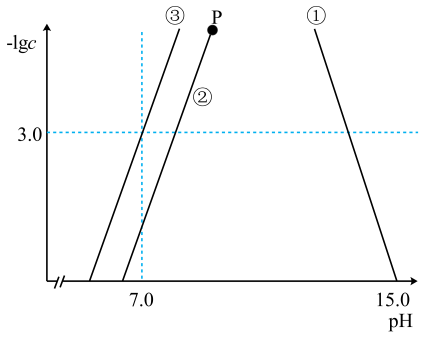
已知:常温下,的;强碱性溶液中Zn元素主要以的形式存在。
A、曲线②代表与pH的关系 B、常温下,的的数量级为 C、向等浓度的和的混合溶液中滴入NaOH溶液,先沉淀 D、向的溶液中加入等体积的HCl后,体系中Zn元素主要以、的形式存在二、综合题
-
17. 实验室利用下列装置进行氯气的制取并进行相关物质氧化性强弱的探究实验,回答下列问题:
资料:i.C中试剂为10mL40%的NaOH溶液,同时滴入了5滴的溶液;
ii.的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱;
iii.在溶液中显绿色。
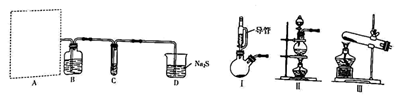 (1)、I中导管的作用是 , B中试剂为。(2)、若实验室用 , 制取 , 气体发生装置应选择(填标号,下同),若用制取 , 则气体发生装置为。由此可判断出氧化性:(填“>”、“<”或“=”)。(3)、D中的实验现象为 , 通过D中现象,得出的结论为。(4)、实验开始后,C中的实验现象如下:
(1)、I中导管的作用是 , B中试剂为。(2)、若实验室用 , 制取 , 气体发生装置应选择(填标号,下同),若用制取 , 则气体发生装置为。由此可判断出氧化性:(填“>”、“<”或“=”)。(3)、D中的实验现象为 , 通过D中现象,得出的结论为。(4)、实验开始后,C中的实验现象如下:C中实验现象
通入前
通入少量后
滴入溶液时产生白色沉淀
在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液
变为绿色,仍有沉淀
已知:棕黑色沉淀为。
①通入前,生成的白色沉淀为(填化学式)。
②通入少量后,棕黑色沉淀增多的原因是(用离子方程式表示)。
③取放置后的1mL悬浊液,加入4mL40%NaOH溶液,再通入 , 沉淀迅速消失,绿色加深。原因是(用离子方程式表示)。
三、综合题
-
18. 利用铝锂钴废料(主要成分为 , 还含有少量铝箔、等杂质)制备的工艺流程如图所示。

已知:具有较强氧化性,、均难溶于水。回答下列问题:
(1)、基态Co原子的价电子排布式为 , 在“碱溶”前,先将铝锂钴废料粉碎的目的为。(2)、“酸溶”时发生的氧化还原反应的离子方程式为(写出一个);该过程使用盐酸也能达到目的,与使用和的混合液对比,使用盐酸的缺点是。(3)、溶液与草酸铵反应的离子方程式为;已知 , 要使溶液中的完全沉淀(即浓度小于),则溶液中浓度最小为。(4)、在有存在的高温条件下,能与反应制备 , 该反应的化学方程式为。(5)、在空气中热分解的热重曲线(剩余固体质量分数随温度变化情况)如图,则300~350℃时剩余的固体为钴的氧化物,则该钴的氧化物的化学式为。 19. 我国科学家开发铜催化剂实现由N,N-二甲基甲酰胺 , 简称DMF]制备三甲胺: 。(1)、在上述反应中,每生成1g气态水,放出kJ的热量。(2)、在铜催化剂表面发生上述反应的历程如图所示(催化剂表面吸附物种用“*”表示)。
19. 我国科学家开发铜催化剂实现由N,N-二甲基甲酰胺 , 简称DMF]制备三甲胺: 。(1)、在上述反应中,每生成1g气态水,放出kJ的热量。(2)、在铜催化剂表面发生上述反应的历程如图所示(催化剂表面吸附物种用“*”表示)。
①下列分步反应中,能垒最大的是(填标号)。
a.A→B b.C→D c.F→G
②A→B中,催化剂吸附放出的总能量(填“大于”、“小于”或“等于”)断裂共价键吸收的总能量。
③D→E的化学方程式为。
(3)、向体积相等的I、II两个恒容密闭容器中分别充入1mol DMF(g)和发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
①容器I中为(填“绝热”或“恒温”)过程。判断的依据是。
②在容器II中,0~12min内分压变化速率为。
③n点时反应的平衡常数。(提示:用分压计算的平衡常数为 , 分压等于总压×物质的量分数)
20. III是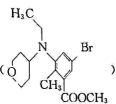 是合成药物Tazverik的中间体,其合成路线如图所示:
是合成药物Tazverik的中间体,其合成路线如图所示:
回答下列问题:
(1)、I为苯的同系物,其化学名称为 , II中官能团包括硝基和。(2)、反应①的反应类型为。(3)、反应②的化学方程式为。(4)、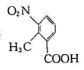 的同分异构体有很多,同时满足下列条件的同分异构体共有种(不考虑立体异构),其中苯环上仅有两种不同化学环境的氢原子的结构简式为。
的同分异构体有很多,同时满足下列条件的同分异构体共有种(不考虑立体异构),其中苯环上仅有两种不同化学环境的氢原子的结构简式为。i.属于芳香族化合物;苯环上连有两个取代基且其中一个为-NO2。
ii.能水解,且能发生银镜反应。
(5)、参照III的合成路线,设计以甲苯为原料(其他试剂任选),制备有机物 的合成路线(已知:苯环上带有甲基,再引人其他基团,主要进入它的邻位或对位;苯环上带有羧基,再引人其他基团,主要进入它的间位)。
的合成路线(已知:苯环上带有甲基,再引人其他基团,主要进入它的邻位或对位;苯环上带有羧基,再引人其他基团,主要进入它的间位)。
-