安徽省皖优联盟2023届高三上学期第一次阶段测试化学试题
试卷更新日期:2022-11-09 类型:月考试卷
一、单选题
-
1. 葛洪《抱朴子》云:扶南出金刚(金刚石),生水底石上,如钟乳状,体似紫石英,可以刻玉,人没水取之,虽铁椎击之亦不能伤。下列说法错误的是( )A、金刚石的硬度大,可以雕刻玉石 B、金刚石在空气中可以燃烧 C、金刚石是一种特殊的金属材料 D、石墨在一定条件下可以转化成金刚石2. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、的溶液:、、、 B、能溶解的溶液:、、、 C、无色透明溶液中:、、、 D、使甲基橙变红色的溶液:、、、3. 下列有关钠、铝、铁单质及其化合物的性质的说法中正确的是( )A、钠表面自然形成的氧化层能够保护内层金属不被空气氧化 B、可用氢氧化钙溶液鉴别溶液和溶液 C、、、均能通过化合反应制得 D、Al、、、均能与NaOH溶液发生反应4. 如图是配制100mL溶液过程示意图中的几步。其中正确的先后顺序是( )
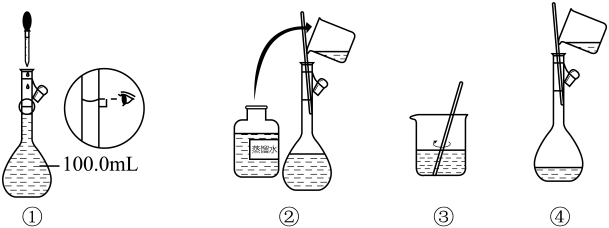 A、①②③④ B、③②④① C、③④②① D、④③②①5. 下列有关物质的性质与应用的对应关系正确的是( )A、NaClO具有氧化性,可用于杀灭新型冠状病毒 B、水解显酸性,可用作铜制线路板的蚀刻剂 C、具有漂白性,常用的水溶液作蒸气的吸收剂 D、具有氧化性,可用于与酸性溶液反应制取6. 海洋碳循环在整个地球气候系统中具有重要地位。下列叙述错误的是( )
A、①②③④ B、③②④① C、③④②① D、④③②①5. 下列有关物质的性质与应用的对应关系正确的是( )A、NaClO具有氧化性,可用于杀灭新型冠状病毒 B、水解显酸性,可用作铜制线路板的蚀刻剂 C、具有漂白性,常用的水溶液作蒸气的吸收剂 D、具有氧化性,可用于与酸性溶液反应制取6. 海洋碳循环在整个地球气候系统中具有重要地位。下列叙述错误的是( ) A、塑料颗粒中含有的碳也会进入海洋碳循环缓慢降解,不会造成污染 B、大气中浓度上升导致海洋酸化,海洋吸收的能力减弱 C、温室效应导致的海表温度上升,会减少海洋对的吸收 D、该循环涉及反应7. 氮是各种生物体生命活动中不可缺少的重要元素。自然界中的氮循环为生物体提供了氮元素。下列有关氮元素说法错误的是( )A、铵态氮肥被植物吸收的过程属于氮的固定 B、雷雨发庄稼的起因是打雷时空气中与化合成NO C、城市空气中的氮氧化物主要来源是燃油汽车产生的尾气 D、工业利用和合成 , 其中的来源是空气8. 用NA表示阿伏加德罗常数的值。下列说法正确的是( )A、的溶液中的数目为0.1NA B、标准状况下,11.2L所含氯原子数目为2NA C、2.8gN2中含共用电子对的数目为0.3NA D、0.1molFe与硝酸反应失去的电子数一定为0.3NA9. 在给定条件下,下列选项所示的物质间转换均能实现的是( )A、 B、 C、 D、10. 实验室中采用如图所示装置(夹持仪器已省略)制备气体,合理的是( )
A、塑料颗粒中含有的碳也会进入海洋碳循环缓慢降解,不会造成污染 B、大气中浓度上升导致海洋酸化,海洋吸收的能力减弱 C、温室效应导致的海表温度上升,会减少海洋对的吸收 D、该循环涉及反应7. 氮是各种生物体生命活动中不可缺少的重要元素。自然界中的氮循环为生物体提供了氮元素。下列有关氮元素说法错误的是( )A、铵态氮肥被植物吸收的过程属于氮的固定 B、雷雨发庄稼的起因是打雷时空气中与化合成NO C、城市空气中的氮氧化物主要来源是燃油汽车产生的尾气 D、工业利用和合成 , 其中的来源是空气8. 用NA表示阿伏加德罗常数的值。下列说法正确的是( )A、的溶液中的数目为0.1NA B、标准状况下,11.2L所含氯原子数目为2NA C、2.8gN2中含共用电子对的数目为0.3NA D、0.1molFe与硝酸反应失去的电子数一定为0.3NA9. 在给定条件下,下列选项所示的物质间转换均能实现的是( )A、 B、 C、 D、10. 实验室中采用如图所示装置(夹持仪器已省略)制备气体,合理的是( )
选项
化学药品
制备的气体
A
浓氨水+熟石灰
B
稀硝酸+铜片
NO
C
稀硫酸+锌粒
D
浓硫酸+亚硫酸钠
A、A B、B C、C D、D11. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
实验结论
A
向某溶液中滴加溶液,有白色沉淀生成
溶液中一定含
B
向溶液中滴加稀硫酸酸化,再滴加溶液,溶液变成血红色
溶液已变质
C
向溶液中逐滴加入少量稀盐酸,无现象
酸性:盐酸
D
在足量溶液中滴入几滴溶液有白色沉淀生成,再滴入溶液,沉淀变为黑色
A、A B、B C、C D、D12. 某溶液中含有、、、、中的几种,向溶液中滴加溶液有白色沉淀生成,过滤、洗涤,再将沉淀加入到足量稀盐酸中,沉淀部分溶解且有气泡产生,下列判断错误的是( )A、不能确定是否含有 B、一定不存在的离子有 C、是否含有需通过焰色反应确定 D、一定存在的离子有、、13. 常温下,氯化铁为棕黑色固体,易升华。实验室欲证明能在加热的条件下还原 , 设计了如下实验。
下列说法错误的是( )
A、装置A中发生的反应为置换反应 B、装置D中产生白色沉淀,可证明能还原 C、实验结束后,应先熄灭酒精灯,待硬质玻璃管冷却后再关闭K D、导管m的作用是平衡压强,可观察装置C中导管口是否堵塞14. 据统计,城市机动车辆每年以15%至20%的速度增长,汽车在剧烈碰撞时,安全气囊中发生反应:。下列判断正确的是( )A、还原剂与氧化产物的物质的量之比为3:2 B、是只含有离子键的离子化合物 C、当转移1mol电子时,可以得到35.84L D、每生成3.2mol , 则有0.4mol被还原二、综合题
-
15. 某实验小组设计如下实验装置(夹持仪器已省略)制备干燥的 , 并在碱性条件下制备(反应原理: , 溶液为绿色)。回答下列问题:
 (1)、设计次氯酸钙装入带有小孔的胶囊的目的是。(2)、B、C中盛放的试剂分别为、(填名称)。(3)、实验时,首先组装装置,然后 , 再将各装置中加入相应的试剂后,将浓盐酸从(填仪器名称)加入试管中,写出试管中反应的化学方程式:。(4)、装置E中反应已完成的现象是。(5)、装置F的作用是(用离子方程式表示)。(6)、从装置E的溶液中获取固体的方法是蒸发浓缩、、过滤、洗涤干燥。(7)、采用紫外一可见分光光度法测试高锰酸钾样品的纯度。准确称取0.70g高锰酸钾样品配制1000mL溶液,进行吸光度测试。在525nm处的吸光度A与高锰酸钾溶液浓度之间关系如下表所示。已知高锰酸钾吸光度的标准曲线方程为(式中A为吸光度,C为高锰酸钾浓度,单位为 , a、b为常数)。
(1)、设计次氯酸钙装入带有小孔的胶囊的目的是。(2)、B、C中盛放的试剂分别为、(填名称)。(3)、实验时,首先组装装置,然后 , 再将各装置中加入相应的试剂后,将浓盐酸从(填仪器名称)加入试管中,写出试管中反应的化学方程式:。(4)、装置E中反应已完成的现象是。(5)、装置F的作用是(用离子方程式表示)。(6)、从装置E的溶液中获取固体的方法是蒸发浓缩、、过滤、洗涤干燥。(7)、采用紫外一可见分光光度法测试高锰酸钾样品的纯度。准确称取0.70g高锰酸钾样品配制1000mL溶液,进行吸光度测试。在525nm处的吸光度A与高锰酸钾溶液浓度之间关系如下表所示。已知高锰酸钾吸光度的标准曲线方程为(式中A为吸光度,C为高锰酸钾浓度,单位为 , a、b为常数)。0.50
0.70
待测溶液
A(吸光度)
0.30
0.40
0.39
根据上表相关数据可计算出高锰酸钾样品的纯度为%(保留三位有效数字)。
16. 化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究与的反应机理,实验步骤如下:
i.打开、 , 通过注射器注入适量蒸馏水,使固体全部溶解;
ii.将部分液体转移至B中;
iii.向A中剩余的溶液中滴加几滴酚酞试液。
回答下列问题:
(1)、“步骤ii”B中左侧溶液褪色且有气泡产生,右侧溶液变为红色。①将部分液体转移至B中的具体操作为。
②试剂X是(填化学式)溶液,右侧与“溶液变红”有关反应的离子方程式为、。
③左侧参与反应的离子方程式为;②、③涉及的氧化还原反应中,若消耗等物质的量的还原剂,则理论上消耗氧化剂的物质的量之比为。
(2)、若向“步骤iii”A中剩余的溶液中加入时,有大量气泡产生。①在该反应中的作用为。
②“步骤iii”的现象为 , 与反应的机理是(用化学方程式表示,第一步)。
(3)、向包裹着适量的脱脂棉(放在石棉网上)上滴加3~4滴水,结果脱脂棉剧烈燃烧。由此可得出与该反应相关的结论是。三、综合题
-
17. 高纯氮化铝()是一种理想的半导体物质。一种以含铝废料(主要成分为 , 含有少量、、、)为原料制备的工艺流程如下:

回答下列问题:
(1)、“溶浸”过程中发生的基本反应类型为 , 滤渣1的主要成分是(填化学式)。(2)、写出“氧化”时生成的离子方程式:。(3)、常温下,“氧化”后溶液中 , 若“调”,是否有沉淀生成?{写出计算过程,已知常温下,}。(4)、“沉铝”时,加入试剂X的名称是。(5)、“操作”步骤包含。(6)、写出“高温灼烧”时反应的化学方程式:;该步骤反应后期需通入一定量的空气,其目的是(从提高纯度角度考虑)。18. 中学化学教材中涉及许多金属和非金属元素,掌握它们的单质及其化合物的性质是学好化学的基础。回答下列问题:(1)、的结构式为 , 过氧化钠的电子式为。(2)、黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(),该反应的化学方程式为 , 其中还原剂和氧化剂的质量比为;根据题意可判断是元酸(填“一”“二”或“三”)。(3)、向含有1mol和1mol的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。
①写出生成a的离子方程式:。
②n1=。
③向P点溶液中加入铜粉,反应的离子方程式为 , 最多可溶解铜粉g。