浙江省精诚联盟2022-2023学年高二上学期10月联考化学试题
试卷更新日期:2022-11-09 类型:月考试卷
一、单选题
-
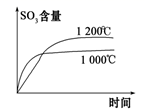
1. 中华传统文化蕴含着丰富的化学知识,下列诗句中主要涉及吸热反应的是( )A、白居易《赋得古原草送别》:“野火烧不尽,春风吹又生。” B、于谦《石灰吟》:“千锤万凿出深山,烈火焚烧若等闲。” C、于谦《咏煤炭》:“爝火燃回春浩浩,烘炉照破夜沉沉。” D、李商隐《相见时难别亦难》:“春蚕到死丝方尽,蜡炬成灰泪始干。”2. 下列做法的目的与改变化学反应速率无关的是( )A、在糕点包装内放置小包除氧剂 B、向玻璃中加入氧化铅 C、牛奶在冰箱里保存 D、未成熟的猕猴桃与成熟苹果一起密封3. 对于可逆反应 , 在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )A、 B、 C、 D、4. 已知热化学方程式2SO2(g)+O2(g)2SO3(g)ΔH=-QkJ/mol(Q>0),则下列说法正确的是( )A、降低温度,平衡正向移动,方程式中的Q值增大 B、若该反应放热QkJ,则此过程中有2molSO2(g)被氧化 C、将2molSO3(g)置于一密闭容器中充分反应,需吸收QkJ的热量 D、2molSO2、1molO2分子中的键能总和大于2molSO3分子中的键能5. 下列热化学方程式正确的是( )A、已知 , , 则a<b B、500℃、30MPa下,将0.5mol (g)和1.5mol (g)置于密闭容器中充分反应生成(g),放热19.3kJ,其热化学方程式为 C、稀盐酸和NaOH溶液反应的中和热 , 则稀和溶液反应的中和热为 D、甲烷的燃烧热 , 则甲烷燃烧的热化学方程式可表示为:6. 在常温常压下,已知:
①4Fe(s)+3O2(g)= 2Fe2O3(s) ΔH1
②4Al(s)+3O2(g)= 2Al2O3(s) ΔH2
③2Al(s)+Fe2O3(s)= Al2O3(s)+2Fe(s) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系正确的是( )
A、ΔH3=(ΔH1+ΔH2) B、ΔH3=(ΔH2-ΔH1) C、ΔH3=2(ΔH1+ΔH2) D、ΔH3=(ΔH2-ΔH1)7. 下列说法正确的是( )A、活化分子的平均能量称为活化能 B、活化分子互相碰撞即可发生化学反应 C、催化剂是通过增大反应所需的活化能来增大反应速率的 D、升高温度会加快化学反应速率,其原因是增加了活化分子的百分数8. 下列关于自发反应的说法中错误的是( )A、非自发反应在一定条件下可以实现 B、能够设计成原电池的反应是自发进行的氧化还原反应 C、电解质在水溶液中的电离是一个自发过程 D、2NO2(g)+4CO(g)=N2(g)+4CO2(g) ΔH<0,则该反应高温下利于自发进行9. 一定温度下在容积恒定的密闭容器中,进行反应A(s)+3B(g) 2C(g)+D(g),当下列物理量不发生变化时,能说明该反应已达到平衡状态的是( )①混合气体的密度;②容器内气体的压强;③混合气体总物质的量;④B物质的量浓度
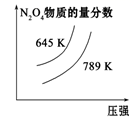
A、①④ B、只有②③ C、②③④ D、只有④10. 下列事实不能用勒夏特列原理解释的是( )A、工业上生产硫酸时,充入过量的空气以提高SO2的转化率 B、打开可乐瓶盖后看到有大量气泡逸出 C、由NO2(g)和N2O4(g)组成的平衡体系,加压后颜色加深 D、工业上用氮气、氢气合成氨气的过程中,通过加压将氨气液化以增大转化率11. 已知化合物A与H2O在一定条件下反应生成化合物B与HCOO- , 其反应历程如图所示,其中TS表示过渡态,I表示中间体。下列说法正确的是( ) A、化合物A与H2O之间的碰撞均为有效碰撞 B、该历程中的最大能垒(活化能)E正=16.87 kJ·mol-1 C、使用更高效的催化剂可降低反应所需的活化能和反应热 D、平衡状态时,升温使平衡逆向移动12. 对于可逆反应4NH3 + 5O2⇌4NO + 6H2O,下列叙述正确的是( )A、达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 B、保持容器内气体压强不变,向其中加入 , 化学反应速率不变 C、保持容器容积不变,向其中加入 , 化学反应速率增大 D、达到化学平衡时,4v正(O2)=5v逆(NO)13. 已知反应式:mX(g)+nY(?) pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的 ,c(X)=0.5mol/L,下列说法正确的是( )A、反应向逆方向移动 B、Y可能是固体或液体 C、系数n>m D、Z的体积分数减小14. 下列四图中,曲线变化情况与所给反应(a、b、c、d均大于0)相对应的是( )
A、化合物A与H2O之间的碰撞均为有效碰撞 B、该历程中的最大能垒(活化能)E正=16.87 kJ·mol-1 C、使用更高效的催化剂可降低反应所需的活化能和反应热 D、平衡状态时,升温使平衡逆向移动12. 对于可逆反应4NH3 + 5O2⇌4NO + 6H2O,下列叙述正确的是( )A、达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 B、保持容器内气体压强不变,向其中加入 , 化学反应速率不变 C、保持容器容积不变,向其中加入 , 化学反应速率增大 D、达到化学平衡时,4v正(O2)=5v逆(NO)13. 已知反应式:mX(g)+nY(?) pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的 ,c(X)=0.5mol/L,下列说法正确的是( )A、反应向逆方向移动 B、Y可能是固体或液体 C、系数n>m D、Z的体积分数减小14. 下列四图中,曲线变化情况与所给反应(a、b、c、d均大于0)相对应的是( )A
B
C
D


2SO2(g)+O2(g)⇌2SO3(g) ∆H=-akJ/mol
N2(g)+3H2(g) ⇌2NH3(g) ∆H=-bkJ/mol
N2O4(g)⇌2NO2(g) ∆H=+ckJ/mol
CO2(g)+C(s) ⇌2CO(g) ∆H=+dkJ/mol
A、A B、B C、C D、D15. 过渡态理论认为:化学反应不是通过反应物分子的简单碰撞完成的。在反应物分子生成产物分子的过程中,首先生成一种高能量的活化配合物,高能量的活化配合物再进一步转化为产物分子。按照过渡态理论,NO2(g)+CO(g)=CO2(g)+NO(g)的反应历程如图,下列有关说法中正确的是( ) A、第二步活化配合物之间的碰撞一定是有效碰撞 B、活化配合物的能量越高,第一步的反应速率越快 C、第一步反应需要吸收能量 D、该反应的反应速率主要取决于第二步反应16. 肼(H2N- NH2)是一种高能燃料,共价键的键能与热化学方程式信息如下表:
A、第二步活化配合物之间的碰撞一定是有效碰撞 B、活化配合物的能量越高,第一步的反应速率越快 C、第一步反应需要吸收能量 D、该反应的反应速率主要取决于第二步反应16. 肼(H2N- NH2)是一种高能燃料,共价键的键能与热化学方程式信息如下表:共价键
N- H
N- N
O= O
O-H
键能/( kJ·mol-1 )
391
161
498
463
热化学方程式
N2H4(g) +O2(g)=N2(g) + 2H2O(g) ΔH=- 570kJ·mol-1
则2N(g) =N2(g)的ΔH为( )
A、-941 kJ·mol-1 B、941 kJ·mol-1 C、-483 kJ·mol-1 D、483 kJ·mol-117. 在图①中A、B两个容器里,分别收集着两种作用不同的理想气体。若将中间活塞打开,两种气体分子立即都占有了两个容器(如图②)。关于此物理过程的下列说法错误的是( ) A、此过程是体系从混乱程度小向混乱程度大变化的过程,即熵增大的过程 B、此过程为自发过程,而且没有热量的吸收或放出 C、在一定条件下,不用借助外力就能自发进行的过程是自发过程 D、此过程是自发可逆的18. 某温度下,反应CO2(g)+H2(g)⇌CO(g)+H2O(g)的平衡常数K=2.25,该温度下,在体积均为10L的三个密闭容器中分别加入反应物,起始加入量如表所示,下列判断错误的是( )
A、此过程是体系从混乱程度小向混乱程度大变化的过程,即熵增大的过程 B、此过程为自发过程,而且没有热量的吸收或放出 C、在一定条件下,不用借助外力就能自发进行的过程是自发过程 D、此过程是自发可逆的18. 某温度下,反应CO2(g)+H2(g)⇌CO(g)+H2O(g)的平衡常数K=2.25,该温度下,在体积均为10L的三个密闭容器中分别加入反应物,起始加入量如表所示,下列判断错误的是( )起始量
甲
乙
丙
H2(mol)
1
2
2
CO2(mol)
1
1
2
A、反应开始时,甲中的反应速率最慢,丙中的反应速率最快 B、平衡时,甲和丙中CO2的转化率相等,均是60% C、平衡时,乙中H2的转化率大于60% D、平衡时,丙中c(H2)是0.08mol/L19. 利用现代传感技术探究压强对平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列分析中错误的是( ) A、t1时移动活塞,使容器体积增大 B、在B、E两点,对应的正反应速率: C、因C到D点,平衡逆向移动,针筒内气体颜色比点深 D、在E,F,H三点中,H点的气体平均相对分子质量最大20. 下列有关实验现象和解释或结论都正确的组合是( )
A、t1时移动活塞,使容器体积增大 B、在B、E两点,对应的正反应速率: C、因C到D点,平衡逆向移动,针筒内气体颜色比点深 D、在E,F,H三点中,H点的气体平均相对分子质量最大20. 下列有关实验现象和解释或结论都正确的组合是( )选项
实验操作
现象
解释或结论
①
分别在20℃、30℃下,取0.1 KI溶液,向其中先加入0.1的硫酸溶液,再加入淀粉溶液,发生反应
30℃下出现蓝色的时间短
探究反应速率与温度的关系
②
向和KSCN的混合溶液中,加入KCl固体
溶液颜色不变
其他条件不变时,增大的浓度,平衡不移动
③
两支试管各盛0.1mol/L 4mL酸性高锰酸钾溶液,分别加入0.1mol/L 2mL草酸溶液和0.2mol/L 2mL草酸溶液
加入0.2mol/L草酸溶液试管中,高锰酸钾溶液褪色更快
其他条件不变时,反应物浓度越大,反应速率越快
④
把充有和的平衡球装置分别放入热水和冷水装置中( △H<0)
热水中颜色更深
其他条件不变时,温度升高,平衡向吸热反应方向移动
A、①③ B、③④ C、①② D、②④21. 利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g) CH3OH(g)。在体积一定的密闭容器中按物质的量之比1:2充入CO和H2 , 测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是( ) A、该反应的△H<0,且KA<KB=KC B、反应速率:v逆(状态A)>v逆(状态B) C、在C点时,CO转化率为75% D、在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同22. 已知在一定温度下,和C在一密闭容器中进行反应 , CO的平衡浓度(mol/L)的对数与温度的倒数的关系如图所示:
A、该反应的△H<0,且KA<KB=KC B、反应速率:v逆(状态A)>v逆(状态B) C、在C点时,CO转化率为75% D、在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同22. 已知在一定温度下,和C在一密闭容器中进行反应 , CO的平衡浓度(mol/L)的对数与温度的倒数的关系如图所示:
下列说法中正确的是( )
A、该反应的 B、Q点的消耗速率大于生成速率 C、温度不变,将R点状态的容器体积缩小,重新达到平衡时,气体的压强增大 D、温度是时,反应的平衡常数为100二、填空题
-
23. 以、为原料生产尿素[]的反应历程与能量变化示意图如下:
 (1)、图中的两步反应属于放热反应的△H=。(用、、、表示,下同)(2)、根据图像写出以、为原料生产尿素[]的热化学方程式。(3)、根据上述反应历程与能量变化示意图,过程(填“第一步反应”或“第二步反应”)为决速步。
(1)、图中的两步反应属于放热反应的△H=。(用、、、表示,下同)(2)、根据图像写出以、为原料生产尿素[]的热化学方程式。(3)、根据上述反应历程与能量变化示意图,过程(填“第一步反应”或“第二步反应”)为决速步。三、综合题
-
24. 实验室用50 mL 0.5 mol/L盐酸、50 mL 0.55 mol/L NaOH溶液和如图所示装置进行中和热的测定实验,得到的数据如表所示。

实验次数
起始温度/℃
终止温度/℃
盐酸
NaOH溶液
1
20.2
20.3
23.7
2
20.3
20.5
23.8
3
21.5
21.6
24.9
(1)、从实验装置上看,图中缺少的一种玻璃仪器是。(2)、经数据处理,t1-t2=3.4,则该实验测得的△H=kJ/mol(溶液密度按1 g/cm3计算,反应后混合溶液的比热容按4.18 J/(g∙℃))计算,结果保留三位有效数字)。(3)、如果改用60 mL1.0 mol/L盐酸跟50 mL1.1 mol/LNaOH溶液进行反应,则与上述实验相比,所放热量(填“增加”“减少”或“不变”);所求中和热数值(填“增加”“减少”或“不变”)。(4)、若用0.5 mol/L盐酸与NaOH固体进行实验,则实验测得的反应热△H1(填“>”“<”或“=”)△H。25. 化学反应速率是描述化学反应进行快慢程度的物理量。下面是某化学兴趣小组测定化学反应速率并探究其影响因素的实验。(1)、Ⅰ.测定化学反应速率甲同学利用如图装置测定化学反应速率。
除如图装置所示的实验用品外,还需要的一件实验用品是。
 (2)、圆底烧瓶中所发生反应的离子方程式为。(3)、若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内的反应速率为(设圆底烧瓶内混合溶液的总体积为100mL,且反应过程中体积不变),而该测定值比实际值偏小,其原因可能是:。(4)、Ⅱ.探究一定条件下反应物浓度对硫代硫酸钠()溶液与硫酸溶液反应速率的影响。
(2)、圆底烧瓶中所发生反应的离子方程式为。(3)、若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内的反应速率为(设圆底烧瓶内混合溶液的总体积为100mL,且反应过程中体积不变),而该测定值比实际值偏小,其原因可能是:。(4)、Ⅱ.探究一定条件下反应物浓度对硫代硫酸钠()溶液与硫酸溶液反应速率的影响。乙同学利用浊度计探究一定条件下反应物浓度对硫代硫酸钠()溶液与硫酸溶液反应速率的影响。已知:浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。

用图1所示装置进行如下表所示的5个实验,分别测量混合后溶液达到相同浑浊度的过程中,浑浊度随时间的变化。实验①~⑤所得数据如图2曲线①~⑤所示。

实验装置
溶液
溶液
蒸馏水
v/mL
v/mL
v/mL
①
0.1
1.5
0.1
3.5
10
②
0.1
2.5
0.1
3.5
9
③
0.1
3.5
0.1
3.5
x
④
0.1
3.5
0.1
2.5
9
⑤
0.1
3.5
0.1
1.5
10
【分析与解释】
实验③中,x=。
(5)、实验①、②、③的目的是。(6)、通过比较Ⅰ组(①、②、③)与Ⅱ组(③、④、⑤)两组实验,可推断:反应物浓度的改变对与硫酸反应的化学反应速率的影响,溶液浓度的改变影响更大。该推断的证据是。26. 习近平主席在第75届联合国大会提出,我国要在2030年前实现碳达峰,2060年前实现碳中和的目标。因此二氧化碳的固定和转化成为科学家研究的重要课题。在适当的条件下,可发生以下两个反应:反应①:
反应②:
(1)、反应①的活化能Ea(正)Ea(逆)(填“>”“<”或“=”)。(2)、已知反应① , 在(填“较高”或“较低”)温度下有利于该反应自发进行。(3)、反应①在起始物时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(),在t=250℃时,x()随压强(p)的变化及在p=5×103Pa时x()随温度(t)的变化,如图所示。
①上图中表示在恒压条件下进行反应的曲线是(填“a”或“b”)。
②t=250℃时,改变压强达到平衡时 , 的平衡转化率α=%(保留三位有效数字)
(4)、一定温度下,在某一恒容密闭容器中充入一定量的和 , 进行反应。下列能说明该反应已达到平衡状态的是____(填序号)。A、 B、气体的平均相对分子量不再随时间变化而改变 C、 D、K不变 E、单位时间内每形成3mol H-H键,同时形成3mol O-H键(5)、在T温度下,将3.5mol 和10mol 充入2L的恒容密闭容器中发生反应①和②,达到平衡状态时(g)和(g)的物质的量分别为2mol和0.5mol。则T温度时反应①的平衡常数K为。(6)、向2L密闭容器中充入1mol 和3mol , 在一定条件下,发生反应: △H<0。的浓度随时间(0~)变化如图所示。其他条件不变,在时间将容器体积缩小至原来的一半,时重新达到平衡。请画出~时段内浓度的变化曲线。(在答题卷对应区域作图)
-