山东省济南市2022-2023学年高二上学期10月份质量检测联合调考化学试题
试卷更新日期:2022-11-09 类型:月考试卷
一、单选题
-
1. 下列反应既属于氧化还原反应,又属于放热反应的是( )A、灼热的木炭与水蒸气的反应 B、与水的反应 C、受热分解 D、与水的反应2. 如图所示装置中,不能形成原电池的是( )A、
 B、
B、 C、
C、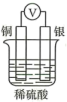 D、
D、 3. 若物质的量均为1 mol的A、B、C所具有的能量分别用Ea、Eb、Ec表示,则对于放热反应A=2B+C,下列关系错误的是( )A、2Eb+Ec>Ea B、Ea>Ec C、Ea>Eb+Ec D、Ea>2Eb4. 下列关于原电池的说法中正确的是( )A、所有的氧化还原反应都可以设计成原电池 B、原电池的负极活动性一定比正极活动性强 C、铅蓄电池放电时,负极质量减小 D、电池工作时,电解质溶液中的阳离子向正极移动5. 钢铁发生析氢腐蚀时,正极上发生的电极反应是( )A、2H++2e-=H2↑ B、Fe2++2e-=Fe C、2H2O+O2+4e-=4OH- D、Fe3++e-=Fe2+6. 下列有关中和反应反应热测定实验的说法中正确的是( )A、可用铜棒代替玻璃搅拌器,用于搅拌反应物 B、为了使反应充分进行,可以向酸(或碱)溶液中分几次加入碱(或酸)溶液 C、测定中和反应反应热实验中,读取混合溶液不再变化的温度为终止温度 D、一次实验一般需做二~三组实验,则一组完整的实验数据需要测温度三次7. 常温常压下,3.2g甲醇完全燃烧生成CO2和液态水时放热72.58kJ,甲醇燃烧热的热化学方程式为( )A、CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=+725.8kJ·mol-1 B、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-725.8kJ·mol-1 C、CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=-725.8kJ·mol-1 D、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1451.6kJ·mol-18. 我国科学家以LiI为催化剂,通过改变盐的浓度调节锂—氧气电池放电效率,模拟装置如图所示。下列说法错误的是( )
3. 若物质的量均为1 mol的A、B、C所具有的能量分别用Ea、Eb、Ec表示,则对于放热反应A=2B+C,下列关系错误的是( )A、2Eb+Ec>Ea B、Ea>Ec C、Ea>Eb+Ec D、Ea>2Eb4. 下列关于原电池的说法中正确的是( )A、所有的氧化还原反应都可以设计成原电池 B、原电池的负极活动性一定比正极活动性强 C、铅蓄电池放电时,负极质量减小 D、电池工作时,电解质溶液中的阳离子向正极移动5. 钢铁发生析氢腐蚀时,正极上发生的电极反应是( )A、2H++2e-=H2↑ B、Fe2++2e-=Fe C、2H2O+O2+4e-=4OH- D、Fe3++e-=Fe2+6. 下列有关中和反应反应热测定实验的说法中正确的是( )A、可用铜棒代替玻璃搅拌器,用于搅拌反应物 B、为了使反应充分进行,可以向酸(或碱)溶液中分几次加入碱(或酸)溶液 C、测定中和反应反应热实验中,读取混合溶液不再变化的温度为终止温度 D、一次实验一般需做二~三组实验,则一组完整的实验数据需要测温度三次7. 常温常压下,3.2g甲醇完全燃烧生成CO2和液态水时放热72.58kJ,甲醇燃烧热的热化学方程式为( )A、CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=+725.8kJ·mol-1 B、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-725.8kJ·mol-1 C、CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=-725.8kJ·mol-1 D、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1451.6kJ·mol-18. 我国科学家以LiI为催化剂,通过改变盐的浓度调节锂—氧气电池放电效率,模拟装置如图所示。下列说法错误的是( ) A、放电时,a电极为负极 B、放电时,电流由b极经用电器流向a极 C、充电时,阳极上的电极反应式为 D、充电时,a极净增14g时电路中转移1mol电子9. 已知:①H2的燃烧热(ΔH)为-285.8kJ·mol-1;
A、放电时,a电极为负极 B、放电时,电流由b极经用电器流向a极 C、充电时,阳极上的电极反应式为 D、充电时,a极净增14g时电路中转移1mol电子9. 已知:①H2的燃烧热(ΔH)为-285.8kJ·mol-1;②中和反应生成1mol水时的反应热(ΔH)为-57.3kJ·mol-1;
③水的汽化热(ΔH)为+44.0kJ·mol-1
下列热化学方程式书写正确的是( )
A、2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ·mol-1 B、H2O(l)=H+(aq)+OH-(aq) ΔH=+57.3kJ·mol-1 C、H2(g)+O2(g)=H2O(g) ΔH=-329.8kJ·mol-1 D、OH-(aq)+CH3COOH(aq)=CH3COO-(aq)+H2O(l) ΔH=+57.3kJ·mol-110. 工业上,在一定条件下用乙烯水化法制备乙醇,其热化学方程式为 。已知几种化学键的键能如表所示。化学键
H-C
C=C
H-O
C-O
C-C
键能/()
413
615
463
351
348
根据键能估算( )
A、 B、 C、 D、11. 一种液态肼(N2H4)燃料电池被广泛应用于发射通信卫星、战略导弹等的运载火箭中。该燃料电池以固体氧化物为电解质,生成物为无毒无害的物质。下列有关该电池的说法正确的是( ) A、电子沿“电极a→用电器→电极b→电解质→电极a”的路径流动 B、电极a上的电极反应式为 C、当电极a上消耗时,电极b上被氧化的O2在标准状况下的体积为22.4L D、该电池常温时不能工作12. 已知:①S(s) + O2(g) =SO2(g) △H1; ②S(g) + O2(g) = SO2(g) △H2。下列说法错误的是( )
A、电子沿“电极a→用电器→电极b→电解质→电极a”的路径流动 B、电极a上的电极反应式为 C、当电极a上消耗时,电极b上被氧化的O2在标准状况下的体积为22.4L D、该电池常温时不能工作12. 已知:①S(s) + O2(g) =SO2(g) △H1; ②S(g) + O2(g) = SO2(g) △H2。下列说法错误的是( )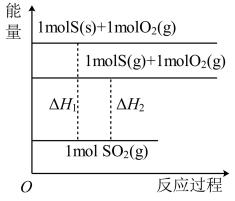 A、硫燃烧过程中将化学能大部分转化为热能 B、相同条件下,1mol S(s)比1mol S(g)更稳定 C、两个反应的反应物的总键能都比生成物的总键能小 D、两个过程的能量变化可用如图表示13. 下列装置图是电解制备金属锂的一种新方法,有关说法错误的是( )
A、硫燃烧过程中将化学能大部分转化为热能 B、相同条件下,1mol S(s)比1mol S(g)更稳定 C、两个反应的反应物的总键能都比生成物的总键能小 D、两个过程的能量变化可用如图表示13. 下列装置图是电解制备金属锂的一种新方法,有关说法错误的是( )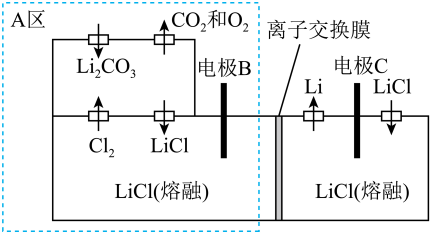 A、电极B上的电极反应式为 B、离子交换膜为阳离子交换膜 C、电极C为负极 D、理论上每生成 , 同时生成
A、电极B上的电极反应式为 B、离子交换膜为阳离子交换膜 C、电极C为负极 D、理论上每生成 , 同时生成二、多选题
-
14. 常温常压下,红磷(P)在一定量的氯气中燃烧会产生白色烟雾,现将3.1g红磷在0.2mol氯气中充分反应(反应物无剩余),测得放出xkJ的热量。向体系中再通入0.1mol氯气,充分反应后,测得又放出ykJ的热量。则下列热化学方程式正确的是( )A、 B、 C、 D、15. 二氧化碳的再利用是实现温室气体减排的重要途径之一、在稀中利用电催化可将同时转化为多种燃料,其原理如图所示。下列说法错误的是( )
 A、离子交换膜为阴离子交换膜 B、一段时间后,阴极区溶液质量会减少 C、Pt电极上的电极反应式为 D、若阴极只生成和 , 则电路中转移电子的物质的量为
A、离子交换膜为阴离子交换膜 B、一段时间后,阴极区溶液质量会减少 C、Pt电极上的电极反应式为 D、若阴极只生成和 , 则电路中转移电子的物质的量为三、填空题
-
16. 盐酸与溶液在如图所示装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热。回答下列问题:
 (1)、从实验装置上看,图中尚缺少的一种玻璃仪器是。(2)、大烧杯上若不盖硬纸板,则求得的中和反应反应热()(填“偏大”、“偏小”或“无影响”),在操作正确的前提下,提高中和反应反应热()的测定准确性的关键是。(3)、计算中和反应反应热时,至少需要的数据是(填标号)。
(1)、从实验装置上看,图中尚缺少的一种玻璃仪器是。(2)、大烧杯上若不盖硬纸板,则求得的中和反应反应热()(填“偏大”、“偏小”或“无影响”),在操作正确的前提下,提高中和反应反应热()的测定准确性的关键是。(3)、计算中和反应反应热时,至少需要的数据是(填标号)。a.盐酸的浓度b.NaOH溶液的浓度c.比热容d.反应后溶液的质量
e.生成水的物质的量f.反应前后溶液温度的变化g.操作所需的时间
(4)、实验中改用盐酸与溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”,下同),所求的生成时中和反应反应热() , 简述理由:。17. 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 , 电解质为KOH溶液。某研究小组以甲烷燃料电池(装置甲)为电源,模拟氯碱工业生产原理,装置如图所示。
请回答以下问题:
(1)、B、D的电极名称分别是、。(2)、C极可以选用的材料是____(填标号)。A、铁棒 B、银棒 C、石墨棒 D、铜棒(3)、观察到C极和D极的不同现象是。(4)、气体b应为(填“CH4”或“O2”),A极发生的电极反应为。(5)、装置甲、乙中的电解质溶液足量,当电路中通过0.2mol电子时,理论上得到的气体在标准状况下的体积为;此时气体a、b的总物质的量与气体c、d的总物质的量之比为。18. 煤和石油通常都含有硫的化合物,燃烧生成的二氧化硫为大气主要污染物之一、二氧化硫的治理已成为当前研究的课题。硫与硫的氧化物在转化过程中的能量变化如图所示。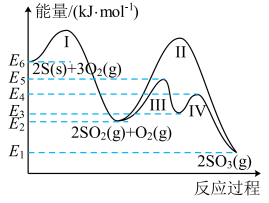
已知:。回答下列问题:
(1)、图中的I、II、III、IV中属于放热反应的是。(2)、写出表示的燃烧热的热化学方程式:。(3)、从图中可看出将SO2氧化成SO3有两条途径:①SO2经过程III、过程IV转化成SO3;②SO2经过程II转化成SO3。已知过程IV的化学方程式为 , 则过程III的热化学方程式为。
(4)、和在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为。则反应后的体系中各组分的物质的量分别为。(5)、已知: , 则相同条件下,(填“”或“”)更稳定,在中能直接生成 , 该反应的热化学方程式为。19. 两种电化学装置如图所示。
已知金属活泼性:。
回答下列问题:
(1)、从能量的角度分析,装置B将能转化为能。(2)、①装置A工作时,Zn电极为(填“正极”或“负极”),发生的电极反应为。②利用装置A进行实验,发现锌片、锰片质量均减轻,说明装置中除了发生电化学反应,还发生非电化学反应,该反应的离子方程式为。实验结束时测得电解质溶液增加32.8g,电流表中有1mol电子发生转移,则锌溶解了g。
(3)、①装置B工作时盐桥中的K+流向(填“”或“”)溶液。②若装置B中负极金属的消耗速率为 , 则盐桥中K+的迁移速率为。
四、综合题
-
20. 氨能源是目前研究的热点之一,回答下列问题:(1)、一种可以快速启动的氨制氢工艺如图1所示:

已知:
快速制氢反应:的。
(2)、氨气是一种富氢燃料,可以直接用于燃料电池,供氨水式燃料电池工作原理如图2所示: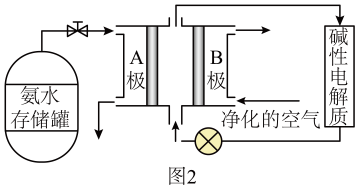
①极为氨气燃料电池的极。
②“净化的空气”是指在进入电池装置前除去(填化学式)的气体。
③氨气燃料电池的反应原理是氨气与氧气反应生成一种常见的无毒气体和水,该电池正极上的电极反应式是。
(3)、已知液氨中存在下列平衡:。用溶有金属氨基化合物(如)的液氨作电解质电解制氢的工作原理如图3所示: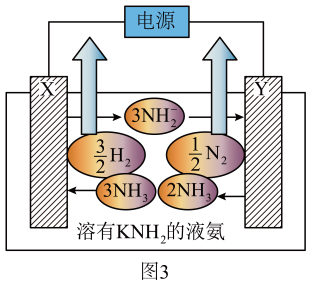
①电极的名称是。
②图3中阳极的电极反应式为。
③若图3中电解质改用 , 则阴极的电极反应式为。