辽宁省协作校2022-2023学年高二上学期第一次考试化学试题
试卷更新日期:2022-11-09 类型:月考试卷
一、单选题
-
1. 将转化为燃料甲醇是实现碳中和的途径之一,在恒温恒容密闭容器中进行反应: , 下列有关说法正确的是( )A、正反应为熵增过程, B、该反应在低温下可自发进行 C、该反应在任意温度下均可自发进行 D、干冰升华是一个熵减的过程2. 下列措施不能改变相应化学反应速率的是( )A、在铁制品表面刷油漆——铁的腐蚀速率 B、高炉炼铁增加炉高——CO的反应速率 C、食物放在冰箱中储存——食物的腐败速率 D、烧煤时用煤粉代替煤块——煤的燃烧速率3. 已知相同条件下:① ;②
;③ ,则K1、K2、K3的关系正确的是( )
A、 B、 C、 D、4. 在标有“”的滴定管内,液面的读数为46.00,如果将管内液体全部放入量筒内,那么量筒内溶液的体积( )A、等于 B、大于 C、小于 D、无法判断5. 下列颜色变化与氧化还原反应无关的是( )A、新切开的苹果在空气中变黄,最终变为褐色 B、白色的硫酸铜固体放置在空气中变为蓝色 C、淡黄绿色的新制氯水久置后变为无色 D、淡黄色的固体放置在空气中,一段时间后变成白色6. 利用下列实验装置进行的实验不能达到相应实验目的的是( ) A、①测量中和反应的反应热 B、②测量锌与稀硫酸反应的反应速率 C、③探究温度对平衡的影响 D、④探究压强对平衡的影响7. 相同温度下,根据三种酸的电离常数,下列判断正确的是( )
A、①测量中和反应的反应热 B、②测量锌与稀硫酸反应的反应速率 C、③探究温度对平衡的影响 D、④探究压强对平衡的影响7. 相同温度下,根据三种酸的电离常数,下列判断正确的是( )酸
电离常数K
A、三种酸的强弱关系: B、反应能够发生 C、由电离常数可以判断,属于强酸,和属于弱酸 D、相同温度下,溶液的电离常数大于溶液的电离常数8. 一定温度下,在体积分别为V1、V2(V1>V2)的两个恒容密闭容器中充入等物质的量的 , 发生反应 , 下列图示中,能符合题意表示Z的体积分数(φ)与反应时间(t)的关系的是(、分别表示体积为V1、V2的密闭容器的压强)( )A、 B、
B、 C、
C、 D、
D、 9. 化学反应的调控对于工业生产具有积极意义,下列关于调控措施的说法错误的是( )A、硫酸工业中,在高温高压、催化剂作用下,可提高生产效益 B、硫酸工业中,为提高的转化率,可通入稍过量的空气 C、工业合成氨,考虑催化剂的活性,选择的反应温度 D、工业合成氨,迅速冷却、液化氨气是为了使化学平衡向生成氨气的方向移动10. 研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如图所示。下列说法错误的是( )
9. 化学反应的调控对于工业生产具有积极意义,下列关于调控措施的说法错误的是( )A、硫酸工业中,在高温高压、催化剂作用下,可提高生产效益 B、硫酸工业中,为提高的转化率,可通入稍过量的空气 C、工业合成氨,考虑催化剂的活性,选择的反应温度 D、工业合成氨,迅速冷却、液化氨气是为了使化学平衡向生成氨气的方向移动10. 研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如图所示。下列说法错误的是( ) A、过程Ⅰ有H-O键断裂并吸收能量 B、过程Ⅱ有O-O键生成并放出能量 C、整个过程中既有非极性键的断裂,又有非极性键的形成 D、2mol的总能量大于2mol和1mol的总能量11. 在两个恒温恒容密闭容器中平衡体系和的反应物平衡转化率分别为和 , 反应物的平衡浓度分别为和 , 在温度不变的情况下,均增加反应物的物质的量,下列叙述正确的是( )A、、均增大,、均增大 B、不变、增大,、均增大 C、不变、增大,不变、增大 D、减小,增大,增大,增大12. 下列实验操作与现象和结论对应正确的是( )
A、过程Ⅰ有H-O键断裂并吸收能量 B、过程Ⅱ有O-O键生成并放出能量 C、整个过程中既有非极性键的断裂,又有非极性键的形成 D、2mol的总能量大于2mol和1mol的总能量11. 在两个恒温恒容密闭容器中平衡体系和的反应物平衡转化率分别为和 , 反应物的平衡浓度分别为和 , 在温度不变的情况下,均增加反应物的物质的量,下列叙述正确的是( )A、、均增大,、均增大 B、不变、增大,、均增大 C、不变、增大,不变、增大 D、减小,增大,增大,增大12. 下列实验操作与现象和结论对应正确的是( )实验操作与现象
结论
A
加热盛有少量固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝
显碱性
B
向某溶液中先加入氯化钡溶液,再滴入盐酸,先产生白色沉淀,后白色沉淀不消失
该溶液中可能含有
C
将晶体溶于稀硫酸,再滴加KSCN溶液,溶液变红
晶体已氧化变质
D
向2支盛有2mL不同浓度溶液的试管中同时加入溶液,未观察到明显的实验现象差异
浓度对反应速率的影响不大
A、A B、B C、C D、D13. 室温时,将的稀溶液与的稀硫酸充分反应。下列关于反应后溶液的判断错误的是( )A、若 , 且 , 则 B、若 , 且 , 则 C、若 , 且 , 则 D、若 , 且 , 则14. 一定温度下,向四个体积不等的恒容密闭容器中分别通入2mol , 发生反应。t min后,四个容器中NOCl的转化率如图所示。下列叙述错误的是( ) A、 B、C点对应容器中,反应达到了平衡状态 C、当四个容器中反应都达到平衡状态时,体积为d L的容器中NOCl的转化率最高 D、体积为b L的容器中反应达到平衡后,再通入1mol NOCl和1mol NO,平衡不发生移动15. 常温下,pH均为2、体积均为的三种酸溶液,分别加水稀释至体积为V,溶液pH随的变化关系如图所示,下列叙述错误的是( )
A、 B、C点对应容器中,反应达到了平衡状态 C、当四个容器中反应都达到平衡状态时,体积为d L的容器中NOCl的转化率最高 D、体积为b L的容器中反应达到平衡后,再通入1mol NOCl和1mol NO,平衡不发生移动15. 常温下,pH均为2、体积均为的三种酸溶液,分别加水稀释至体积为V,溶液pH随的变化关系如图所示,下列叙述错误的是( ) A、常温下, B、原溶液中酸的物质的量浓度: C、b点和c点对应的溶液中水的电离程度相同 D、当时,三种溶液同时升高温度,减小
A、常温下, B、原溶液中酸的物质的量浓度: C、b点和c点对应的溶液中水的电离程度相同 D、当时,三种溶液同时升高温度,减小二、综合题
-
16. 煤和石油通常都含有硫的化合物,燃烧生成的二氧化硫为大气主要污染物之一、二氧化硫的治理已成为当前研究的课题。硫与硫的氧化物在转化过程中的能量变化如图所示。

已知:。
回答下列问题:
(1)、图中的I、II、III、IV中属于放热反应的是。(2)、写出表示的燃烧热的热化学方程式:。(3)、从图中可看出将氧化成有两条途径:①经过程III、过程IV转化成;②经过程II转化成。这两种途径相比,①改变的条件是 , 改变该条件主要是降低了。已知过程IV的化学方程式为 , 则过程III的热化学方程式为。(4)、9.6gS和16g在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为109.8kJ。则反应后的体系中各组分的物质的量分别为(保留两位有效数字)。(5)、工业上常用NaOH溶液吸收 , 若将0.4mol通入500mLNaOH溶液中充分反应,测得反应放出x kJ热量。已知该条件下,1mol通入足量的NaOH溶液中充分反应放出y kJ热量。则和NaOH溶液反应生成的热化学反应方程式为。17. 汽车的发展给我们带来便利的同时也导致了一些环境问题。请根据所学知识回答下列问题:(1)、已知:燃料的燃烧热分别为(a、b、c均大于零),则的。(2)、燃料燃烧时常存在燃烧不充分、尾气残留等问题,所以汽车排气管会加装三元催化器,催化反应进行,催化剂能加快反应速率的原因是。(3)、为探究汽车尾气的转化,向一体积为的恒容密闭容器中充入和 , 发生反应 , 温度分别为和时,的转化率随时间的变化关系如图所示。则该反应的(填“>”、“<”或“=”,下同)0;若时该反应的平衡常数分别为 , 则。 (4)、若在、体积为的恒容密闭容器中,充入和 , 初始压强为下进行反应 , 反应过程中,总压强随时间的变化关系如图所示。
(4)、若在、体积为的恒容密闭容器中,充入和 , 初始压强为下进行反应 , 反应过程中,总压强随时间的变化关系如图所示。
①M点时,的转化率为 , 。
②下该反应的平衡常数。
③平衡后保持其他条件不变,若再充入、 , 则平衡向(填“正”或“逆”)反应方向移动。
18. 按要求回答下列问题:(1)、一定温度下,现有a.稀盐酸、b.稀硫酸、c.稀醋酸三种酸。①相同体积、等pH的三种酸,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是(用a、b、c表示)。
②体积相同、物质的量浓度也相同的三种酸,向其中分别放入足量的锌(大小、形状相同),产生相同体积的(相同状况),则开始时反应速率由大到小的顺序为(用a、b、c表示)。
(2)、现用中和滴定法测定某盐酸的浓度,有关数据记录如表:滴定序号
待测液体积/ mL
NaOH标准液
滴定前的刻度/mL
滴定后的刻度/ mL
体积/ mL
1
25.00
2
25.00
1.50
31.50
30.00
3
25.00
5.00
31.34
26.34
①用碱式滴定管盛装的氢氧化钠标准液。排出碱式滴定管中气泡的方法应采用如图1所示操作中的(填“甲”、“乙”或“丙”),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

图1
②第一次滴定前后,滴定管中液面的位置如图2,该次滴定所用氢氧化钠标准液的体积为。

③实验中采用酚酞作为指示剂,判断滴定终点的现象:最后半滴加入时,锥形瓶中溶液从色变为色,且半分钟内不变色。
④根据所给数据,该盐酸的物质的量浓度为mol/L。
⑤出现了以下操作(其他操作正确),其中会造成测定结果(待测液浓度)偏高的有(填标号)。
A.量取标准液的碱式滴定管未润洗
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸润洗
D.滴定到达终点时,俯视滴定管读数
E.滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失
19. 碘及其化合物广泛用于医药、染料等方面。碘酸是一种强酸,其水溶液有强氧化性。已知氧化性:。回答下列问题:(1)、一种以含有少量的废液为原料制备的方法如图所示。
①“转化”生成的Ag溶于稀硝酸可获得硝酸银,写出Ag与稀硝酸反应的离子方程式:。
②通入的过程中,若 , 则反应中被氧化的元素为(填元素符号);当后,单质碘的产率会降低,原因是。
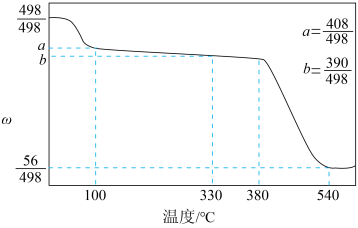
(2)、大量的碘由自然界的与还原剂反应制得,则该制备的反应中的氧化剂和还原剂的物质的量之比为。(3)、卤素互化物可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:。(4)、碘酸钙是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水。加热升温过程中剩余固体的质量分数w()随温度变化的关系如图所示。为获得无水碘酸钙,可将晶体(填实验操作)。若将加热温度提高至540℃,则此时得到固体的主要成分为(填化学式)。