辽宁省名校联盟2022-2023学年高二上学期10月联考化学试题
试卷更新日期:2022-11-09 类型:月考试卷
一、单选题
-
1. 劳动成就梦想。下列劳动项目与所述的化学知识没有关联的是( )
选项
劳动项目
化学知识
A
厨房帮厨:炒菜时,时常会添加料酒
将乙醇氧化为可调味的乙酸
B
工厂消毒:向各个办公场所喷酒“84”消毒液
NaClO具有强氧化性,能使蛋白质变性杀灭病毒
C
社区服务人员给铁护栏粉刷油漆
金属铁隔绝空气不易腐蚀
D
自主探究:锌、钢和柠檬为原料制作水果电池
锌能与柠檬中酸性物质发生氧化还原反应
A、A B、B C、C D、D2. 反应3H2(g)+N2(g)2NH3(g) ΔH<0,达到平衡后,将体系的温度降低,下列叙述中正确的是( )A、正反应速率增大,逆反应速率减小,平衡向正反应方向移动 B、正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 C、正反应速率和逆反应速率都减小,平衡向逆反应方向移动 D、正反应速率和逆反应速率都减小,平衡向正反应方向移动3. 已知:①②
③
④
下列说法正确的是( )
A、的燃烧热为 B、 C、相同质量的和完全燃烧,放出的热量多 D、 , 理论上可利用该反应设计成原电池4. 某温度下,反应在密闭容器中达到平衡,下列说法错误的是( )A、增大压强, , 平衡常数不变 B、加入催化剂,平衡时的浓度增大 C、恒容下,充入一定量的 , 平衡向正反应方向移动 D、恒容下,充入一定量的 , 的平衡转化率减小5. 下列图示与对应的叙述不相符的是( ) A、(a)图可表示锌和稀硫酸反应过程中的能量变化 B、通过(b)图可知石墨比金刚石稳定 C、由(c)图可知, D、(d)图是某反应A→C的能量变化曲线图(E表示能量),反应中6. 我国学者结合实验与计算机模拟结果,研究了均相NO—CO的反应历程,该反应经历了I、II、III三个过渡态。下图中显示的是反应路径中每一个阶段内各驻点的能量相对于此阶段内反应物能量的能量之差,则下列说法中错误的是( )
A、(a)图可表示锌和稀硫酸反应过程中的能量变化 B、通过(b)图可知石墨比金刚石稳定 C、由(c)图可知, D、(d)图是某反应A→C的能量变化曲线图(E表示能量),反应中6. 我国学者结合实验与计算机模拟结果,研究了均相NO—CO的反应历程,该反应经历了I、II、III三个过渡态。下图中显示的是反应路径中每一个阶段内各驻点的能量相对于此阶段内反应物能量的能量之差,则下列说法中错误的是( )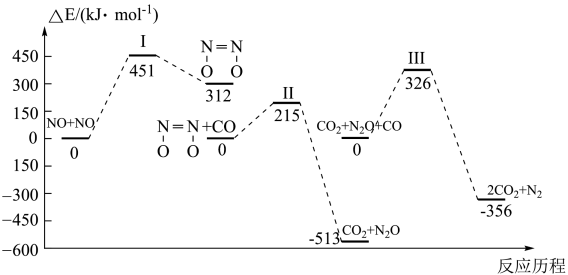 A、比
A、比 更容易与CO发生反应
B、
C、整个反应分为三个基元反应阶段,其中第一个反应阶段活化能最大
D、其他条件不变,增大压强可以增大反应速率同时提高反应物的转化率
7. 下列实验能达到实验目的且操作正确的是( )
更容易与CO发生反应
B、
C、整个反应分为三个基元反应阶段,其中第一个反应阶段活化能最大
D、其他条件不变,增大压强可以增大反应速率同时提高反应物的转化率
7. 下列实验能达到实验目的且操作正确的是( )A
B
C
D
用蒸发结晶的方法从氯化铵溶液中得到氯化铵晶体
用氢氧化钠溶液除去乙酸乙酯中的乙酸
测定锌与稀硫酸的反应速率(计量器未画出)
比较、、S的氧化性强弱



 A、A B、B C、C D、D8. 一定温度下,在容积为2L的恒容密闭容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。下列说法错误的是( )
A、A B、B C、C D、D8. 一定温度下,在容积为2L的恒容密闭容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。下列说法错误的是( ) A、该反应的化学方程式为 B、 , C、时,正、逆反应速率相等,反应达到平衡状态 D、时,容器容积不变,充入惰性气体Ar,平衡正向移动9. 高铁电池是一种新型高能高容量电池,某高铁电池的工作原理如图所示。下列说法错误的的是( )
A、该反应的化学方程式为 B、 , C、时,正、逆反应速率相等,反应达到平衡状态 D、时,容器容积不变,充入惰性气体Ar,平衡正向移动9. 高铁电池是一种新型高能高容量电池,某高铁电池的工作原理如图所示。下列说法错误的的是( )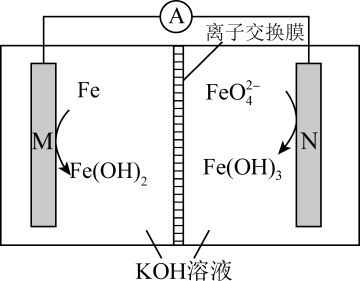 A、M极电势低于N极电势 B、电池工作时,电流方向:N→A→M→N C、N极的电极反应式为 D、电池工作一段时间后,正极区中的物质的量减小10. 铅酸电池是一种可充电电池,其放电时的总反应为:。如图所示,利用铅酸电池电解溶液(a、b均为石墨电极),可以制得、、较浓的和NaOH溶液。下列说法正确的是( )
A、M极电势低于N极电势 B、电池工作时,电流方向:N→A→M→N C、N极的电极反应式为 D、电池工作一段时间后,正极区中的物质的量减小10. 铅酸电池是一种可充电电池,其放电时的总反应为:。如图所示,利用铅酸电池电解溶液(a、b均为石墨电极),可以制得、、较浓的和NaOH溶液。下列说法正确的是( )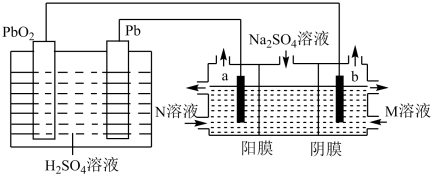 A、铅酸电池放电一段时间后,正、负极的质量均增加 B、N和M溶液分别为稀和稀NaOH溶液 C、a电极的电极反应式为 D、当电路中有1mol电子通过时,b电极收集到的体积为11. 下列关于各装置图的叙述错误的是( )
A、铅酸电池放电一段时间后,正、负极的质量均增加 B、N和M溶液分别为稀和稀NaOH溶液 C、a电极的电极反应式为 D、当电路中有1mol电子通过时,b电极收集到的体积为11. 下列关于各装置图的叙述错误的是( ) A、图I装置为原电池装置,可以实现化学能到电能的转化 B、图II装置中钢闸门应与外接电源的负极相连,称之为“外加电流阴极保护法” C、图III装置可制备并能较长时间保持其颜色 D、图IV装置可用于观察铁的吸氧腐蚀12. 甲烷催化二氧化碳重整制合成气,可减少碳排放,变废为宝,其主要反应为: , 在刚性容器中,采用“HSD-2型”催化剂,一定的温度及压强范围内,测得反应的速率方程为[表示气体分压,分压=总压×物质的量分数],下列推理错误的是( )A、使用催化剂,反应速率加快,不变 B、升高温度能提高合成气的产率 C、增大 , 反应速率和平衡常数均增大 D、增大 , 反应速率和平衡常数均不变13. 在的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应: , 已知该反应平衡常数与温度的关系如表:
A、图I装置为原电池装置,可以实现化学能到电能的转化 B、图II装置中钢闸门应与外接电源的负极相连,称之为“外加电流阴极保护法” C、图III装置可制备并能较长时间保持其颜色 D、图IV装置可用于观察铁的吸氧腐蚀12. 甲烷催化二氧化碳重整制合成气,可减少碳排放,变废为宝,其主要反应为: , 在刚性容器中,采用“HSD-2型”催化剂,一定的温度及压强范围内,测得反应的速率方程为[表示气体分压,分压=总压×物质的量分数],下列推理错误的是( )A、使用催化剂,反应速率加快,不变 B、升高温度能提高合成气的产率 C、增大 , 反应速率和平衡常数均增大 D、增大 , 反应速率和平衡常数均不变13. 在的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应: , 已知该反应平衡常数与温度的关系如表:温度/℃
25
80
230
平衡常数
2
下列说法错误的是( )
A、升温不利于生成 B、在25℃时,反应的平衡常数为 C、在80℃时,测得某时刻,、CO的浓度均为 , 则此时 D、在80℃达到平衡时,测得 , 则的平衡浓度为14. 温度为T℃,向容积不等的密闭容器中分别加入足量活性炭和 , 发生反应:。反应相同时间,测得各容器中的转化率与容器容积的关系如图所示。下列说法错误的是( ) A、对c点容器加压,缩小容器容积,则此时 B、T℃时,a、b两点时反应的平衡常数 C、向a点体系中充入一定量 , 达到新平衡时,转化率将减小 D、图中a点所示条件下15. 根据酸碱质子理论,给出质子的物质是酸,结合质子的是碱,给出质子的能力越强,酸性越强。已知: , , 下列酸性强弱顺序正确的是( )A、 B、 C、 D、
A、对c点容器加压,缩小容器容积,则此时 B、T℃时,a、b两点时反应的平衡常数 C、向a点体系中充入一定量 , 达到新平衡时,转化率将减小 D、图中a点所示条件下15. 根据酸碱质子理论,给出质子的物质是酸,结合质子的是碱,给出质子的能力越强,酸性越强。已知: , , 下列酸性强弱顺序正确的是( )A、 B、 C、 D、二、综合题
-
16.(1)、I.已知合成氨反应 。在其他条件不变的情况下,探究改变起始时氢气的物质的量对合成反应的影响,实验结果如图所示:(图中T表示温度,n表示起始时物质的量)
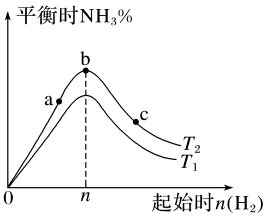
图像中和的关系是:(填“>”“<”“=”或“无法确定”)。
(2)、在a、b、c三点所处的平衡状态中,反应物转化率最大的是(填字母)。(3)、若容器容积为 , b点对应的 , 测得平衡时的转化率为60%,则平衡时的物质的量浓度为。(4)、II.已知:25℃时,亚硫酸的电离平衡常数为 , ;次氨酸的电离平衡常数为;碳酸的电离平衡常数为 , 。回答下列问题:的电离方程式为。
(5)、足量的溶液和溶液发生反应的主要离子方程式为;足量的溶液中加入溶液发生反应的离子方程式为。(6)、向的溶液中滴加等体积的一定浓度的稀硫酸,此时测得溶液中的 , 则溶液中。17. 2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:(1)、在一定温度下,向容积固定的密闭容器中加入足量的和 , 起始压强为时,发生下列反应生成水煤气:I.
II.
①列说法正确的是。
A.平衡时向容器中充入情性气体,反应I的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时,的转化率为70%,的物质的量为。此时,整个体系(填“吸收”或“放出”)热量kJ,反应I的平衡常数(以分压表示,分压=总压×物质的量分数,保留两位有效数字)。
(2)、一种脱除和利用水煤气中方法的示意图如下。
①某温度下,吸收塔中溶液吸收一定量的后, , 则该溶液的(该温度下的 , )。
②吸收塔中被吸收的离子方程式为。
③利用电化学原理,将电催化还原为 , 同时阳极得到氧气,阳极反应式为。
18. 二草酸合铜(II)酸钾可用于无机合成、功能材料制备。实验室制备二草酸合铜(II)酸钾可采用如下步骤:I.取已知浓度的溶液,搅拌下滴加足量溶液,产生浅蓝色沉淀,加热,沉淀转变成黑色,过滤。
II.向草酸溶液中加入适量固体,制得和混合溶液。
III.将II的混合溶液加热至80~85℃,加入I中的黑色沉淀。全部溶解后,趁热过滤。
IV.将III的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(II)酸钾晶体,进行表征和分析。
回答下列问题:
(1)、由配制I中的溶液,下列仪器中不需要的是(填仪器名称)。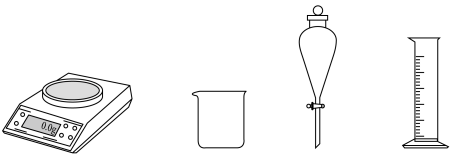 (2)、长期存放的中,会出现少量白色固体,原因是。(3)、I中的黑色沉淀是(写化学式)。(4)、II中原料配比为 , 写出反应的化学方程式。(5)、II中,为防止反应过于刚烈而引起喷溅,加入应采取的方法。(6)、III中应采用进行加热。(7)、IV中“一系列操作”包括。19. 以焙烧黄铁矿(杂质为石英等)产生的红渣为原料制备铵铁蓝颜料。工艺流程如下:
(2)、长期存放的中,会出现少量白色固体,原因是。(3)、I中的黑色沉淀是(写化学式)。(4)、II中原料配比为 , 写出反应的化学方程式。(5)、II中,为防止反应过于刚烈而引起喷溅,加入应采取的方法。(6)、III中应采用进行加热。(7)、IV中“一系列操作”包括。19. 以焙烧黄铁矿(杂质为石英等)产生的红渣为原料制备铵铁蓝颜料。工艺流程如下:
回答下列问题:
(1)、红渣的主要成分为(填化学式),滤渣①的主要成分为(填化学式)。(2)、黄铁矿研细的目的是。(3)、还原工序中,S元素被氧化为硫酸根的化学方程式为。(4)、沉铁工序中加入的溶液可用于的检验,现象为。(5)、若用还原工序得到的滤液制备和 , 所加试剂为和(填化学式,不引入杂质)。