湖南省宁乡市四校联考2022-2023学年高二上学期10月月考化学试题
试卷更新日期:2022-11-09 类型:月考试卷
一、单选题
-
1. 下列热化学方程式正确的是( )A、已知在、下,燃烧生成水蒸气放出热量,其热化学方程式为 B、、下,将和置于密闭容器中充分反应生成 , 放热 , 其热化学方程式为 C、甲烷的燃烧热为 , 则甲烷燃烧热的热化学方程式可表示为 D、、时,强酸与强碱的稀溶液发生中和反应的中和热为 , 则硫酸溶液与氢氧化钾溶液反应的热化学方程式为:2. 下列事实中,不能用勒夏特列原理解释的是( )A、在溴水中存在如下平衡:Br2+H2OHBr+HBrO,当加入NaOH溶液后颜色变浅 B、对2H2O22H2O+O2的反应,使用MnO2可加快制O2的反应速率 C、反应CO+NO2CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动 D、合成氨反应:N2+3H22NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施3. 化学家格哈德•埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如图:

已知:N2(g)+3H2(g)2NH3(g) ΔH=—92kJ/mol。下列关于合成氨反应的叙述中错误的是( )
A、该过程表明,在化学反应中存在化学键的断裂与形成 B、③→④过程,N原子和H原子形成了含有非极性键的NH3 C、过程②需吸收能量,过程③则放出能量 D、合成氨反应中,反应物断键吸收能量小于生成物形成新键释放的能量4. 下列有关说法中正确的是( )A、在低温下能自发进行,则该反应的 B、室温下不能自发进行,说明该反应的 C、若 , 化学反应在任何温度下都不能自发进行 D、加入合适的催化剂能降低反应活化能,从而改变反应的焓变5. 下列反应前后物质的总能能量变化能用如图表示的是( ) A、Ba(OH)2•8H2O与NH4Cl的反应 B、生石灰和水的反应 C、木炭在氧气中燃烧 D、盐酸与氢氧化钠溶液的反应6. 氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。
A、Ba(OH)2•8H2O与NH4Cl的反应 B、生石灰和水的反应 C、木炭在氧气中燃烧 D、盐酸与氢氧化钠溶液的反应6. 氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。

下列分析合理的是( )
A、如图中c曲线是加入催化剂a时的能量变化曲线 B、反应①的热化学方程式为:N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ/mol C、在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L D、催化剂a、b能提高化学反应①、②的化学反应速率和平衡转化率7. NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图1;研究发现在催化剂上可能发生的反应过程如图2。下列说法错误的是( )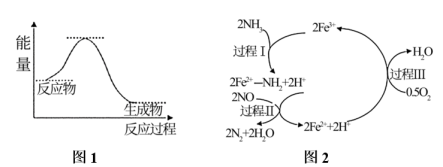 A、NH3催化还原NO为放热反应 B、过程I中NH3断裂极性键,需要吸收能量,Fe3+体现了氧化性 C、过程III的离子方程式: D、反应过程中,反应物为NH3、O2、NO,Fe3+、Fe2+为中间产物8. 已知X(g)+3Y (g) 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是( )A、充分反应后,放出热量为a kJ B、当反应达到平衡状态时,X与W的物质的量浓度之比一定为1:2 C、当X的物质的量分数不再改变,表明该反应已达平衡 D、若增大Y的浓度,正反应速率增大,逆反应速率减小9. 已知:H2(g)+Br2(g)=2HBr(g) △H=-72kJ/mol,其它相关数据如表:
A、NH3催化还原NO为放热反应 B、过程I中NH3断裂极性键,需要吸收能量,Fe3+体现了氧化性 C、过程III的离子方程式: D、反应过程中,反应物为NH3、O2、NO,Fe3+、Fe2+为中间产物8. 已知X(g)+3Y (g) 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是( )A、充分反应后,放出热量为a kJ B、当反应达到平衡状态时,X与W的物质的量浓度之比一定为1:2 C、当X的物质的量分数不再改变,表明该反应已达平衡 D、若增大Y的浓度,正反应速率增大,逆反应速率减小9. 已知:H2(g)+Br2(g)=2HBr(g) △H=-72kJ/mol,其它相关数据如表:H2(g)
Br2(g)
HBr(g)
1mol分子中的化学键断裂时需要吸收的能量/kJ
436
a
369
则表中a为( )
A、404 B、260 C、230 D、20010. 对于反应3A(g)+B(g)4C(g)+2D(g),测得4种条件下的反应速率分别为①v(A)=0.9mol•L-1•s-1、②v(B)=24mol•L-1•min-1、③v(C)=1.6mol•L-1•s-1、④v(D)=0.4mol•L-1•s-1 , 则上述4种条件下的反应速率大小关系正确的是( )A、②>④>③>① B、②>①>④>③ C、②=③>①>④ D、②=③>④=①11. 肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=−32.9 kJ·mol−1;反应Ⅱ:N2H4(g)+H2(g)=2NH3(g) ΔH2=−41.8kJ·mol−1
下列说法错误的是( )
A、图所示过程①是放热反应 B、反应Ⅱ的能量过程示意图如图所示 C、断开3 molN2H4(g)的化学键吸收的能量大于形成1molN2(g)和4molNH3(g)的化学键释放的能量 D、200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g) ΔH=+50.7 kJ·mol−112. 已知反应: , 不同条件下,以X和Y的物质的量之比为开始反应,反应达到平衡时,Z的物质的量分数与压强及温度的关系如图所示。下列判断正确的是( ) A、 B、 C、反应物的转化率随温度升高而减小 D、反应物的转化率随压强增大而减小
A、 B、 C、反应物的转化率随温度升高而减小 D、反应物的转化率随压强增大而减小二、多选题
-
13. 反应CO(g)+2H2(g)CH3OH(g) ΔH<0,达到平衡后,在t1、t2、t4时刻改变某一外界条件时,反应速率随时间变化的曲线如图所示,下列说法正确的是( )
 A、t1时刻改变的条件可能是升高温度 B、t3时刻改变的条件可能是增大反应物的浓度 C、t4时刻改变的条件可能是减小压强 D、t0时刻的平衡常数与t5时刻的平衡常数一定相同14. 丙烯和卤化氢加成,第一步反应产生的碳正离子中间体有两种可能:
A、t1时刻改变的条件可能是升高温度 B、t3时刻改变的条件可能是增大反应物的浓度 C、t4时刻改变的条件可能是减小压强 D、t0时刻的平衡常数与t5时刻的平衡常数一定相同14. 丙烯和卤化氢加成,第一步反应产生的碳正离子中间体有两种可能: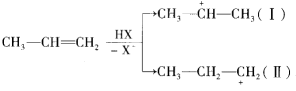
其能量与反应进程关系如图所示。下列说法正确的是( )
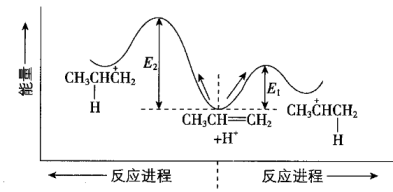 A、合适的催化剂不能改变E1或E2 B、碳正离子中间体的稳定性:I>II C、碳正离子中间体的生成速率:II<I D、由丙烯转化成I和II均要放出热量
A、合适的催化剂不能改变E1或E2 B、碳正离子中间体的稳定性:I>II C、碳正离子中间体的生成速率:II<I D、由丙烯转化成I和II均要放出热量三、综合题
-
15.(1)、 (一)强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢可构成火箭推进剂。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4mol液态肼与足量的液态过氧化氢反应生成N2和水蒸气时放出256.0kJ的热量。
该反应的热化学方程式为。
(2)、16g液态肼与液态过氧化氢反应生成气态水时放出的热量是kJ。(3)、此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。(4)、 (二)煤和石油通常都含有硫的化合物,燃烧生成的二氧化硫为大气主要污染物之一。二氧化硫的治理已成为当前研究的课题。硫与硫的氧化物在转化过程中的能量变化如图所示:
已知:E1=E2-198=E3-245=E6-791.4。
回答下列问题:
图中的I、II、III、IV中属于放热反应的是。
(5)、写出表示S(s)的燃烧热的热化学方程式:。(6)、从图中可看出将SO2氧化成SO3有两条途径:①SO2经过程III、过程IV转化成SO3;②SO2经过程II转化成SO3。这两种途径相比,①改变的条件是 , 改变该条件主要是降低了。已知过程IV的化学方程式为2V2O4(s)+O2(g)2V2O5(s);则过程III的热化学方程式为。16. 甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH1
反应Ⅱ:CO(g)+2H2(g)CH3OH(g)ΔH2
下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K2):
温度
250℃
300℃
350℃
KⅡ
2.0
0.27
0.012
(1)、写出反应Ⅰ的化学平衡常数表达式:KⅠ=;保持恒温恒容,将反应Ⅰ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡(填“正向”“逆向”或“不”)移动,平衡常数KⅠ(填“变大”“变小”或“不变”)。(2)、在一定条件下将2molCO和6molH2充入2L的密闭容器中发生反应Ⅱ,5min后测得c(CO)=0.4mol·L-1 , 计算可得此段时间的反应速率(用H2表示)为mol·L-1·min-1。(3)、由表中数据判断ΔH2(填“>”“<”或“=”)0;反应CO2(g)+H2(g)CO(g)+H2O(g)ΔH3=(用ΔH1和ΔH2表示)。(4)、若容器容积不变,则下列措施可提高反应Ⅱ中CO转化率的是(填序号)。a.使用高效催化剂
b.充入He,使体系总压强增大
c.将CH3OH(g)从体系中分离
d.充入CO,使体系总压强增大
(5)、比较这两种合成甲醇的方法,原子利用率较高的是(填“Ⅰ”或“Ⅱ”)。17. 回答下列问题:(1)、氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)2NH3(g)。该可逆反应达到平衡的标志是____(填字母)。A、3v正(H2)=2v逆(NH3) B、单位时间生成mmolN2的同时消耗3mmolH2 C、容器内的总压强不再随时间而变化 D、混合气体的密度不再随时间变化 E、amolN≡N键断裂的同时,有6amolN—H键断裂 F、N2、H2、NH3的分子数之比为1∶3∶2(2)、利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:①CO(g)+2H2(g)CH3OH(g) ΔH=-99kJ•mol-1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-58kJ•mol-1
③CO2(g)+H2(g)CO(g)+H2O(g) ΔH
图1中能正确反映反应①平衡常数K随温度变化关系的曲线是;反应③的ΔH=kJ•mol-1。
 (3)、合成气的组成=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为;α(CO)随温度升高而减小,其原因是。
(3)、合成气的组成=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为;α(CO)随温度升高而减小,其原因是。 18. 某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:
18. 某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:实验编号
实验温度
试管中所加试剂及其用量/mL
溶液褪至无色所需时间/min
0.6mol/LH2C2O4
H2O
3mol/LH2SO4稀溶液
0.05mol/LKMnO4溶液
①
25
3.0
V1
2.0
3.0
1.5
②
25
2.0
3.0
2.0
3.0
2.7
③
50
2.0
V2
2.0
3.0
1.0
(1)、请写出该反应的离子方程式。(2)、V1=。(3)、根据表中的实验①、②数据,可以得到的结论是。(4)、探究温度对化学反应速率的影响,应选择(填实验编号)。(5)、该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号
实验温度/℃
试管中所加试剂及其用量
再加入某种固体
溶液褪至无色所需时间/min
0.6mol/LH2C2O4
H2O
3mol/LH2SO4稀溶液
0.05mol/LKMnO4溶液
④
25
2.0
3.0
2.0
3.0
MnSO4
t
①该小组同学提出的假设是。
②若该小组同学提出的假设成立,应观察到现象。