黑龙江省龙西北八校联合体2022-2023学年高二上学期第一次月考化学试题
试卷更新日期:2022-11-09 类型:月考试卷
一、单选题
-
1. 下列有关测定中和反应反应热实验的说法正确的是( )A、用铜丝代替玻璃搅拌器,测得的△H偏大 B、强酸的稀溶液与强碱的稀溶液反应生成1 mol H2O的△H均为-57.3 kJ/mol C、测定中和反应反应热的实验中,混合溶液的温度不再变化时,该温度为终止温度 D、某同学通过实验测出稀盐酸和稀NaOH溶液反应1 mol H2O反应热△H=-52.3 kJ/mol,造成这一结果的原因不可能是用测量过稀盐酸温度的温度计直接测量稀NaOH溶液的温度2. 勒夏特列原理是平衡移动问题的指挥棒,下列事实不能用勒夏特列原理解释的是( )A、打开碳酸饮料会有大量气泡冒出,实验室用排饱和食盐水的方法收集氯气 B、对于2HI(g)H2(g)+I2(g),达到平衡后,缩小容器体积可使体系颜色变深 C、反应CO(g)+NO2(g)CO2(g)+NO(g)(正反应为放热反应),达到平衡后,升高温度体系颜色变深 D、工业制取金属钾Na(l)+KCl(l)NaCl(l)+K(g),选取适宜的温度,使钾成蒸气从反应混合物中分离出来3. 只知某反应向正反应方向移动,下列说法错误的是( )
①反应物转化率必定增加;②生成物的浓度必定增加;③反应物的浓度必定降低;④生成物的质量必定减少
A、只有①② B、只有①②③ C、只有③④ D、①②③④4. 在一密闭容器中进行如下反应:2SO2(g)+O2(g) 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是( )A、SO2为0.4 mol/L、O2为0.2 mol/L B、SO2、SO3均为0.15 mol/L C、SO3为0.25 mol/L D、SO3为0.4 mol/L5. 2SO2(g)+O2(g) 2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列有关叙述正确的是( ) A、E1-E2=△H B、该反应为吸热反应 C、升高温度,不影响活化分子的百分数 D、使用催化剂使该反应的反应热发生改变6. 实验室用 粒与稀盐酸反应制备 时反应速率太慢,为了加快反应速率,下列方法可行的是( )A、加入浓 B、加入 C、使 粒过量 D、滴入几滴 溶液7. 科学家结合实验和计算机模拟结果,研究了在贵重金属催化剂表面上的气态体系中,一个CO分子还原NO的能量变化与反应历程如图所示。下列说法错误的是( )
A、E1-E2=△H B、该反应为吸热反应 C、升高温度,不影响活化分子的百分数 D、使用催化剂使该反应的反应热发生改变6. 实验室用 粒与稀盐酸反应制备 时反应速率太慢,为了加快反应速率,下列方法可行的是( )A、加入浓 B、加入 C、使 粒过量 D、滴入几滴 溶液7. 科学家结合实验和计算机模拟结果,研究了在贵重金属催化剂表面上的气态体系中,一个CO分子还原NO的能量变化与反应历程如图所示。下列说法错误的是( ) A、该反应的热化学方程式为2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=Ed-EakJ•mol-1 B、决定整个反应速率快慢的步骤是① C、反应过程中断裂与形成的化学键都包含极性键 D、改变催化剂不能使反应的焓变和熵变发生改变8. 根据表中提供的数据及相关物质结构知识可知:
A、该反应的热化学方程式为2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=Ed-EakJ•mol-1 B、决定整个反应速率快慢的步骤是① C、反应过程中断裂与形成的化学键都包含极性键 D、改变催化剂不能使反应的焓变和熵变发生改变8. 根据表中提供的数据及相关物质结构知识可知:反应1:;
反应2:。
反应1和反应2的反应热分别为( )

化学键
Si-Cl
H-H
Si-Si
H-Cl
O=O
Si-O
键能/(kJ∙mol-1)
360
436
176
431
498
460
A、、 B、、 C、、 D、、9. 下列叙述中有几项可以说明反应2HI(g)H2(g)+I2(g)已达平衡状态的是( )①单位时间内生成nmolH2的同时生成nmolHI
②反应体系的颜色不再变化
③百分组成w(HI)=w(I2)
④反应速率v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥v分解(HI)=v生成(HI)
⑦体系的压强不变
⑧混合气体的相对分子质量不变
⑨反应体系的温度不变
⑩断开2molH—I键同时断开1molH—H键
A、3个 B、4个 C、6个 D、7个10. 以下自发进行反应可用能量判据来解释的是( )A、硝酸铵自发地溶于水 B、2N2O5(g)═4NO2(g)+O2(g)△H=+56.7kJ•mol﹣1 C、(NH4)2 CO3(s)═NH4HCO3(s)+NH3(g);△H=+74.9 kJ/mol D、2H2(g)+O2(g)═2H2O(l);△H=﹣571.6 KJ/mol11. 在1200℃时,天然气脱硫工艺中会发生下列反应H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH1
2H2S(g)+SO2(g)=S2(g)+2H2O(g) ΔH2
H2S(g)+O2(g)=S(g)+H2O(g) ΔH3
2S(g)=S2(g) ΔH4 , 则ΔH4的正确表达式为( )
A、ΔH4=(ΔH1+ΔH2-3ΔH3) B、ΔH4=(3ΔH3-ΔH1-ΔH2) C、ΔH4=(ΔH1+ΔH2+3ΔH3) D、ΔH4=(ΔH1-ΔH2-3ΔH3)12. 反应X(g)+Y(g)2Z(g)(放热反应),达到平衡时,下列说法正确的是( )A、减小容器体积,平衡向右移动 B、加入催化剂,Z的产率增大 C、增大c(X),X的转化率增大 D、降低温度,Y的转化率增大13. 对于反应 , 下列各数据表示不同条件下的反应速率,其中反应进行得最慢的是( )A、 B、 C、 D、14. 下列关于热化学反应方程式的描述中正确的是( )A、稀HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则稀H2SO4和稀Ba(OH)2溶液反应的热化学方程式:H2SO4(aq)+Ba(OH)2(aq)= BaSO4(s)+H2O(l) ΔH= -57.3kJ/mol B、CO的燃烧热是283.0kJ/mol,则:2CO2(g)=2CO(g)+O2(g) ΔH=2×(-283.0)kJ/mol C、两个起始体积相同的容器中充入等量的NO2发生反应:2NO2(g) N2O4(g) 达到平衡,恒压容器中气体的颜色比恒容容器中颜色深 D、已知石墨转化为金刚石要吸热,则等量的石墨与金刚石相比总键能小15. 在密闭容器中的一定量混合气体发生反应: , 平衡时测得A的浓度为。保持温度不变,将容器的容积压缩到原来的一半,再达到平衡时,测得A的浓度变为。下列有关判断错误的是( )A、C的体积分数增大了 B、A的转化率降低了 C、平衡向正反应方向移动 D、16. 某温度下,将0.2molCO和0.2molH2O充入某密容器中,在催化剂存在下,发生反应:H2O(g)+CO(g)CO2(g)+H2(g),达到化学平衡时H2的物质的量分数为25%。保持温度不变,若将1.5molCO和3molH2O充入上述反应器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是( )A、 B、 C、 D、17. 向四个起始容积相同的密闭容器中充入表中所示气体及相应的量,加入催化剂并控制温度、容积或压强,发生反应 , 直至达平衡。下列说法错误的是( )编号
条件
起始物质的量/
温度/
容积或压强
①
600
维持恒容
0.2
0.2
0
0
②
700
维持恒容
0.1
0.1
0.1
0.05
③
600
维持恒容
0.4
0.4
0
0
④
600
维持恒压
0.4
0.4
0
0
A、平衡时的浓度:①>② B、平衡时的正反应速率:①<② C、的平衡转化率:③>① D、平衡时容器内气体总压:④>③>①>②18. 反应(放热反应)的反应速率随时间变化如图所示,在、、、时刻都只有一个条件发生改变。下列判断正确的是( )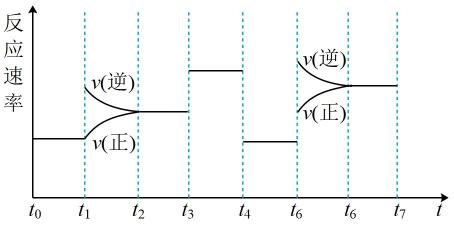 A、阶段,A的转化率最小 B、时,改变的条件一定是使用了催化剂 C、时,改变的条件一定是升高了温度 D、阶段,C的百分含量最大19. 可逆反应①X(g)+2Y(g)2Z(g) 、②2M(g)N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
A、阶段,A的转化率最小 B、时,改变的条件一定是使用了催化剂 C、时,改变的条件一定是升高了温度 D、阶段,C的百分含量最大19. 可逆反应①X(g)+2Y(g)2Z(g) 、②2M(g)N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
下列判断正确的是( )
A、反应①的正反应是吸热反应 B、达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15 C、达平衡(I)时,X的转化率为 D、在平衡(I)和平衡(II)中,M的体积分数相等二、综合题
-
20. 一定温度下,向一容积为 5 L 的恒容密闭容器中充入 0.4 mol SO2和0.2 mol O2 , 发生反应:2SO2(g)+O2(g) ⇌2SO3(g)H=-196 kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:(1)、判断该反应达到平衡状态的标志是(填序号)。
a.SO2、O2、SO3三者的浓度之比为 2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和 SO3的生成速率相等
(2)、①SO2的转化率为;②达到平衡时反应放出的热量为;
③此温度下该反应的平衡常数 K=。
(3)、如图表示平衡时 SO2的体积分数随压强和温度变化的曲线,则:
①温度关系 : T1T2( 填 “>”“<” 或“=”,下同);
②平衡常数关系:KAKB , KAKD。
21.(1)、Ⅰ、大气中的二氧化碳主要来自煤、石油及其他含碳化合物的燃烧。已知时,下,相关物质燃烧的热化学方程式知下:①;
②。
石墨在氧气中燃烧至反应物均耗尽:
①燃烧后的产物为(填化学式),转移的电子总物质的量为。
②燃烧后放出的总热量为。
③将所得气体通入溶液中充分反应(不考虑气体的逸出),所得的盐为(填化学式),判断的依据是。
④若测得③中反应放出的总热敏为 , 已知该条件下,将 , 通入溶液中充分反应放出的热量。则与溶液反应生成的热化学方程式为(用含m、n的式子表示)。
(2)、已知: , 下列说法正确的是____(填标号)。A、金刚石比石显稳定 B、每放出的热量,需消耗氧气的体积为 C、等物质的量的金刚石和石墨,完全燃烧后,石墨放出的热量更少(3)、 Ⅱ、在一定温度,下,分别在密闭容器中充入和 , 发生反应: , 达平衡时,测得无毒气体的体积分数 , 该条件下平衡常数(为以分压表示的平衡常数,分压-总压×物质的量分数)。三、综合题
-
22. 取的溶液与的硫酸溶液置于如图所示的装置中进行中和反应反应热的测定实验:

温度
起始温度
终止温度
实验次数
平均值
1
26.2
26.0
26.1
29.5
2
27.0
27.4
27.2
32.3
3
25.9
25.9
25.9
29.2
4
26.4
26.2
26.3
29.8
回答下列问题:
(1)、从(上图)中实验装置看,其中尚缺少的一种玻璃仪器是。(2)、实验中若用溶液跟溶液反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”)。(3)、若溶液和硫酸溶液的密度都是 , 反应后生成的溶液比热容 , 通过以上数据计算中和反应反应热(结果保留小数点后1位)。(4)、现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和的稀盐酸恰好完全反应,其反应热分别为 , 则的大小关系为。(5)、现将浓度相等、体积分别为的溶液混合,测量混合液温度,结果如图(已知:)。下列叙述正确的是____。 A、实验的环境温度为 B、P点混合溶液呈中性 C、由M、P点温差计算可得到中和热为 D、若将改为 , P点将向右下方移动(6)、中和热测定实验中,下列操作能保证实验准确性的是(填字母)。
A、实验的环境温度为 B、P点混合溶液呈中性 C、由M、P点温差计算可得到中和热为 D、若将改为 , P点将向右下方移动(6)、中和热测定实验中,下列操作能保证实验准确性的是(填字母)。a、为节省时间,只做一次实验
b、两烧杯夹层间碎纸条没有填满
c、记录混合液的最高温度作为终止温度
d、用铁制容器代替烧杯进行实验
c、测量溶液的温度计用水洗净擦干后才用米测溶液的温度