河南省豫北名校2022-2023学年高二上学期10月教学质量检测化学试题
试卷更新日期:2022-11-09 类型:月考试卷
一、单选题
-
1. 化学与生活、生产密切相关。下列说法错误的是( )A、空气中的水蒸气被冷凝成饮用水的过程是放热反应 B、用可除去工业废水中的等重金属离子 C、研发新型催化剂,使工业合成氨在温和条件下发生,可降低能耗 D、回收利用废旧的铅酸蓄电池,既可以减少环境污染,又可以节约资源2. 已知 H2(g)+Cl2(g)2HCl(g) ∆H=-183kJ∙mol-1 , 其它相关数据如表:
物质
H2
Cl2
HCl
1mol分子中的化学键断裂时吸收的能量/kJ
436
a
431
下列说法正确的是( )
A、1L H2(g)和1L Cl2(g)完全反应生成2L HCl(g)放出183kJ热量 B、1mol H2(g)和1mol Cl2(g)的总能量小于2mol HCl(g)的总能量 C、a=243 D、该反应生成2mol HCl(l)时,放出的能量小于183kJ3. 下列关于化学反应方向的说法正确的是( )A、凡是放热的反应都是自发反应 B、凡是需要加热才发生的反应都是非自发反应 C、凡是熵增的反应都是自发反应 D、反应是否自发,需要综合考虑反应焓变和熵变4. 下列事实不可以证明是弱碱的是( )A、常温下,溶液的 B、溶液可以使酚酞试液变红 C、溶液与过量氨水反应,产生的沉淀不溶解 D、相同条件下,氨水的导电性比溶液的弱5. 下列关于溶液的说法错误的是( )A、溶液中含有2种分子和5种离子 B、升高温度,的水解平衡正向移动 C、加水稀释,的水解平衡正向移动 D、加入氢氧化钠固体,可以使溶液中6. 已知在密闭容器中发生反应:。下列说法错误的是( )A、和充分反应,生成Z的物质的量小于 B、达到化学平衡状态时,X、Y、Z的浓度均不再发生变化 C、达到平衡时,升高温度,逆反应速率增大,正反应速率减小,平衡逆向移动 D、调整该反应起始时反应物的量,达到化学平衡状态时,放出的总热量可达7. 一定温度下,在的四氯化碳溶液()中发生分解反应:。在不同时刻测量放出的体积,换算成浓度如表:0
600
1200
1710
2220
2820
x
1.40
0.96
0.66
0.48
0.35
0.24
0.12
下列说法错误的是( )
A、 , 生成的平均速率为 B、反应时,放出的体积为 C、推测上表中的x为3930 D、反应达到平衡时,8. 下列实验现象和实验结论错误的是( )选项
实验操作
实验现象
实验结论
A
向溶液中滴加溶液,再加入少量固体
溶液变红,加入固体后,红色变浅
加入后,的平衡逆向移动
B
用计分别测量相同物质的量浓度的溶液和溶液的
溶液的大于溶液的
C
向2支试管中依次加入等体积等物质的量浓度的和混合液,分别置于冷水和热水中
置于热水中的混合溶液先出现浑浊
温度升高,化学反应速率加快
D
向盛有溶液的试管中逐滴滴入溶液至不再产生沉淀,再向其中滴加溶液
观察到先产生砖红色沉淀 , 然后砖红色沉淀转变为黑色沉淀
A、A B、B C、C D、D9. 电化学气敏传感器可用于监测环境中的含量,其工作原理示意图如图所示。下列说法错误的是( )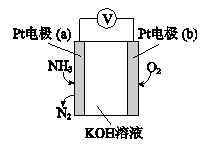 A、工作时,溶液中向电极a移动 B、a的电极反应式为 C、反应消耗的与的物质的量之比为4:5 D、在电极b上发生还原反应10. 室温下,通过下列实验探究Na2S溶液的性质。
A、工作时,溶液中向电极a移动 B、a的电极反应式为 C、反应消耗的与的物质的量之比为4:5 D、在电极b上发生还原反应10. 室温下,通过下列实验探究Na2S溶液的性质。实验
实验操作和现象
1
用pH试纸测定0.1 mol·L-1 Na2S溶液的pH,测得pH约为l3
2
向0.1 mol·L-1 Na2S溶液中加入过量的0.2mol·L-1AgNO3溶液,产生黑色沉淀
3
向0.1 mol·L-1 Na2S溶液中通入过量的H2S气体,测得溶液pH约为9
4
向0.1mol·L-1 Na2S溶液中滴加几滴0.05mol·L-1盐酸,观察不到明显现象
下列说法错误的是( )
A、Na2S溶液中存在c(OH-)=c(H+)+c(HS-)+2c(H2S) B、实验2反应静置后的上层清液中有c2(Ag+)∙ c(S2-)=Ksp(Ag2S) C、实验3得到的溶液中有c(HS-)+2c(S2-)=0.2mol/L D、实验4发生反应的离子方程式为S2-+H+=HS-11. 一种新型可充电电池,其工作原理如图所示。下列说法正确的是( )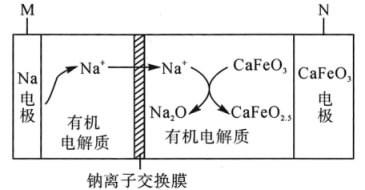 A、放电时N为正极,电极反应为 B、充电时,电极M为阳极 C、放电时,电流由电极M沿导线流向电极N D、电极材料中,单位质量放出的电能大小:12. 利用电化学原理将二氧化碳转化为甲醇,同时将糠醛(
A、放电时N为正极,电极反应为 B、充电时,电极M为阳极 C、放电时,电流由电极M沿导线流向电极N D、电极材料中,单位质量放出的电能大小:12. 利用电化学原理将二氧化碳转化为甲醇,同时将糠醛( )转化为糠酸(
)转化为糠酸( ),其工作原理如图所示。下列说法正确的是( )
),其工作原理如图所示。下列说法正确的是( ) A、“石墨烯”是电池的负极 B、该离子交换膜为阴离子交换膜 C、电池的总反应为
A、“石墨烯”是电池的负极 B、该离子交换膜为阴离子交换膜 C、电池的总反应为
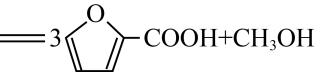 D、每消耗 , 则通过离子交换膜的为
13. (s)与CO(g)主要发生如下反应。
D、每消耗 , 则通过离子交换膜的为
13. (s)与CO(g)主要发生如下反应。①
②
反应的还原产物与温度密切相关。其他条件一定,(s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法错误的是( )
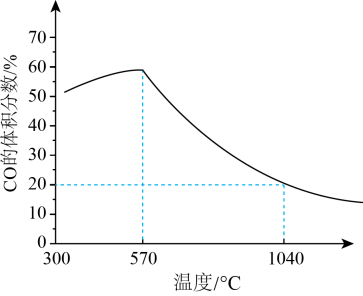 A、反应的焓变为 B、根据图像推测,应当小于0 C、反应温度越高,主要还原产物中铁元素的价态越低 D、温度高于1040℃时,(s)和CO(g)发生的主要反应的化学平衡常数14. 常温下,或的单一饱和溶液体系中,金属阳离子的物质的量浓度的负对数与溶液的变化关系如图所示。已知常温下, , 下列说法错误的是( )
A、反应的焓变为 B、根据图像推测,应当小于0 C、反应温度越高,主要还原产物中铁元素的价态越低 D、温度高于1040℃时,(s)和CO(g)发生的主要反应的化学平衡常数14. 常温下,或的单一饱和溶液体系中,金属阳离子的物质的量浓度的负对数与溶液的变化关系如图所示。已知常温下, , 下列说法错误的是( ) A、曲线a表示饱和溶液中的变化关系,且 B、向X点对应的饱和溶液中加入少量固体,可转化为Y点对应的溶液 C、除去酸性溶液中含有的少量杂质,可加入适量 , 充分搅拌后过滤 D、当和两种沉淀共存时,溶液中
A、曲线a表示饱和溶液中的变化关系,且 B、向X点对应的饱和溶液中加入少量固体,可转化为Y点对应的溶液 C、除去酸性溶液中含有的少量杂质,可加入适量 , 充分搅拌后过滤 D、当和两种沉淀共存时,溶液中二、综合题
-
15. 合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。回答下列问题:(1)、结合下表数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是。
化学反应
K(298K)的数值
N2(g)+O2(g)2NO(g)
5.0×10-31
N2(g)+3H2(g)2NH3(g)
4.1×106
(2)、对于反应N2(g)+3H2(g)2NH3(g),在一定条件下氨的平衡含量如下表:温度/℃
压强/MPa
氨的平衡含量(体积分数)
200
10
81.5%
550
10
8.25%
①合成氨反应为(填“吸热”或“放热”)反应。
②其他条件不变时,升高温度,氨的平衡含量减小的原因是(填标号)。
A.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
B.升高温度,浓度商(Q)增大,平衡常数(K)不变,Q>K,平衡向逆反应方向移动
C.升高温度,活化分子数增多,反应速率加快
D.升高温度,平衡常数(K)减小,平衡向逆反应方向移动
(3)、图1表示500℃、60.0MPa条件下,平衡时NH3的体积分数与原料气投料比的关系。根据图中M点数据,可计算出平衡时N2的体积分数为。 (4)、图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中X代表的是(填“温度”或“压强”)。判断L1、L2的大小关系并说明理由。
(4)、图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中X代表的是(填“温度”或“压强”)。判断L1、L2的大小关系并说明理由。 16. 硫及其化合物在生产生活中有重要的应用。回答下列问题:(1)、煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应如下:
16. 硫及其化合物在生产生活中有重要的应用。回答下列问题:(1)、煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应如下:则(用含a、b的式子表示)。
(2)、溶液脱除空气中并再生的原理如图甲所示。
将一定体积含有的空气匀速通入溶液中,反应相同时间,初始浓度及其与脱除率的关系如图乙所示。当时,脱除率下降的原因是。
 (3)、已知: , 下列关于该反应的说法正确的是____(填标号)。A、相同时间内,消耗的同时生成 , 则反应达到平衡 B、使用催化剂,可以提高的平衡转化率 C、当温度、压强一定时,气体的平均摩尔质量不变时,则反应达到平衡 D、增大氧气的浓度,活化分子的百分数增大,有效碰撞频率增大,反应速率加快 E、其他条件相同,恒压比恒容条件具有更高的平均反应速率和更大的平衡常数(4)、和少量水蒸气置于容积可变的真空密闭容器中,受热逐渐失去的三个化学方程式、水蒸气的平衡压强和温度的关系如表所示:
(3)、已知: , 下列关于该反应的说法正确的是____(填标号)。A、相同时间内,消耗的同时生成 , 则反应达到平衡 B、使用催化剂,可以提高的平衡转化率 C、当温度、压强一定时,气体的平均摩尔质量不变时,则反应达到平衡 D、增大氧气的浓度,活化分子的百分数增大,有效碰撞频率增大,反应速率加快 E、其他条件相同,恒压比恒容条件具有更高的平均反应速率和更大的平衡常数(4)、和少量水蒸气置于容积可变的真空密闭容器中,受热逐渐失去的三个化学方程式、水蒸气的平衡压强和温度的关系如表所示:化学方程式
水蒸气的平衡压强
Ⅰ:
1.04
6.05
Ⅱ:
0.75
4.00
Ⅲ:
0.11
0.60
①图丙表示水蒸气平衡压强与温度的关系曲线,其中表示平衡时反应Ⅲ的曲线是(填“a”“b”或“c”)。

②设为相对压力平衡常数,其表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为)除以。在时,反应Ⅱ的。
17. 室温下,有浓度均为的下列五种溶液:①溶液、②溶液、③溶液、④溶液、⑤溶液,已知室温下电离常数:; , 。回答下列问题:
(1)、上述溶液中,水的电离被抑制的是(填序号,下同),水的电离被促进的是。(2)、上述溶液的由大到小的顺序为。(3)、比较溶液③和④中的物质的量浓度:③④(填“>”“<”或“=”)。(4)、向溶液①中加水稀释至原体积的2倍,恢复至室温,所得溶液的。(5)、为确定溶液①稀释后的精确浓度,取稀释后的待测溶液①于锥形瓶中,用浓度为的标准溶液滴定。①为了确定滴定终点,还需要加入的试剂为。达到滴定终点的现象为。
②在滴定实验过程中,下列仪器中有蒸馏水,对实验结果没有影响的是(填标号)。
A.酸式滴定管 B.锥形瓶 C.碱式滴定管
③经3次平行实验,达到滴定终点时,平均消耗标准溶液 , 则溶液①稀释后的精确浓度为。
18. 通过化学方法可使能量按人们所期望的形式转化,从而开辟新能源和提高能量转化率。回答下列问题:(1)、根据构成原电池本质判断,如下反应可以设计成原电池的是____(填标号)。A、 B、 C、 D、(2)、为了探究化学反应中的能量变化,某同学设计了如图两个实验。有关实验现象,下列说法正确的是____(填标号)。 A、图甲和图乙的气泡均产生于锌棒表面 B、图乙中产生气体的速率比图甲快 C、图甲中温度计显示的最高温度高于图乙中温度计显示的最高温度 D、图甲和图乙中温度计显示的温度相等,且均高于室温(3)、如图是甲烷燃料电池的工作原理示意图。
A、图甲和图乙的气泡均产生于锌棒表面 B、图乙中产生气体的速率比图甲快 C、图甲中温度计显示的最高温度高于图乙中温度计显示的最高温度 D、图甲和图乙中温度计显示的温度相等,且均高于室温(3)、如图是甲烷燃料电池的工作原理示意图。
①电池的负极是电极(填“a”或“b”),该极的电极反应为。
②电池工作一段时间后,电解质溶液的(填“增大”“减小”或“不变”)。
(4)、熔融盐燃料电池具有很高的发电效率,因而受到重视。可用碳酸锂和碳酸钠的熔融盐混合物作电解质,一氧化碳为负极燃气,空气与二氧化碳的混合气为正极助燃气,制得在下工作的燃料电池,其负极反应为。①正极反应式为。
②总反应式为。
19. 我国科学家利用多相催化剂 , 以为氧化剂,为氮源,在温和条件下制备酰胺、腈类。某小组以菱锰矿(主要成分为 , 含和等)为原料制备。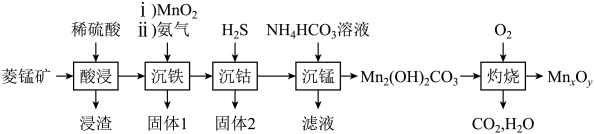
已知:常温下,。的电离常数:。
回答下列问题:
(1)、“酸浸”过程中,溶解的离子方程式为。(2)、“沉铁”中加入的目的是(用离子方程式表示)。已知常温下, , 恰好完全沉淀时(此时浓度为)溶液的。(已知)(3)、“沉钴”中发生的反应为 , 该反应的平衡常数。(4)、“沉锰”过程中,生成沉淀的离子方程式为。常温下加入的溶液呈(填“酸性”“中性”或“碱性”)(已知:的 , 的)。