安徽省示范高中培优联盟 2022-2023学年高二上学期联赛化学试题
试卷更新日期:2022-11-09 类型:竞赛测试
一、单选题
-
1. 化学与生活密切相关,下列叙述错误的是( )A、75%的乙醇溶液可以用作医用消毒剂 B、铝制餐具用于蒸煮酸性食物 C、亚硝酸钠可以用作食品防腐剂 D、硅酸钠可以用作黏合剂和防火剂2. 加碘食盐中的碘以碘酸钾(KIO3)的形式存在。已知在溶液中与I-可发生反应:+5I-+6H+=3I2+3H2O。根据上述反应,可用试纸和一些常见试剂进行实验,证明食盐中存在。
可供选用的物质有:①蒸馏水②蓝色石蕊试纸③碘化钾④淀粉⑤硝酸⑥乙酸⑦乙醇。
进行上述实验时,下列选择正确的是( )
A、①②③⑦ B、①③④⑤ C、①③④⑥ D、①②④⑤⑦3. 下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式正确的是( )选项
微粒
加入试剂
发生反应的离子方程式
A
Na+、Fe3+、Cl-、I-
NaOH溶液
Fe3++3OH-=Fe(OH)3↓
B
NH、H+、SO
少量Ba(OH)2
H++OH-+Ba2++SO=H2O+BaSO4↓
C
H+、Fe2+、Cl-、SO
Ba(NO3)2溶液
Ba2++SO=BaSO4↓
D
Na+、Al3+、Cl-、NO
少量澄清石灰水
Al3++3OH-=Al(OH)3↓
A、A B、B C、C D、D4. 下列变化中,符合图示电子转移的是( )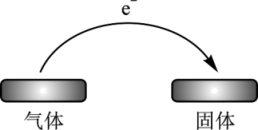 A、NH3使CuO变为红色 B、CO2使过氧化钠变白 C、铝在空气中形成钝化膜 D、灼热的铁丝在氯气中燃烧5. 用如图装置(夹持装置略)进行实验,由b中现象能证明a中产物生成的是( )
A、NH3使CuO变为红色 B、CO2使过氧化钠变白 C、铝在空气中形成钝化膜 D、灼热的铁丝在氯气中燃烧5. 用如图装置(夹持装置略)进行实验,由b中现象能证明a中产物生成的是( )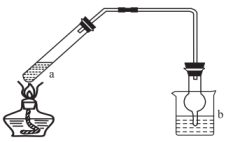
a中反应
b中检测试剂及现象
A
铁粉与水生成H2
肥皂水冒泡
B
浓NaOH和NH4Cl溶液生成NH3
酚酞溶液变红
C
浓HNO3分解生成NO2
淀粉—KI溶液变蓝
D
浓HCl与MnO2生成Cl2
紫色石蕊溶液变红
A、A B、B C、C D、D6. 研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如图所示。
已知几种物质中化学键的键能如表:
化学键
H2O中的H-O键
O2中的O=O键
H2中的H-H键
H2O2中的O-O键
H2O2中的O-H键
键能kJ/mol
463
498
436
138
463
若反应过程中分解了2mol水,则下列说法错误的是( )
A、过程I吸收了926kJ能量 B、过程II形成了非极性共价键 C、过程III属于放热反应 D、总反应为2H2O2H2↑+O2↑7. 向盛有少量Na2O2的密闭容器(体积不变)中通入SO2 , 测定容器中O2的含量随时间变化曲线如图,
则下列说法错误的是( )
A、ab段O2含量增加的原因:2Na2O2+2SO2=2Na2SO3+O2 B、bc段O2含量缓慢降低的可能原因:反应生成O2的速率小于消耗O2的速率 C、c点O2含量高于a点,则此时反应产物中含有Na2SO3 D、取c点少量固体,加入BaCl2溶液有白色固体生成,证实有Na2SO4生成8. 一种水性电解液Zn-MnO2电池如图所示(KOH溶液中,Zn2+以Zn(OH)存在),a、b为离子交换膜。电池放电时,K2SO4溶液的浓度增大。下列叙述错误的是( ) A、a为阴离子交换膜 B、III区的K+通过离子交换b向II区迁移 C、I区的H+减少2mol,Zn电极质量减少65g D、电池总反应:Zn+4OH-+MnO2+4H+=Zn(OH)+Mn2++2H2O9. 在恒温恒容的密闭容器中,某催化剂表面上发生氨的分解反应:2NH3(g)N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时间的变化如表所示,下列说法正确的是( )
A、a为阴离子交换膜 B、III区的K+通过离子交换b向II区迁移 C、I区的H+减少2mol,Zn电极质量减少65g D、电池总反应:Zn+4OH-+MnO2+4H+=Zn(OH)+Mn2++2H2O9. 在恒温恒容的密闭容器中,某催化剂表面上发生氨的分解反应:2NH3(g)N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时间的变化如表所示,下列说法正确的是( )编号
时间/min
c(NH3)/(10-3mol•L-1)
表面积/cm2
0
20
40
60
80
①
a
2.40
2.00
1.60
②
a
1.20
0.80
0.40
x
③
2a
2.40
1.60
0.80
0.40
0.40
A、实验①,N2的反应速率:0~20min大于20~40min B、实验②,40min时,v正(NH3)=v逆(NH3) C、相同条件下,增加氨气的浓度,反应速率增大 D、相同条件下,增加催化剂的表面积,反应速率增大10. 如图所示,在一支50mL注射器中吸入20mLNO,然后吸入5mL水,用乳胶管和弹簧夹封住管口。下列实验操作不能达到预期目的的是( )
实验操作
目的
A
振荡注射器,无明显现象
验证NO不溶于水
B
打开弹簧夹,快速吸入10mL空气后,夹上弹簧夹,无色气体变为红棕色
证明可发生反应:2NO+O2=2NO2
C
再次振荡注射器,气体颜色逐渐变浅至无色,注射器活塞向内移动
证明可发生反应:3NO2+H2O=2HNO3+NO
D
再打开弹簧夹,快速吸入空气至活塞位置处于最大刻度处,夹上弹簧夹,充分振荡注射器后静置,直至无明显现象为止
将注射器中的NO完全转化为HNO3
A、A B、B C、C D、D11. 将Cl2通入过量石灰乳[Ca(OH)2]中即可制得以Ca(ClO)2为有效成分的漂白粉。下列解释事实的方程式中,错误的是( )A、生成Ca(ClO)2:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O B、漂白粉溶液与盐酸混合产生Cl2:ClO﹣+Cl﹣+2H+=Cl2↑+H2O C、漂白粉溶液吸收CO2后产生白色沉淀:Ca2++CO2+H2O=CaCO3↓+2H+ D、漂白粉溶液加入适量醋酸在短时间内能达到漂白效果:Ca(OH)2+2CH3COOH=Ca(CH3COO)2+2H2O、Ca(ClO)2+2CH3COOH=Ca(CH3COO)2+2HClO12. LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如图:
已知:BaS易溶于水
下列说法错误的是( )
A、还原工序中加入BaS的目的:还原HBr中的少量Br2 B、除杂工序中产生滤渣的主要成分为:BaSO4、S C、中和工序中发生的化学反应主要为:Li2CO3+H2SO4=Li2SO4+CO2↑+H2O D、参与反应的n(Br2):n(BaS):n(H2SO4)=1:1:1二、多选题
-
13. 研究小组为探究Na2S晶体在空气中变质后的产物,进行实验并记录现象如下:
①取Na2S样品加水溶解,得到澄清溶液a。
②取少量溶液a加入过量盐酸,有臭鸡蛋气味的气体放出,且出现淡黄色浑浊。
③将②中浊液过滤,向滤液中加入BaCl2溶液,产生白色沉淀。
已知:Na2S溶液能溶解S生成Na2Sx , Na2Sx与酸反应生成S和H2S(臭鸡蛋气味)
下列说法错误的是( )
A、②中淡黄色浑浊可能是S与H+反应产生的 B、①和②说明该Na2S样品中含有S C、③中白色沉淀是BaSO4 D、该Na2S样品中不可能含有Na2SO314. CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之后,以N2为载气,以恒定组成的N2、CH4为混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到CO2 , 在催化剂上检测到有积碳。
下列说法错误的是( )
A、反应①为化合反应,反应②为氧化还原反应 B、t1~t3 , n(H2)比n(CO)多,可能有副反应CH4C+2H2 C、t2时刻,副反应生成H2的速率大于反应②生成H2的速率 D、t3之后,生成CO的速率为0,可能是反应②到达化学平衡状态三、综合题
-
15. 利用太阳能分解H2O获得氢气,再通过CO2加氢制甲醇(CH3OH)等燃料,从而实现可再生能源和CO2的资源化利用。
 (1)、H2O的空间结构为;CO2的形成过程为(用电子式表示)。(2)、过程IV的能量转化形式为。(3)、过程I、II是典型的人工光合作用过程:4H2O+2CO22CH3OH+O2 , 该反应是(填“吸热”或“放热”)反应。(4)、过程II中CO2催化加氢制取甲醇,反应如下:
(1)、H2O的空间结构为;CO2的形成过程为(用电子式表示)。(2)、过程IV的能量转化形式为。(3)、过程I、II是典型的人工光合作用过程:4H2O+2CO22CH3OH+O2 , 该反应是(填“吸热”或“放热”)反应。(4)、过程II中CO2催化加氢制取甲醇,反应如下:主反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
副反应:CO2(g)+H2(g)CO(g)+H2O(g) △H1=+41.2kJ•mol-1
①CO、H2生成CH3OH的热化学方程式是。
②提高CH3OH在平衡体系中的含量,可采取如下措施:(写出两条即可)。
(5)、过程III制得的H2中混有CO,去除CO的反应如下:CO(g)+H2O(g)CO2(g)+H2(g)。在容积不变的密闭容器中,将0.1molCO、0.1molH2O混合加热到830℃发生上述反应,下列情况说明该反应一定达到化学平衡的是。a.CO的物质的量不再发生变化
b.CO与H2的物质的量浓度相等
c.n(CO)∶n(H2O)∶n(CO2)∶n(H2)=1∶1∶1∶1
d.v正(CO)=v逆(H2O)
(6)、多步热化学循环分解水是制氢的重要方法,如“铁—氯循环”法,反应如下:i.4H2O(g)+3FeCl2(s)=Fe3O4(s)+6HCl(g)+H2(g) △H1
ii.Fe3O4(s)+8HCl(g)=FeCl2(s)+2FeCl3(s)+4H2O(g) △H2
iii.2FeCl3(s)=2FeCl2(s)+Cl2(g) △H3
iv. △H4
反应i~iv循环可分解水,可利用△H1~△H4计算2H2O(g)=2H2(g)+O2(g)的△H。在横线处写出反应iv的化学方程式 。
(7)、大规模制H2所需能量可由太阳能提供。利用Na2CO3•10H2O可将太阳能储存、释放,结合反应方程式说明储存、释放太阳能的原理:。16. 乙烯是重要有机化工原料。结合以下路线回答: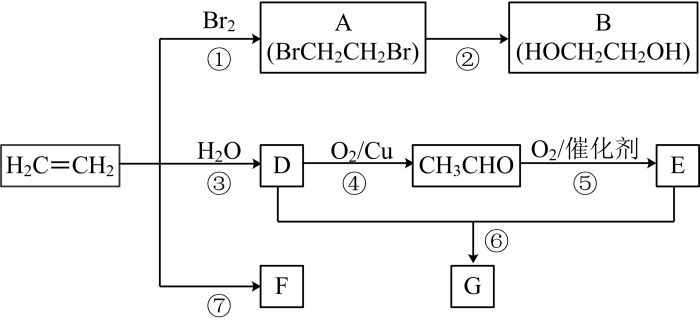
已知:2CH3CHO+O22CH3COOH
(1)、反应①的反应类型是 , B的官能团是。(2)、F是一种高分子,可用于制作食品袋,其结构简式为。(3)、G是一种油状、有香味的物质,有以下两种制法。制法一:实验室用D和E反应制取G,装置如图1所示。

i.关于该实验的说法错误的是(填序号)。
a.甲中加入几片碎瓷片可以防止暴沸
b.乙中导管不伸入液面下是为了防止倒吸
c.甲中加入过量D,可使E的转化率达到100%
d.实验结束,乙中液体上层为无色透明的油状液体
e.乙中的饱和Na2CO3溶液可以用NaOH代替
ii.反应⑥的化学方程式是 , 反应类型是。
iii.分离出试管乙中油状液体的方法是。
制法二:工业上用CH2=CH2和E直接反应获得G。
iv.直接反应获得G的化学反应方程式是。
v.与制法一相比,制法二的优点是。
(4)、采用装置如图2证明乙酸的酸性强于碳酸。试剂M、N分别是:、。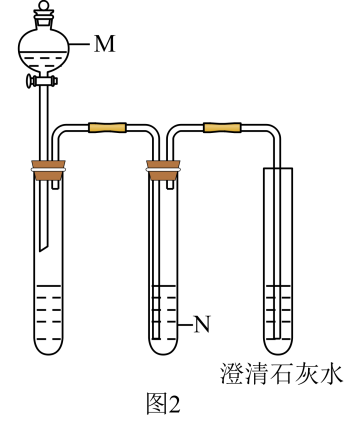 17. 某研究小组利用如图装置(夹持装置略)制备氯气,并探究不同条件下氯气与二价锰化合物的反应。
17. 某研究小组利用如图装置(夹持装置略)制备氯气,并探究不同条件下氯气与二价锰化合物的反应。资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、(绿色)、(紫色)
ii.浓碱条件下,可被OH-还原为
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱

序号
物质a
C中实验现象
通入Cl2前
通入Cl2后
I
水
得到无色溶液
产生棕黑色沉淀,且放置后不发生变化
II
5%NaOH溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
III
40%NaOH溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
(1)、盛装浓盐酸的仪器名称是 , 为减缓生成Cl2的速率,可以采用的方法是。(2)、B中试剂是。(3)、D的作用是 , 可选用的试剂(填标号)。a.NaCl b.FeCl2 c.Na2SO3 d.NaOH e.H2SO4
(4)、通入Cl2后,I中产生棕黑色沉淀的化学方程式为。(5)、对比实验I、II通入Cl2后的实验现象,可以得出的结论是:二价锰化合物的还原性。(6)、根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将氧化为
①用离子方程式表示可能导致溶液碱性减弱的原因 , 但通过实验测定溶液的碱性变化很小。
②取III中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为 , 溶液绿色缓慢加深,原因是MnO2被(填“化学式”)氧化,可证明III的悬浊液中氧化剂过量。
③取III中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深的原因是。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因。
18. 某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3 , 进而制备高纯氧化铁晶体,其流程如图:
已知:i.FeS2与稀硫酸不反应;
ii.Fe3+通过反应I、反应II被还原,反应I为:2Fe3++FeS2=2S+3Fe2+。
(1)、为提高“浸取”工序的反应速率,可采用的措施有:搅拌、催化剂、(写两条)。(2)、滤渣的成分是。(3)、①配平还原反应II的离子方程式:。_FeS2+_Fe3++_H2O=_Fe2++_SO+_。
②还原前后溶液中部分离子的浓度见表(溶液体积变化忽略不计):
离子
还原前浓度(mol•L-1)
还原后浓度(mol•L-1)
Fe2+
0.10
2.50
3.50
3.70
反应I、II中生成的Fe2+的物质的量之比为。
(4)、①“沉淀”工序中的离子反应方程式为。②“沉淀”工序中所得沉淀需充分洗涤,检验沉淀是否洗净的方法是。
(5)、“煅烧”工序是在空气中进行,“煅烧”工序中的化学反应方程式为。(6)、取agFeCO3样品,加适量稀硫酸溶解后,向其中加入VmL0.1000mol•L-1的KMnO4溶液恰好完全反应。(已知:杂质不参与反应)样品中FeCO3质量分数的计算式为(用质量分数表示)。
(7)、直接煅烧FeSO4也可以制备Fe2O3 , 该方法与煅烧FeCO3制备法相比有何缺点?。