高中化学人教版(2019)必修第二册 第五章第一节 【硫及其化合物】
试卷更新日期:2022-11-03 类型:同步测试
一、单选题
-
1. 硫及其化合物的转化具有重要应用。下列说法正确的是( )A、硫元素在自然界中均以化合态形式存在 B、空气中排放过量SO2会形成酸雨,且酸雨的pH会随时间增长而降低 C、常温下浓H2SO4能使铁片钝化是因为浓硫酸具有脱水性 D、质量分数为49%、密度为1.4g·cm-3的硫酸,其物质的量浓度为2.8 mol·L-12. 下列关于浓硫酸的说法正确的是( )A、不能用铁制容器盛装冷浓硫酸 B、稀释浓硫酸是将水沿着容器壁慢慢倒入浓硫酸中 C、浓硫酸能使蔗糖变黑,体现了浓硫酸的脱水性 D、浓硫酸是一种常用的液体干燥剂,可用于干燥氨气3. 下列说法正确的是( )A、因为具有漂白性,所以它能使酸性高锰酸钾溶液褪色 B、气体通入溶液能产生白色沉淀 C、热稳定性: D、硫和氯气分别与铁反应后,铁元素的价态相同4. 下图所示的实验装置中,实验开始一段时间后,观察到的现象错误的是( )
 A、苹果块会干瘪 B、胆矾晶体表面有“白斑” C、小试管内有晶体析出 D、pH试纸变红5. 在指定条件下,下列选项所示的物质间转化能实现的是( )A、S CuS B、稀H2SO4(aq) SO2(g) C、浓H2SO4 SO2(g) D、SO2(g)(NH4)2SO3(aq)6. 下图是有关二氧化硫性质的实验装置图,下列说法正确的是( )
A、苹果块会干瘪 B、胆矾晶体表面有“白斑” C、小试管内有晶体析出 D、pH试纸变红5. 在指定条件下,下列选项所示的物质间转化能实现的是( )A、S CuS B、稀H2SO4(aq) SO2(g) C、浓H2SO4 SO2(g) D、SO2(g)(NH4)2SO3(aq)6. 下图是有关二氧化硫性质的实验装置图,下列说法正确的是( ) A、a中紫色石蕊先变红后褪色 B、b中品红溶液褪色,加热后又恢复红色 C、c中氢硫酸溶液出现黄色浑浊,体现的还原性 D、d中溴水褪色,体现了二氧化硫漂白性7. 已知硫酸和氯磺酸结构关系如图:
A、a中紫色石蕊先变红后褪色 B、b中品红溶液褪色,加热后又恢复红色 C、c中氢硫酸溶液出现黄色浑浊,体现的还原性 D、d中溴水褪色,体现了二氧化硫漂白性7. 已知硫酸和氯磺酸结构关系如图: 。下列说法错误的是( ) A、氯磺酸是一元酸 B、氯磺酸中硫元素化合价为+6价 C、氯磺酸遇水会发生反应: D、氯磺酸在HCl作用下可得
。下列说法错误的是( ) A、氯磺酸是一元酸 B、氯磺酸中硫元素化合价为+6价 C、氯磺酸遇水会发生反应: D、氯磺酸在HCl作用下可得 8. 硫及其化合物的分类与相应硫元素的化合价关系如图所示。下列说法正确的是( )
8. 硫及其化合物的分类与相应硫元素的化合价关系如图所示。下列说法正确的是( ) A、葡萄酒中添加适量c可以起到杀菌和抗氧化的作用 B、工业制备f的最后一步是用水吸收d C、将c通入紫色石蕊试液中,溶液先变红后褪色 D、可用f的浓溶液干燥a9. 喷泉实验装置如图所示。应用下列各组气体一溶液,能出现喷泉现象的是( )
A、葡萄酒中添加适量c可以起到杀菌和抗氧化的作用 B、工业制备f的最后一步是用水吸收d C、将c通入紫色石蕊试液中,溶液先变红后褪色 D、可用f的浓溶液干燥a9. 喷泉实验装置如图所示。应用下列各组气体一溶液,能出现喷泉现象的是( )
气体
溶液
A
稀
B
饱和NaOH溶液
C
NO
稀溶液
D
稀盐酸
A、A B、B C、C D、D10. 部分含硫物质的分类与相应化合价关系如图所示。下列说法合理的是( ) A、a可与c发生反应生成b B、b在过量氧气中燃烧生成d C、e溶液和g溶液都能与铜反应 D、h转化为f时,需加入还原剂11. 宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是( )A、 放入水中: B、 通过灼热铁粉: C、铜丝插入热的浓硫酸中: D、 通入酸性 溶液中:12. 常温下,将甲针筒内20mLH2S推入含有10 mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述不正确是(气体在同温同压下测定)( )
A、a可与c发生反应生成b B、b在过量氧气中燃烧生成d C、e溶液和g溶液都能与铜反应 D、h转化为f时,需加入还原剂11. 宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是( )A、 放入水中: B、 通过灼热铁粉: C、铜丝插入热的浓硫酸中: D、 通入酸性 溶液中:12. 常温下,将甲针筒内20mLH2S推入含有10 mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述不正确是(气体在同温同压下测定)( )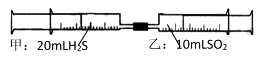 A、有淡黄色固体生成 B、有无色液体生成 C、气体体积缩小 D、最终约余15mL气体13. 硫酸铵无色结晶或白色颗粒,无气味,溶于水,不溶于乙醇和丙酮。硫酸铵在一定温度下分解的化学方程式为:3(NH4)2SO4=3SO2↑+N2↑+4NH3↑+6H2O。下列说法错误的是()A、将分解产生的混合气体,用水充分吸收,生成物中n[(NH4)2SO3]:n(NH4HSO3)=1:2 B、将分解产生的混合气体,通入到BaCl2溶液中能产生白色沉淀 C、将分解产生的混合气体,用足量的浓硫酸充分吸收后,可以收集到纯净的N2 D、将分解产生的混合气体,通入到酸性K2Cr2O7溶液中,涉及氧化还原反应的离子方程式为:Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O14. 根据下列实验操作和现象,得出的结论错误的是( )
A、有淡黄色固体生成 B、有无色液体生成 C、气体体积缩小 D、最终约余15mL气体13. 硫酸铵无色结晶或白色颗粒,无气味,溶于水,不溶于乙醇和丙酮。硫酸铵在一定温度下分解的化学方程式为:3(NH4)2SO4=3SO2↑+N2↑+4NH3↑+6H2O。下列说法错误的是()A、将分解产生的混合气体,用水充分吸收,生成物中n[(NH4)2SO3]:n(NH4HSO3)=1:2 B、将分解产生的混合气体,通入到BaCl2溶液中能产生白色沉淀 C、将分解产生的混合气体,用足量的浓硫酸充分吸收后,可以收集到纯净的N2 D、将分解产生的混合气体,通入到酸性K2Cr2O7溶液中,涉及氧化还原反应的离子方程式为:Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O14. 根据下列实验操作和现象,得出的结论错误的是( ) A、A B、B C、C D、D15. 已知甲、乙、丙和X是4种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是( )
A、A B、B C、C D、D15. 已知甲、乙、丙和X是4种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是( ) A、甲为 ,X是 B、甲为 ,X是 溶液 C、甲为 ,X为 D、甲为 ,X为
A、甲为 ,X是 B、甲为 ,X是 溶液 C、甲为 ,X为 D、甲为 ,X为二、综合题
-
16. 为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:(1)、据汞的原子结构示意图
 , 汞在第周期。 (2)、①叠氮化钠(NaN3)可用于汽车安全气囊的产气药,NaN3在撞击时能发生分解反应生成两种单质。计算理论上65 gNaN3完全分解,释放出标准状况下的气体体积L。
, 汞在第周期。 (2)、①叠氮化钠(NaN3)可用于汽车安全气囊的产气药,NaN3在撞击时能发生分解反应生成两种单质。计算理论上65 gNaN3完全分解,释放出标准状况下的气体体积L。②氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,工业将氧化铝、氮气和碳在一定条件下反应制得AlN和CO,请将下列的化学反应方程式配平。
_Al2O3+_N2+_C—_AlN+_CO
(3)、利用元素的化合价推测物质的性质是化学研究的重要于段。如图是硫元素的“价—类”二维图:
①从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有(填化学式)。
②Z的浓溶液与铁单质在加热条件下可以发生化学反应生成Y,该反应的化学方程式为。
17. 硫是重要的非金属元素,也是人类较早认识的元素之一。下图为硫及其化合物在自然界中的部分转化关系。根据信息,完成下列填空。 (1)、硫元素在自然界中的存在形式(选填编号)
(1)、硫元素在自然界中的存在形式(选填编号)a.只有游离态b.只有化合态c.既有游离态也有化合态
(2)、下列关于的说法正确的是(选填编号)a.是无色无味的有毒气体b.与反应生成不稳定的
c.有毒,不能用作食品加工d.气体通入溶液中产生白色沉淀
工业上常用漂白纸浆、毛、丝等,时间久了,漂白过的物质会发黄。简述原因。
(3)、请写出过程①发生反应的化学方程式,并标出电子转移的方向和数目。(4)、浓硫酸是一种重要的无机酸①浓硫酸在空气中放置一段时间后浓度变小,体现了浓硫酸的(选填编号)。
a.吸水性b.挥发性c.脱水性d.强酸性
②利用现象,工业上用铁或铝制容器盛装冷的浓硫酸。
③浓硫酸在使下列物质发生转化时,只表现出强氧化性的是(选填编号)。
a.b.c.C→
(5)、金属离子可以与硫酸根结合形成硫酸盐,下列硫酸盐的化学式不正确的是(选填编号)a.明矾:b.重晶石:c.胆矾:
请书写溶于水的电离方程式。
18. 硫酸是实验室和工业常用试剂。(1)、工业储存运输浓硫酸可以使用金属容器(填编号,下同)。a.铁 b.镁 c.锌
(2)、如图是硫酸试剂瓶标签上的部分内容,该硫酸的浓度是;实验人员操作时不必需穿戴的安全用具是
a.防护手套 b.实验服 c.防毒面具 d.护目镜
(3)、实验室中向烧杯内加入约20g蔗糖,向其中插入玻璃棒,滴加几滴蒸馏水,再加入适量浓硫酸。试回答下列问题:①该实验除有刺激性气味的气体产生外,还可能有现象;
②将产生的气体通入品红溶液,红色褪去,判断该气体中含有(写化学式),将产生气体先通过足量酸性高锰酸钾溶液,再通过澄清石灰水,石灰水变浑浊,判断该气体中还含有(写化学式),写出产生该混合气体的化学方程式;
③研究人员将产生的上述混合气体通入溶液,无明显现象,再通入氯气,则可观察到白色沉淀出现。试解释出现白色沉淀的原因。
④实验结束吸收尾气应该选用的装置是 , 烧杯中盛放的试剂是。
 19. 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
19. 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系: (1)、X的化学式是;从硫元素的化合价变化角度分析,图中Y与H2O2的反应时,Y体现了性(填“氧化”或“还原”);写出检验物质Y的一种方法是。(2)、Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为。(3)、Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是____(填字母)。A、Na2S+S B、Na2SO3+S C、SO2+Na2SO4 D、Na2SO3+Na2SO4(4)、已知Na2SO3能被K2Cr2O7氧化为Na2SO4 , 则24mL0.05mol·L-1的Na2SO3溶液与20mL0.02mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为。20. 依据图中硫元素及其化合物的转化关系,回答问题:
(1)、X的化学式是;从硫元素的化合价变化角度分析,图中Y与H2O2的反应时,Y体现了性(填“氧化”或“还原”);写出检验物质Y的一种方法是。(2)、Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为。(3)、Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是____(填字母)。A、Na2S+S B、Na2SO3+S C、SO2+Na2SO4 D、Na2SO3+Na2SO4(4)、已知Na2SO3能被K2Cr2O7氧化为Na2SO4 , 则24mL0.05mol·L-1的Na2SO3溶液与20mL0.02mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为。20. 依据图中硫元素及其化合物的转化关系,回答问题: (1)、图中,请写出反应①的离子方程式。(2)、图中,X的化学式为 , 从化合价上看,X具有(填数字)
(1)、图中,请写出反应①的离子方程式。(2)、图中,X的化学式为 , 从化合价上看,X具有(填数字)①氧化性;②还原性
(3)、图中,W在医疗上可用作石膏绷带,关于它的用途还有(填数字)。①在工业上,可来调节水泥的硬化速率 ②在食品中,可用来作营养强化剂
③在美术上,可用来制作各种模型 ④在日常生活中,“卤水点豆腐”
(4)、反应③可表示为H2S+Cl2=2HCl+S↓,当生成1molS时,转移的电子为mol。也可表示为2H2S+SO2=3S↓+2H2O,当生成1molS时,转移的电子为mol。(5)、SO2可使酸性高锰酸钾溶液褪色,体现了(填数字)①氧化性;②还原性;③漂白性。
请写出该反应的化学方程式:。